Dispense prodotte nel corso POF Giochi della Chimica
























- Slides: 30

Dispense prodotte nel corso POF “Giochi della Chimica 2012” II Lezione

Variabili o parametri di stato. • In termodinamica lo stato di un sistema è definito da un punto di vista macroscopico, per mezzo di alcune proprietàche possono rappresentarlo nel suo complesso. Le grandezze di interesse termodinamico sono la temperatura, la pressione, il volume, la densità, eventualmente la concentrazione dei singoli elementi chimici, se in un sistema ne sono presenti più d'uno, ecc. • Chiameremo queste grandezze variabili o parametri di stato. • Se si considera un sistema costituito da una certa quantità di gas chimicamente puro, le sue variabili termodinamiche sono il volume V, la pressione p e la temperatura t. Queste grandezze non sono indipendenti fra loro. In altre parole, i tre parametri di stato di un sistema gassoso sono legati da una relazione che ci permette di determinare uno qualsiasi di essi quando siano noti gli altri due. • Pertanto, lo stato termodinamico di una certa quantità di gas è completamente definito dai valori di due qualsiasi delle variabili V, p e t.

Gas ideali o gas perfetti Per gas ideale si intende un gas che possieda le seguenti proprietà (modello di gas ideale) • le molecole sono puntiformi, per cui il volume delle particelle è trascurabile in confronto al volume totale entro il quale sono libere di muoversi. • interagiscono tra loro e con le pareti del recipiente mediante urti perfettamente elastici (non vi è dispersione di energia durante gli urti); • non esistono forze di interazione a distanza tra le molecole del gas; • le molecole del gas sono identiche tra loro e indistinguibili. • l’energia cinetica media (dovuta al moto) e la velocità delle particelle sono direttamente proporzionali alla temperatura assoluta del gas. In un gas reale la situazione è generalmente più complessa, Ad esempio esistono, se pur deboli, delle forze di coesione che agiscono soprattutto a basse temperature e a pressioni elevate. Il comportamento di un gas reale può essere assimilato a quello di un gas perfetto quando è molto rarefatto e quando di è lontani dalla temperatura critica, cioè da quel valore di temperatura al di sotto del quale il gas diventa liquido con adeguata compressione

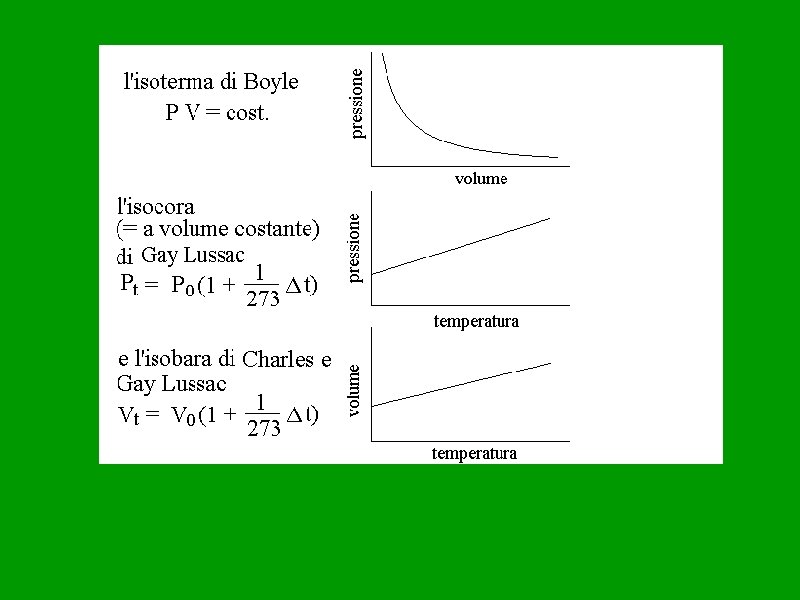
Le leggi dei gas Il comportamento di un gas perfetto è completamente definito da tre variabili indipendenti, dette variabili di stato, che sono la pressione (simbolo p) che il gas esercita sul recipiente, il volume (simbolo V) occupato dal gas e la temperatura (simbolo T, misurata in kelvin). Le relazioni tra le variabili di stato, dette leggi dei gas, definiscono completamente il comportamento di un gas in tutte le situazioni fisiche. Mantenendo costante una delle tre grandezze, e variando le altre due, si ottengono le tre leggi empiriche dei gas perfetti, ricavate sperimentalmente prima del XVIII secolo. Una trasformazione che avviene in un gas mantenendo costante la sua temperatura, e facendo variare pressione e volume, si dice trasformazione isoterma; una trasformazione a pressione costante si dice isobara, mentre una trasformazione a volume costante si dice isocora.

Gay Lussac Charles e

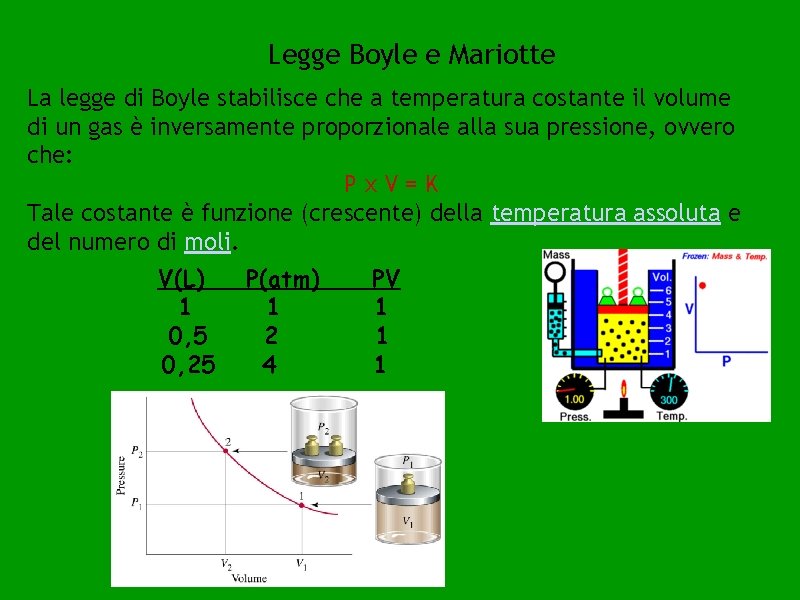
Legge Boyle e Mariotte La legge di Boyle stabilisce che a temperatura costante il volume di un gas è inversamente proporzionale alla sua pressione, ovvero che: Px. V=K Tale costante è funzione (crescente) della temperatura assoluta e del numero di moli. V(L) 1 0, 5 0, 25 P(atm) 1 2 4 PV 1 1 1

Legge di Charles (o prima legge di Gay Lussac o legge isobara dei gas) La legge di Charles fu ricavata come legge di dilatazione dei gas allorché Charles scoprì che tutti i gas (supposti a comportamento ideale), a pressione costante, subiscono la stessa dilatazione all'aumentare della temperatura, secondo una legge data dalla relazione: V(t) = V 0(1 + αt) (P = costante) dove la temperatura è misurata in gradi centigradi, V 0 è il volume del gas a t = 0 °C e α è il coefficiente di dilatazione termica del gas uguale numericamente a 1/273, 15. Secondo questa formulazione deve esistere una temperatura limite (inferiore a 0 °C) tale per cui il gas non occupa alcun volume. Tale temperatura si può ricavare trovando il valore di t per il quale V(t)=0. Si ottiene: t = -273, 13 °C pari al valore T = 0 K nella scala Kelvin, detta anche scala delle temperature assolute. Se si misura la temperatura in gradi Kelvin (temperatura assoluta), la legge di Charles assume la forma più semplice: V(T) = V 0 α T (P = costante) In cui si nota che a pressione costante il volume di un gas è direttamente proporzionale alla sua temperatura assoluta Da quest’ultima equazione possiamo ricavare una forma della legge di Charles più utile per i calcoli: V 1 / T 1 = V 2 / T 2 (P = costante) Nella quale T è espressa in gradi Kelvin.

Legge di Gay Lussac (o seconda legge di Gay Lussac o legge isocora dei gas) La legge di Gay Lussac dice che a volume costante, la pressione aumenta linearmente con la temperatura, secondo una legge data dalla relazione: p(t) = p 0(1 + αt) V = costante) dove la temperatura è misurata in gradi centigradi, p 0 è la pressione del gas a t = 0 °C e α è il coefficiente di dilatazione termica del gas uguale numericamente a 1/273, 15. Secondo questa formulazione deve esistere una temperatura limite (inferiore a 0 °C) tale per cui il gas ha pressione uguale a zero. Tale temperatura si può ricavare trovando il valore di t per il quale p(t)=0. Si ottiene: t = -273, 13 °C pari al valore T = 0 K nella scala Kelvin, detta anche scala delle temperature assolute. Se si misura la temperatura in gradi Kelvin (temperatura assoluta), la legge di Gay Lussac assume la forma più semplice: p(T) = p 0 α T (V = costante) In cui si nota che a volume costante la pressione di un gas è direttamente proporzionale alla sua temperatura assoluta Da quest’ultima equazione possiamo ricavare una forma della legge di Gay Lussac più utile per i calcoli: p 1 / T 1 = p 2 / T 2 (v = costante) Nella quale T è espressa in gradi Kelvin.

EQUAZIONE DI STATO DEI GAS Questa equazione lega insieme tutti e tre i parametri: pressione, volume e temperatura. La sua formulazione è la seguente: PV = n. RT dove n è il numero di moli del gas, T è la temperatura in gradi Kelvin R è la costante universale dei gas il cui valore varia in funzione delle unità di misura adottate per esprimere le altre grandezze nell'equazione R = 8, 314472 Joule/(moli x gradi Kelvin), nel Sistema Internazionale R = 0, 0821 (litri x atmosfere) / (moli x gradi Kelvin) Nei calcoli pratici, questa equazione viene usata nella forma: P 1 V 1 / T 1 = P 2 V 2 / T 2 (ricordiamo sempre che in questa formula dobbiamo esprimere T in gradi Kelvin).

LEGGE DI AVOGADRO: Volumi uguali di gas diversi, a parità di pressione e temperatura, contengono lo stesso numero di molecole. Per esempio, a parità di condizioni di pressione e temperatura, un litro di Ossigeno o un litro di Cloro, contengono lo stesso numero di molecole. La legge di Avogadro implica anche a pressione e temperatura costanti, il volume di un gas è direttamente proporzionale al suo numero di molecole. Inoltre tenendo in considerazione la legge di combinazione dei volumi di Gay Lussac (il rapporto tra i volumi di gas che reagiscono tra loro è espresso da numeri interi e piccoli), la legge di Avogadro implica che la materia possa essere costituita da molecole. Ad esempio 3 volumi di idrogeno di combinano con 1 volume di azoto per formare 2 volumi di ammoniaca. Poiché gli atomi entrano in combinazione come unità intere, i due volumi di ammoniaca saranno necessariamente costituiti da N 2 e i 3 volumi di idrogeno saranno costituiti da H 2. La reazione sarà quindi 3 H 2+N 2=2 NH 3 Se i gas fossero allo stato monoatomico la reazione tra tre volumi di ammoniaca e 1 volume di azoto porterebbe ad un solo volume di NH 3. 3 H + N = NH 3

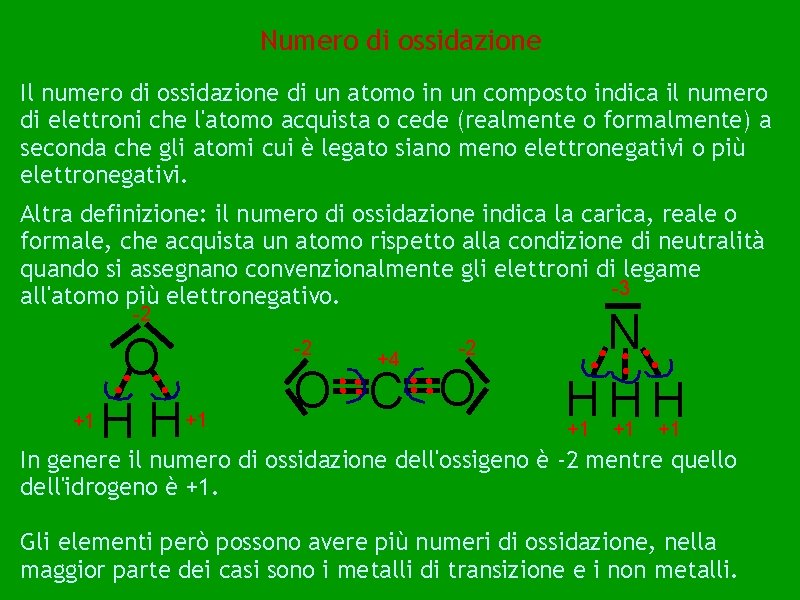
Numero di ossidazione Il numero di ossidazione di un atomo in un composto indica il numero di elettroni che l'atomo acquista o cede (realmente o formalmente) a seconda che gli atomi cui è legato siano meno elettronegativi o più elettronegativi. Altra definizione: il numero di ossidazione indica la carica, reale o formale, che acquista un atomo rispetto alla condizione di neutralità quando si assegnano convenzionalmente gli elettroni di legame -3 all'atomo più elettronegativo. -2 O +1 H H +1 -2 +4 -2 O C O N H H H +1 +1 +1 In genere il numero di ossidazione dell'ossigeno è -2 mentre quello dell'idrogeno è +1. Gli elementi però possono avere più numeri di ossidazione, nella maggior parte dei casi sono i metalli di transizione e i non metalli.

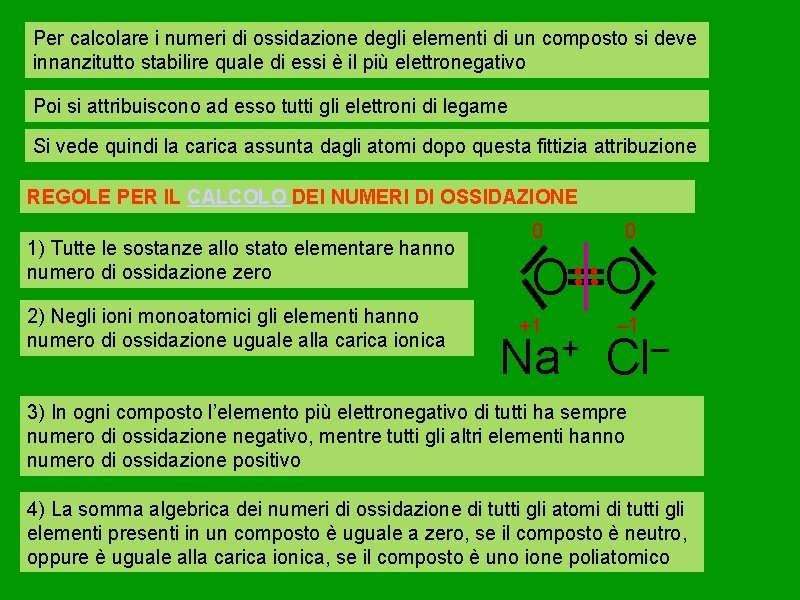
Per calcolare i numeri di ossidazione degli elementi di un composto si deve innanzitutto stabilire quale di essi è il più elettronegativo Poi si attribuiscono ad esso tutti gli elettroni di legame Si vede quindi la carica assunta dagli atomi dopo questa fittizia attribuzione REGOLE PER IL CALCOLO DEI NUMERI DI OSSIDAZIONE 1) Tutte le sostanze allo stato elementare hanno numero di ossidazione zero 2) Negli ioni monoatomici gli elementi hanno numero di ossidazione uguale alla carica ionica 0 0 O O +1 + Na – 1 – Cl 3) In ogni composto l’elemento più elettronegativo di tutti ha sempre numero di ossidazione negativo, mentre tutti gli altri elementi hanno numero di ossidazione positivo 4) La somma algebrica dei numeri di ossidazione di tutti gli atomi di tutti gli elementi presenti in un composto è uguale a zero, se il composto è neutro, oppure è uguale alla carica ionica, se il composto è uno ione poliatomico

5) Alcuni elementi mantengono costante il loro numero di ossidazione in tutti i composti che formano, mentre altri lo variano da un composto all’altro In generale i numeri di ossidazione seguono il seguente schema: a) L’idrogeno ha sempre numero di ossidazione +1 oppure -1; b) I metalli hanno solo numeri di ossidazione positivi; c) I non metalli possono avere numeri di ossidazione positivi o negativi; d) Tranne alcune eccezioni gli elementi di gruppi pari hanno solo numeri di ossidazione pari, mentre quelli dei gruppi dispari hanno solo numeri di ossidazione dispari; e) Per tutti gli elementi, il numero di ossidazione positivo il più alto corrisponde al numero del gruppo cui l’elemento appartiene. Per quanto detto sopra, gli altri numeri di ossidazione si ottengono riducendo di 2, 4 o 6 unità il numero di ossidazione più alto.

Composti inorganici e nomenclatura Nomenclatura tradizionale: Prevede l’uso di prefissi e suffissi, in base al numero di ossidazione dei vari elementi Il nome del composto dipende dal numero di ossidazione degli elementi nel composto. Nel caso di 2 diversi numeri di ossidazione: • desinenza -oso, per il numero di ossidazione minore (ferroso, rameoso, piomboso) • desinenza -ico, per il numero di ossidazione maggiore (ferrico, rameico, piombico) Nel caso in cui vi siano più di 2 numeri di ossidazione si usa questa nomenclatura: • +1 o +2; ipo- -oso, acido ipocloroso • +3 o +4; -oso, acido cloroso • +5 o +6; -ico, acido clorico • +7; per- -ico, acido perclorico

Nomenclatura ufficiale (o IUPAC): Si indica il numero di atomi di ogni elemento presenti all’interno del composto, tramite prefissi di origine greca; quando è presente un solo atomo di un elemento non si utilizza alcun prefisso In alcuni casi il numero di ossidazione viene indicato tra parentesi a fianco del nome del composto n° atomi prefisso 2 bi (o di) 3 tri 4 tetra 5 penta 6 esa 7 epta Alcuni nomi tradizionali, fortemente radicati nell’uso comune, quali acqua, ammoniaca (NH 3) o metano (CH 4), sono stati accettati come internazionalmente validi.

Ossidi Gli ossidi sono composti binari formati dalla combinazione di un elemento (tranne i gas nobili e il fluoro) con l'ossigeno. Esistono gli ossidi dei metalli, ossidi basici; e gli ossidi dei non metalli, ossidi acidi o anidridi. Ossidi basici Composti binari formati dall’unione di un metallo con l’ossigeno. Poiché l’ossigeno è molto più elettronegativo dei metalli, tutti gli ossidi sono composti ionici e quindi solidi a temperatura ambiente Nomenclatura tradizionale a) • se il metallo ha un solo numero di ossidazione: ossido di + nome metallo (es. ossido di sodio Na 2 O) b) se il metallo ha due numeri di ossidazione: • ossido + nome metallo con desinenza OSO, per il numero di ossidazione minore. Ad es. ossido piomboso Pb. O (numero di ossidazione +2); • ossido + nome metallo con desinenza ICO, per il numero di ossidazione maggiore. Ad es. ossido piombico Pb. O 2 (numero di ossidazione +4). Nomenclatura ufficiale Si conta il numero di atomi di ogni elemento e si utilizzano i relativi prefissi, insieme al termine “ossido di”. Ad es. Na 2 O ossido di disodio; Pb. O ossido di piombo (+2); Pb. O 2 biossido di piombo (+4); se il metallo ha più numeri di ossidazione, al nome del metallo si fa seguire il numero di ossidazione messo tra parentesi

Anidridi o ossidi acidi: Composti binari formati dall’unione di un non metallo con l’ossigeno La differenza di elettronegatività tra l’ossigeno e non metalli è piccola; le anidridi sono quindi composti covalenti più o meno polari, che a temperatura ambiente possono essere solidi, liquidi o gassosi. Nomenclatura tradizionale a) se il non metallo ha un solo numero di ossidazione: anidride + nome non metallo con desinenza ICA (es. anidride carbonica CO 2) b) se il non metallo ha due numeri di ossidazione: anidride + nome non metallo con desinenza OSA, per il numero di ossidazione minore. Ad es. anidride solforosa SO 2 (+4); anidride + nome non metallo con desinenza ICA, per il numero di ossidazione maggiore. Ad es. anidride solforica SO 3 (+6). c) se il non metallo ha quattro numeri di ossidazione, come gli elementi del 7° gruppo (+1, +3, +5, +7): anidride IPO nome non metallo con desinenza OSA per il numero di ossidazione +1. Es. Cl 2 O anidride ipoclorosa; anidride + nome non metallo con desinenza OSA, per il numero di ossidazione +3. Es. anidride clorosa Cl 2 O 3; anidride + nome non metallo con desinenza ICA, per il numero di ossidazione +5. Es. anidride clorica Cl 2 O 5; anidride PER nome non metallo con desinenza ICA per il numero di ossidazione +7. Es. Cl 2 O 7 anidride perclorica;

Nomenclatura ufficiale Anche i composti tra ossigeno e non metalli sono chiamati ossidi; si utilizzano sempre i prefissi relativi al numero di atomi degli elementi. Ad esempio: SO 2 biossido di zolfo (+4); SO 3 triossido di zolfo (+6)¸ Cl 2 O ossido di dicloro (+1); Cl 2 O 3 triossido di dicloro (+3); Cl 2 O 5 pentaossido di dicloro (+5); Cl 2 O 7 eptaossido di dicloro (+7). Se il metallo ha più numeri di ossidazione, al nome del non metallo si fa seguire il numero di ossidazione messo tra parentesi,

Idracidi Sono composti binari formati da H (idrogeno) e uno dei seguenti non metalli S (zolfo), Se (selenio), F (fluoro), Cl (cloro), Br (bromo) e I (iodio). Questi composti possono essere sciolti in acqua e in questo caso si comportano come acidi. Sono composti covalenti polari ed a temperatura ambiente sono tutti gassosi, tranne HF, che è liquido a causa del legame a ponte di idrogeno. Il nome tradizionale viene attribuito aggiungendo la desinenza -idrico alla radice del nome del non metallo, preceduto dalla parola acido. Il nome IUPAC è formato dal nome non metallo, terminante in URO, seguito da “di idrogeno”; il numero degli atomi di idrogeno viene indicato da un prefisso prima della parola “idrogeno” : HF fluoruro di idrogeno; HCl cloruro di idrogeno; HBr bromuro di idrogeno; HI ioduro di idrogeno; H 2 S solfuro di diidrogeno; H 2 Se seleniuro di didrogeno

Idrossidi o basi. Composti ionici ternari (ovvero tre elementi) formati da un catione metallico (numero ossidazione +) e da tanti ioni idrossido (OH-) quanti ne occorrono per neutralizzare la carica del catione. es. idrossido di calcio Ca(OH)2 Gli idrossidi si preparano facendo reagire gli ossidi basici con l'acqua. Gli idrossidi sono tutti composti ionici e quindi solidi a temperatura ambiente. La nomenclatura tradizionale in questo caso si ottiene sostituendo la parola idrossido a quella dell'ossido corrispondente. Per la nomenclatura IUPAC Si indica il numero dei gruppi ossidrile ponendo i soliti prefissi davanti al termine “idrossido”, cui segue “di” ed il nome del metallo; se il metallo ha più numeri di ossidazione, al nome del metallo si fa seguire il numero di ossidazione messo tra parentesi Na(OH) idrossido di sodio; Fe(OH)2 diidrossido di ferro (+2); Fe(OH)3 triidrossido di ferro (+3); Pb(OH)4 tetraidrossido di piombo (+4).

Ossiacidi ossigenati Composti ternari molecolari formati da idrogeno, un non metallo oppure un metallo di transizione e ossigeno, scritti nella formula in quest'ordine. Sono composti covalenti polari solidi o liquidi a temperatura ambiente Derivano dalla reazione tra anidridi e acqua (tutti gli elementi mantengono il proprio numero di ossidazione); inoltre nella formula dell’ossiacido il non metallo è presente, tranne qualche eccezione, sempre con un solo atomo La nomenclatura tradizionale deriva da quella degli anidridi, sostituendo alla parola anidridi la parola acido mantenendo invariati prefissi e desinenze. es. acido borico; acido carbonico. . . Per la nomenclatura IUPAC, al temine acido si attribuisce un aggettivo riferito al numero di atomi di ossigeno presenti nell’acido ed al nome del non metallo, terminante in ICO; segue poi, tra parentesi, il numero di ossidazione del non metallo • Ad es. HCl. O acido ossoclorico (+1); HCl. O 2 acido diossoclorico (+3); • HCl. O 3 acido triossoclorico (+5); HCl. O 4 acido tetraossoclorico (+7); • H 2 SO 4 acido tetraossosolforico (+6); H 2 SO 3 acido triossosolforico (+4)

Sali Sono composti ionici formalmente derivati dagli acidi per sostituzione totale o parziale degli atomi di idrogeno con uno o più cationi metallici. Per scrivere la formula del sale, (che è un composto neutro) si deve considerare che la somma delle cariche positive dei cationi (derivanti dalla dissociazione degli idrossidi) dovrà essere uguale alla somma delle cariche negative degli anioni (derivanti dalla dissociazione degli acidi).

Nomenclatura degli anioni monoatomici In entrambe le nomenclature il nome dell’anione monoatomico si ottiene aggiungendo la desinenza uro al nome del non metallo. F- anione fluoruro; Cl- anione cloruro; Br- anione bromuro; I- anione ioduro; S 2 - anione solfuro; Se 2 - anione seleniuro.

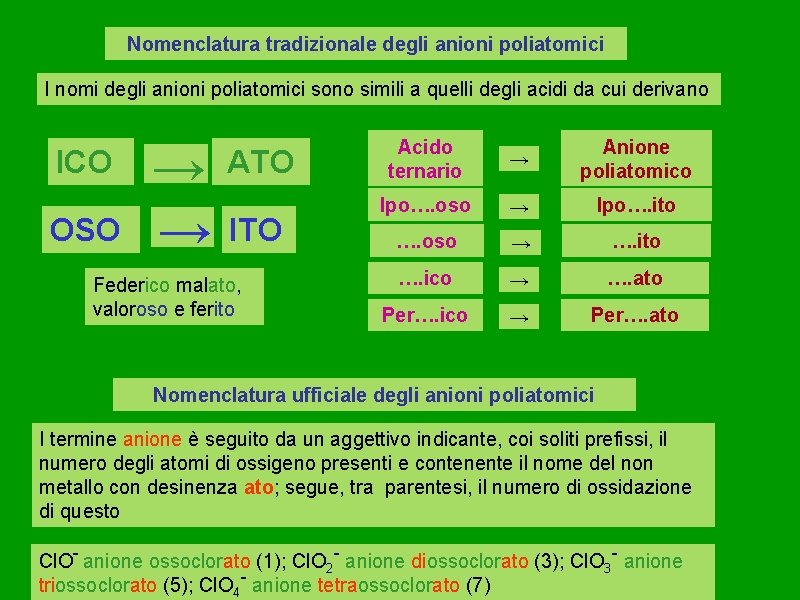
Nomenclatura tradizionale degli anioni poliatomici I nomi degli anioni poliatomici sono simili a quelli degli acidi da cui derivano ICO OSO → ATO → ITO Federico malato, valoroso e ferito Acido ternario → Anione poliatomico Ipo…. oso → Ipo…. ito …. oso → …. ito …. ico → …. ato Per…. ico → Per…. ato Nomenclatura ufficiale degli anioni poliatomici I termine anione è seguito da un aggettivo indicante, coi soliti prefissi, il numero degli atomi di ossigeno presenti e contenente il nome del non metallo con desinenza ato; segue, tra parentesi, il numero di ossidazione di questo Cl. O- anione ossoclorato (1); Cl. O 2 - anione diossoclorato (3); Cl. O 3 - anione triossoclorato (5); Cl. O 4 - anione tetraossoclorato (7)

SALI BINARI Sono composti ionici, formati da un metallo e da un non metallo, che derivano dalla reazione tra un acido binario ed un idrossido Nomenclatura tradizionale a) se il metallo ha un solo numero di ossidazione: nome non metallo terminante in URO + di nome metallo Ad es. cloruro di sodio (Na. Cl), fluoruro di potassio (KF); b) se il metallo ha due numeri di ossidazione: nome non metallo terminante in URO + nome metallo con desinenza OSO, per il numero di ossidazione minore. Ad es. cloruro ferroso Fe. Cl 2 (+2); nome non metallo terminante in URO + nome metallo con desinenza ICO, per il numero di ossidazione maggiore. Ad es. cloruro ferrico Fe. Cl 3 (+3). Nomenclatura IUPAC Si scrive il nome del non metallo, terminante in URO, cui segue di ed il nome del metallo; ciascuno nome viene preceduto dai soliti prefissi riferiti al numero di atomi di ciascun elemento. Ad esempio: Fe. Cl 2 dicloruro di ferro; Fe. Cl 3 tricloruro di ferro; Na. Cl cloruro di sodio; Al 2 S 3 trisolfuro di dialluminio; Li 2 S solfuro di dilitio.

SALI TERNARI Sono composti ionici, formati da metallo, non metallo ed ossigeno, che derivano dalla reazione tra un acido ternario ed un idrossido Nomenclatura tradizionale Si indica per primo il nome dell’anione poliatomico derivante dalla decomposizione dell’acido, cui segue il nome del catione metallico • Se il metallo ha un solo numero di ossidazione lo si indica con di + nome metallo • Se il metallo ha due numeri di ossidazione si utilizzano le solite desinenze OSO per il numero di ossidazione minore ed ICO per il numero di ossidazione maggiore. Nomenclatura ufficiale Nome del non metallo, terminante in ATO (seguito tra parentesi dal suo numero di ossidazione), + di ed il nome del metallo (seguito tra parentesi dal suo numero di ossidazione, qualora ne abbia più di uno). Il nome del non metallo viene preceduto da un prefisso indicante il numero di atomi di ossigeno (diosso, triosso ecc) presenti nell’anione e viene dal numero di ossidazione del non metallo; il nome del metallo viene seguito da un prefisso (di, tri. . ) indicante il numero dei cationi e seguito dal numero di ossidazione del metallo Es. Na 2 SO 3 triossosolfato (4) di di sodio

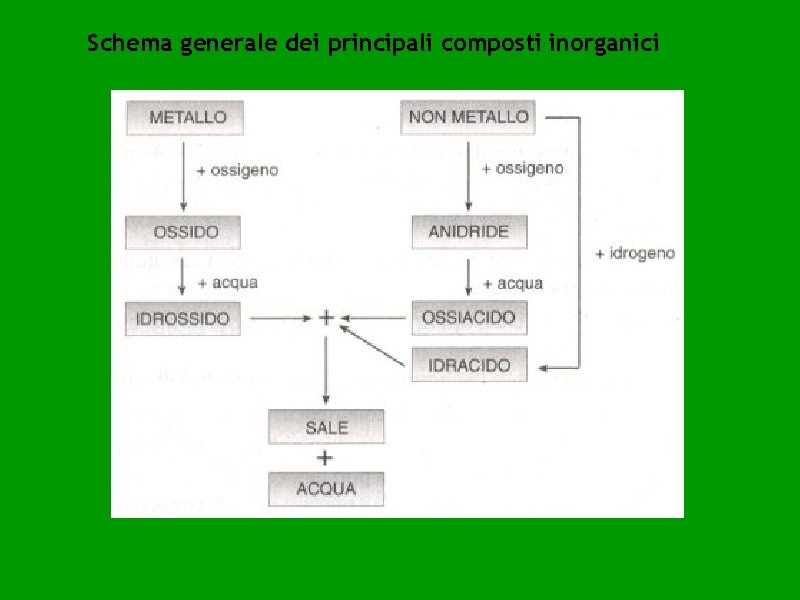
Schema generale dei principali composti inorganici

Formule chimiche Esistono diversi tipi di formule: • Formula bruta: formula che indica esclusivamente il tipo e il numero di atomi che compongono la molecola. • Formula di struttura: indica la disposizione spaziale degli atomi della molecola, mostrando come gli atomi sono legati tra loro e con quale tipo di legame

Nella formula minima il numero degli atomi di ciascun elemento che formano il composto sono nel rapporto minimo di combinazione E' possibile calcolare la formula minima di una molecola se si conosce la percentuale in peso di ogni elemento:

Per conoscere la percentuale dei singoli elementi in un composto ho bisogno di conoscere quanti atomi di ciascun elemento sono presenti nella molecola
 Le proprietà colligative
Le proprietà colligative Dispense del corso di sistemi energetici
Dispense del corso di sistemi energetici Edvard munch sera nel corso karl johann
Edvard munch sera nel corso karl johann Il racconto della chimica e della terra soluzioni
Il racconto della chimica e della terra soluzioni Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Moti millenari della terra zanichelli
Moti millenari della terra zanichelli Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Il racconto della chimica e della terra
Il racconto della chimica e della terra Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra What is the language in
What is the language in Gay pof
Gay pof Gkmen
Gkmen Pol pof
Pol pof Gcse pof
Gcse pof Pof eugene
Pof eugene Porbqu
Porbqu La questione della lingua nel 600
La questione della lingua nel 600 Circonferenza nel piano cartesiano
Circonferenza nel piano cartesiano Slide antincendio
Slide antincendio Tutor magistralis dispense
Tutor magistralis dispense Project management dispense
Project management dispense This is the centerpiece of any pouring station
This is the centerpiece of any pouring station Non charged floor stock drug list
Non charged floor stock drug list Ez dispense
Ez dispense Generatori di vapore dispense
Generatori di vapore dispense Galvin group
Galvin group Elettrochimica
Elettrochimica Terza legge ponderale di dalton
Terza legge ponderale di dalton Leggi ponderali zanichelli
Leggi ponderali zanichelli Soluzioni chimica più capitolo 17
Soluzioni chimica più capitolo 17