Nuestro Grupo Haals 2005 del colegio San Ignacio






































- Slides: 39

Nuestro Grupo “Haals 2005” del colegio “San Ignacio de Loyola” de 3 ro de secundaria integrados por: - Horna Pingo, Carlos López Carrión, Jean Ato Cadenas, Diego Alva Bayona, Erick Les vamos a dar a conocer las funciones químicas inorgánicas Empezar

FUNCIONES QUÍMICAS INORGÁNICAS

FUNCIONES QUÍMICAS INORGÁNICAS 1. - Hidruros - Metálicos - No Metálicos 2. - Óxidos - Básicos - Ácidos 3. - Óxidos especiales. 4. - Hidróxidos 5. - Ejercicios desarrollados y propuestos 6. - Evaluación del usuario

Hidruros Los hidruros son compuestos binarios formados por átomos de Hidrógeno y de otro elemento, y hay dos tipos: • Hidruros Metálicos: Se forman cuando el hidrógeno se combina con un metal. En éstos compuestos el HIDRÓGENO actúa con estado de oxidación: -1. Ver más • Hidruros No Metálicos: Son aquellos que se forman de la Combinación del Hidrógeno y de un elemento No Metálico. Ver más

Hidruros Metálicos Vamos a dar a conocer algunos ejemplos para entender mejor los Hidruros metálicos • Cu. H: monohidruro de cobre » • Hg. H 2: dihidruro de mercurio » • Cu. H: hidruro de cobre(I) » • Hg. H 2: hidruro de mercurio(II) » • Cu. H: hidruro cuproso » • Hg. H 2: hidruro mercúrico » N. St N. T N. S = Nomenclatura Sistemática N. St = Nomenclatura Stock N. T = Nomenclatura Tradicional

Hidruros No Metálicos Vamos a dar a conocer algunos ejemplos para entender mejor los Hidruros No Metálicos • BH 3: trihidruro de boro o borano • NH 3: trihidruro de nitrógeno o amoniaco • As. H 3: trihidruro de arsénico o arsina • PH 3: trihidruro de fósforo o fosfina

Óxidos Un Óxido se obtiene de la combinación de Oxigeno (O) y de un elemento Químico. Existen 2 tipos de óxidos: • Óxidos Básicos: Los Óxidos básicos se obtienen de la combinación de Oxigeno (O) y un Metal. Ver más • Óxidos Ácidos: Los Óxidos Ácidos se obtienen de la combinación de oxigeno (O) y un No Metal. Ver más

Óxidos Básicos Si el metal con el que se combina tiene una sola valencia se nombran con las palabras óxido de, y el nombre del metal con el que se combina. Ejemplos: • Ca. O------Óxido de Calcio. • Na 2 O-----Óxido de Sodio. Si el metal con el que se combina tiene 2 valencias, se pone como en el de valencia 1 pero el nombre del metal acaba en oso cuando actúa con la valencia menor y en ico cuando actua con la valencia mayor y se le quita el prefijo de. Ejemplos: • Fe. O------Óxido ferroso • Fe 2 O 3 ------Óxido férrico

Óxidos Ácidos Al igual que los óxidos básicos, si tiene una sola valencia se nombran con las palabras óxido de y si tiene más de dos valencias se nombran con los prefijos –oso y –ico. Veamos algunos ejemplos: • H 2 CO 3 ----------Acido Carbónico • P 2 O 3 ----------Oxido Fosforoso • P 2 O 5 ----------Oxido Fosfórico • SO 3 ----------Oxido sulfúrico • N 2 O 3 ---------Oxido nitroso

Óxidos especiales Son compuestos binarios del Oxígeno, generalmente con un metal, en los que aparece el anión peroxo. Aparentemente el oxígeno funciona con la valencia 1. Se nombran según el óxido del que provienen. Ejemplos:

HIDRÓXIDOS OXIDO BASICO + AGUA = HIDROXIDO Un óxido básico reacciona con AGUA para dar una nueva sustancia que se denomina Hidróxido o Base, pero cuando un óxido ácido se combina con agua se obtiene un ácidos oxácidos.

NOMENCLATURA TRADICIONAL Hidróxido del metal, utilizando los prefijos oso e ico cuando el metal presenta mas de un estado de oxidación posible. (oso si el estado de oxidación que está usando el elemento es el menor de los que tiene e ico viceversa si está usando el mayor de ellos) Ejemplos: Na. OH → (hidróxido de sodio) Ca(OH)2 → (Hidróxido de calcio) Fe(OH)2 → (dióxido ferroso) Cu. OH → (hidróxido cuproso) Fe(OH)3 → (hidróxido férrico) Cu(OH)2 → (hidróxido cùprico)

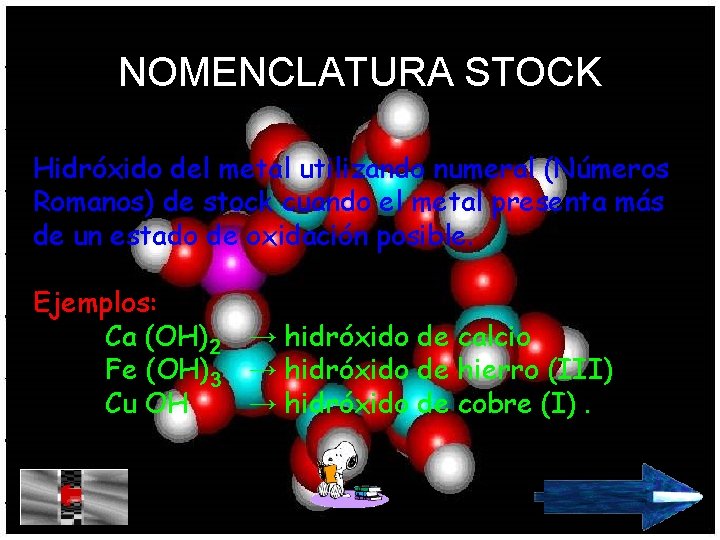
NOMENCLATURA STOCK Hidróxido del metal utilizando numeral (Números Romanos) de stock cuando el metal presenta más de un estado de oxidación posible. Ejemplos: Ca (OH)2 → hidróxido de calcio Fe (OH)3 → hidróxido de hierro (III) Cu OH → hidróxido de cobre (I).

NOMENCLATURA IUPAC Prefijos indicando la cantidad de iones oxidrilos presentes en el compuesto. Ejemplos: Ø Cu(OH)2 (dihidróxido de cobre), Ø Na. OH (monohidróxido de sodio), Ø Fe(OH)3 (Trihidróxido de hierro). Se reemplaza la palabra ÓXIDO por la palabra HIDRÓXIDO. Ejemplo: ØAl 2 O 3 óxido de aluminio → Al(OH)3 hidróxido de aluminio ØFe. O óxido ferroso → Fe(OH)2 hidróxido ferroso

A que función pertenecen los siguientes compuestos: Óxido mercúrico : Óxido Básico Hidruro de plata : Hidruro Metálico Hidróxido de cobalto (III) : Hidróxido Metálico Óxido de carbono (II) : Óxido Metálico Ácido clorhídrico : Hidruro No Metálico

ESCRIBE LA FÓRMULA DE LOS SIGUIENTES COMPUESTOS Óxido de calcio : Ca. O 2 Trióxido de telurio : Te. O 3 Hidruro de zinc : Zn. H 2 Hidróxido de plomo (II) : Pb(OH)2 Hidróxido de platino (IV) : Pt(OH)4

Indica el estado de oxidación de los elementos metales o no metales en las siguientes fórmulas. Ra. O : Ra +2. O -2 Ni 2 O 3 : NI +3 O -2 Pb. H 4 : Pb +4 H -1 HCl : H +1 Cl -1 Pt(OH)4 : Pt +4 (OH) -1

Escribe la nomenclatura tradicional de : Ca. O Pt. H 4 H 2 S Pb(OH)4 Cu(OH)2 Óxido Cálcico Hidruro Platínico Sulfuro de Hidrógeno Hidróxido Plúmbico Hidróxido de cúprico

Sopa de Letras Resolver esta de sopa de letras en casa ( puedes imprimirla ).


1. 2. 3. 4. 5. 6. HCl Hg. H 2 Te Si. H 4 Mn. O 2 HF

-Hidruro sódico - Hidruro cálcico - Hidruro de hierro (II) - Hidruro platínico.

- Hidróxido de litio - Hidróxido de bario - Hidróxido de hierro (III) - Hidróxido de cromo (III) - Hidróxido de aluminio

DESARROLLA TU HABILIDAD 1. - Indica el estado de oxidación de los elementos metales o no metales en las siguientes fórmulas (suma algebraica ). IR A EJERCICIOS

• I 2 O • P 2 O 5 • H 2 Se • Fe. H 3 • Ca (OH)2

Respuesta de la Pregunta Nº 1 • • • I +1 P +5 H+1 H -1 Ca +2 → → → O-2 Se-2 Fe+3 (OH) -1

DESARROLLA TU HABILIDAD 2. - Escribe la fórmula de los siguientes compuestos: IR A EJERCICIOS

• • • Óxido de níquel (II) Dióxido de estaño Anhídrido bromoso Óxido de fósforo (V) Ácido clorhídrico

Respuesta de la Pregunta Nº 2 • Ni. O 2 • Sn. O 2 • Br. O 3 • PO 5 • HCl

DESARROLLA TU HABILIDAD 3. - A QUÉ FUNCIÓN PERTENECEN LOS SIGUIENTES COMPUESTOS: IR A EJERCICIOS

a) b) c) d) e) Óxido de fierro (III) Dióxido de platino Anhídrido bórico Trióxido de azufre Hidróxido de plata (I)

Respuesta de la Pregunta Nº 3 a) b) c) d) e) Óxido Básico Óxido No Metálico Hidróxido Metálico

DESARROLLA TU HABILIDAD 4. - ESCRIBE LA ECUACIÓN DE LOS SIGUIENTES COMPUESTOS: IR A EJERCICIOS

a) b) c) d) e) Óxido de litio Trióxido de di aluminio Dióxido de silicio Óxido de fósforo (III) Hidróxido de platino (IV)

Respuesta de la Pregunta Nº 4 a) b) c) d) e) Li+1 2 Al+3 Si+4 P+3 Pt+4 + + + 2 O-2 3 O-2 O-2 = = = Li. O 2 Al 2 O 3 Si. O 2 PO 3 Pt. O 2

DESARROLLA TU HABILIDAD 5. - ESCRIBE LA NOMENCLATURA DE: IR A EJERCICIOS

N. STOCK • • Fe 2 O 3 (III) Cl 2 O (I) N 2 O 5 HCl N. TRADICIONAL

Respuesta de la Pregunta Nº 5 TRADICIONAL a) Óxido Férrico b) Óxido Hipocloroso c) Óxido Nítrico d) Ácido Clorhídrico STOCK Óxido de Fierro (III) Óxido de Cloro (I) Óxido de Nitrógeno (V) Hidruro de Cloro (I)

Bibliografías • Información: 1. http: //www. librys. com/formulacionquimicainorganica/hidruros. html -> Hidruros 2. http: //www. fortunecity. com/campus/dawson/196/hidrunom. htm -> Hidruros No Metales 3. http: //www. fortunecity. com/campus/dawson/196/hidrumet. htm -> Hidruros Metálicos 4. http: //perso. wanadoo. es/frq/formulacion/peroxidos. html -> peróxidos 5. http: //www. carlos-harold 2. blogspot. com -> Información de funciones químicas inorgánicas 6. http: //www. halls 2006. blogspot. com -> Información de funciones químicas inorgánicas 7. http: //www. astromia. com/glosario/oxido. htm -> Oxido (Definición) • Adornos e ilustraciones: 1. http: //www. gifmania. com/ -> Gifs animados 2. http: //gifsanimados. espaciolatino. com/ -> Gifs animados 3. http: //images. google. com. pe/images? q=fondos&hl=es&lr=&sa=N&tab=wi -> Fondos 4. http: //images. google. com. pe/images? svnum=10&hl=es&lr=&q=fondos+cu adrados -> Fondos
 Rayo notable
Rayo notable Colegio ignacio carrera pinto lo prado
Colegio ignacio carrera pinto lo prado Orden religiosa fundada por san ignacio de loyola
Orden religiosa fundada por san ignacio de loyola Que todas mis intenciones acciones y operaciones
Que todas mis intenciones acciones y operaciones Frases de san ignacio de loyola en todo amar y servir
Frases de san ignacio de loyola en todo amar y servir Iglesia san ignacio de loyola
Iglesia san ignacio de loyola Colegio nuestro tiempo algarrobo
Colegio nuestro tiempo algarrobo Nuestro grupo esta conformado por
Nuestro grupo esta conformado por Himno del colegio san isidoro espinal tolima
Himno del colegio san isidoro espinal tolima Modificador de frase
Modificador de frase Grupo preposicional exemplos
Grupo preposicional exemplos Grupo objeto y grupo sujeto
Grupo objeto y grupo sujeto O que é predicativo do objeto
O que é predicativo do objeto Colegio san francisco temuco
Colegio san francisco temuco Material de apoyo colegio san francisco coll
Material de apoyo colegio san francisco coll Textileria aymara dibujo
Textileria aymara dibujo Colegio san carlos
Colegio san carlos Andres felipe paredes campos
Andres felipe paredes campos Colegio san sebastian colina
Colegio san sebastian colina Colegio san nicolas canal chacao
Colegio san nicolas canal chacao Colegio ass
Colegio ass Prepa san carlos
Prepa san carlos Colegio parroquial san pedro claver
Colegio parroquial san pedro claver Colegio ana guerra de jesus santo domingo san vicente
Colegio ana guerra de jesus santo domingo san vicente San francisco de asís temuco aula virtual
San francisco de asís temuco aula virtual Colegio san pedro nolasco quillota
Colegio san pedro nolasco quillota Colegio san francisco javier
Colegio san francisco javier Lisosomas funcion
Lisosomas funcion Colegio san esteban talca
Colegio san esteban talca Colegio san pedro chanel sullana
Colegio san pedro chanel sullana Colegio san pedro nolasco concepcion
Colegio san pedro nolasco concepcion San viator huesca
San viator huesca Colegio san francisco coll material de apoyo
Colegio san francisco coll material de apoyo Colegio san jorge de inglaterra
Colegio san jorge de inglaterra Iglesia de san vicente barakaldo
Iglesia de san vicente barakaldo Colegio san nicolas canal chacao
Colegio san nicolas canal chacao San juan evangelista colegio
San juan evangelista colegio Colegio san jorge de inglaterra
Colegio san jorge de inglaterra Colegio san francisco de asis de nueva imperial
Colegio san francisco de asis de nueva imperial Cumbres de nos
Cumbres de nos






























































