CINETICA CHIMICA Aspetto cinetico e termodinamico di una














![Leggi cinetiche reazione al SECONDO ORDINE: 2 A P vr = k [A]2 unità Leggi cinetiche reazione al SECONDO ORDINE: 2 A P vr = k [A]2 unità](https://slidetodoc.com/presentation_image_h/bde7e5cc47e9c9ceb009246866c19285/image-22.jpg)

![1 d[A] v == k [A]x [B]y [C]k [D]z a dt Legge cinetica della 1 d[A] v == k [A]x [B]y [C]k [D]z a dt Legge cinetica della](https://slidetodoc.com/presentation_image_h/bde7e5cc47e9c9ceb009246866c19285/image-25.jpg)



![Leggi cinetiche integrate 3. Reazioni di secondo ordine: A 2 P intercetta 1/[A]0 Leggi cinetiche integrate 3. Reazioni di secondo ordine: A 2 P intercetta 1/[A]0](https://slidetodoc.com/presentation_image_h/bde7e5cc47e9c9ceb009246866c19285/image-33.jpg)











- Slides: 45

CINETICA CHIMICA

Aspetto cinetico e termodinamico di una reazione DG e Keq ci dicono la tendenza di una reazione ad avvenire spontaneamente È indispensabile però sapere anche quanto impiega una reazione a raggiungere il proprio stato di equilibrio CH 4 + 2 O 2 CO 2 + 2 H 2 O Keq ~ 10140 Spontaneità e velocità non hanno nessuna correlazione tra loro

A differenza della termodinamica che si occupa della stabilità relativa tra reagenti e prodotti in una reazione chimica, la cinetica chimica si occupa dello studio della velocità con cui avviene una reazione chimica e della sua dipendenza da vari fattori. La cinetica si occupa anche di esaminare la sequenza dei processi chimici o fisici attraverso cui ha luogo la conversione tra reagenti e prodotti (meccanismo di reazione). In questa maniera lo studio della velocità di reazione mira ad ottenere informazioni dettagliate sull’interazione tra le molecole nel corso della reazione.

Consideriamo la seguente reazione chimica: A P in cui A è il reagente e P il prodotto. Si definisce velocità media di formazione del prodotto l’aumento della concentrazione del prodotto nell’unità di tempo considerata, cioè: in cui [P]1 è la concentrazione di P al tempo t 1 e [P]2 quella ad un tempo successivo t 2. Poiché sia [P] che t aumentano essa è una grandezza positiva ed ha unità mol/(L·s).

Si parla anche di velocità di scomparsa del reagente A che è anch’essa una grandezza positiva, anche se [A] diminuisce con t, a causa del segno negativo. Si definisce velocità di reazione l’aumento della concentrazione dei prodotti o la diminuzione della concentrazione dei reagenti nell’unità di tempo, cioè

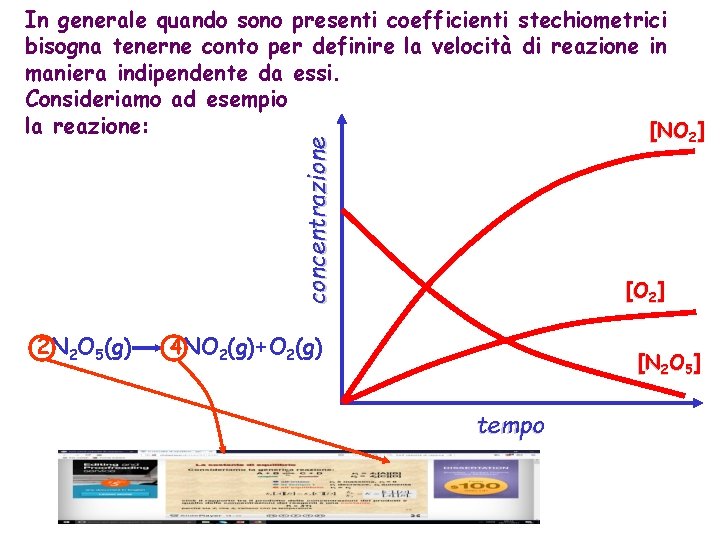
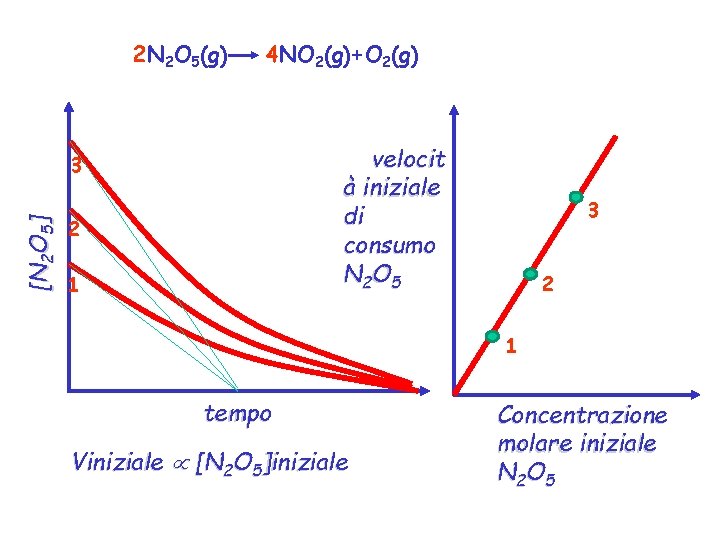
concentrazione In generale quando sono presenti coefficienti stechiometrici bisogna tenerne conto per definire la velocità di reazione in maniera indipendente da essi. Consideriamo ad esempio la reazione: [NO 2] 2 N 2 O 5(g) [O 2] 4 NO 2(g)+O 2(g) [N 2 O 5] tempo

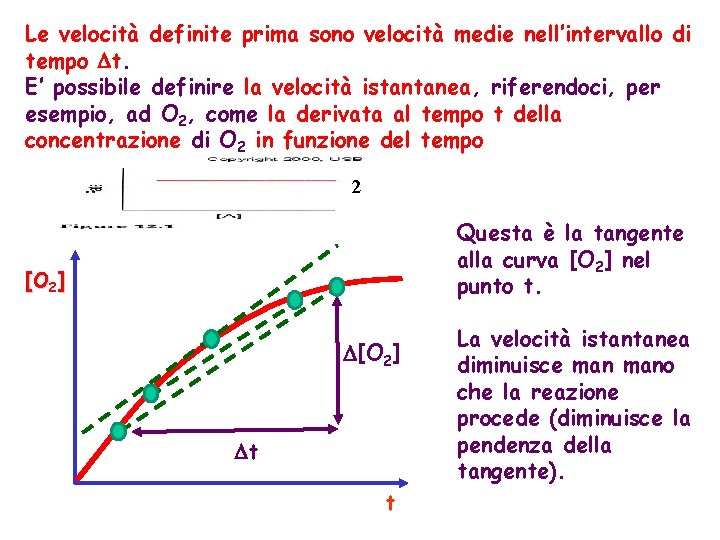
Le velocità definite prima sono velocità medie nell’intervallo di tempo t. E’ possibile definire la velocità istantanea, riferendoci, per esempio, ad O 2, come la derivata al tempo t della concentrazione di O 2 in funzione del tempo 2 Questa è la tangente alla curva [O 2] nel punto t. [O 2] t t La velocità istantanea diminuisce mano che la reazione procede (diminuisce la pendenza della tangente).

Velocità di una reazione N 2 O 4 2 NO 2 All’equilibrio N 2 O 4 é dissociato del 35% Velocità di una reazione è riferita al tempo che i reagenti impiegano per trasformarsi nei prodotti nel processo che porta il sistema al raggiungimento del suo stato di equilibrio. Quale é la concentrazione delle due specie durante la reazione?

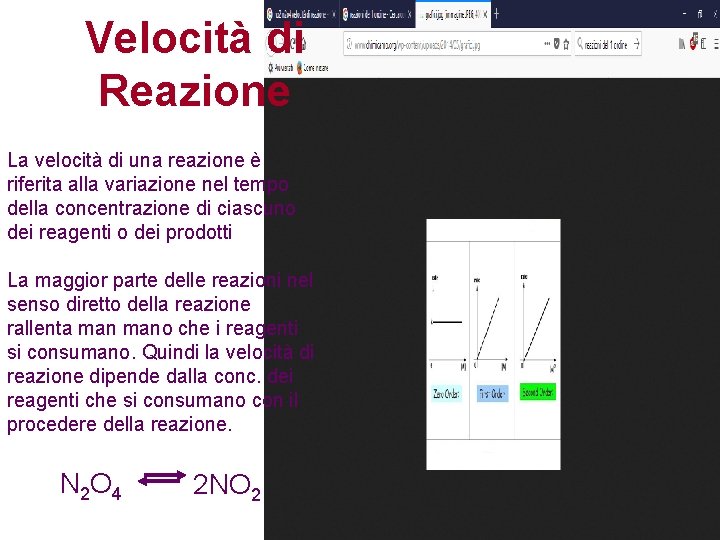
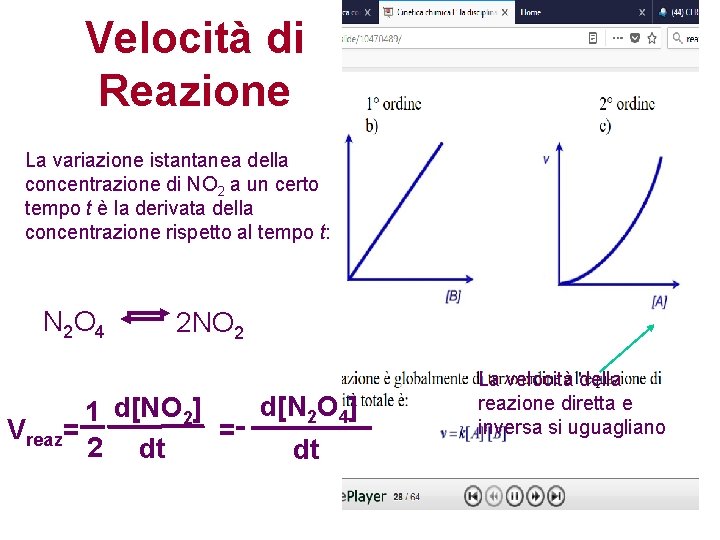
Velocità di Reazione La velocità di una reazione è riferita alla variazione nel tempo della concentrazione di ciascuno dei reagenti o dei prodotti La maggior parte delle reazioni nel senso diretto della reazione rallenta mano che i reagenti si consumano. Quindi la velocità di reazione dipende dalla conc. dei reagenti che si consumano con il procedere della reazione. N 2 O 4 2 NO 2

Velocità di Reazione La variazione istantanea della concentrazione di NO 2 a un certo tempo t è la derivata della concentrazione rispetto al tempo t: N 2 O 4 2 NO 2 d[N 2 O 4] 1 d[NO 2] Vreaz= =2 dt dt La velocità della reazione diretta e inversa si uguagliano

2 N 2 O 5(g) 4 NO 2(g)+O 2(g) velocit à iniziale di consumo N 2 O 5 [N 2 O 5 ] 3 2 1 tempo Viniziale [N 2 O 5]iniziale Concentrazione molare iniziale N 2 O 5

Sperimentalmente si trova che la velocità iniziale di una reazione chimica dipende SOLO dalla concentrazione dei reagenti (tutti o eventualmente solo alcuni).

Velocità di Reazione a. A + b. B c. C + d. D 1 d[A] 1 d[B] 1 d[C] 1 d[D] Vreaz=== = d dt a dt b dt c dt A t = 0, cioè quando sono presenti solo i reagenti, si ha una velocità iniziale che dipende da T e dalla concentrazione dei reagenti. Ordine della reazione rispetto al componente A Ordine della reazione rispetto al componente B d[A] 1 Viniz= a dt = k [A]x [B]y. Legge cinetica della reazione x+y è l’ordine complessivo della reazione costante cinetica o costante di velocità, è indipendente dalla conc. dei reagenti, dipende da T

Non solo la velocità iniziale è proporzianale alla concentrazione di N 2 O 5, ma in qualunque istante la velocità è direttamente proprozionale alla concentrazione di N 2 O 5 residua in quell’istante, secondo la stessa costante di propozionalità, e quindi in qualunque momento della reazione vale la legge cinetica ma quando non sono all’inizoi della reazione possono esserci i prodotti che contribuiscono alla velocità diretta della reazione: 1 d[A] v == k [A]x [B]y [C]k [D]z a dt Legge cinetica della reazione

Se i prodotti prendono parte alla reazione, hanno un ordine di reazione negativo nella legge cinetica. Es: 2 O 3 2 Legge cinetica determinata sperimentalmete: v = k [O 3]2 [O 2]-1 2 SO 2 + O 2 2 SO 3 Legge cinetica determinata sperimentalmete: v = k [SO 2] [SO 3]-1/2

Velocità di Reazione x, y e k sono delle costanti che vanno determinate sperimentalmente. x e y non coincidono necessariamente con i coefficienti stechiometrici a e b e non sono ricavabili direttamente dalla reazione, in quanto dipendono dal meccanismo di reazione

Ad esempio per la reazione: 2 NO 2 + F 2 2 NOF l’equazione cinetica è: viniz = k [NO 2] [F 2] Le dimensioni di k dipendono dalla particolare equazione cinetica in modo tale che la velocità risulti sempre espressa in mol dm-3 s-1. Ad esempio per la reazione precedente:

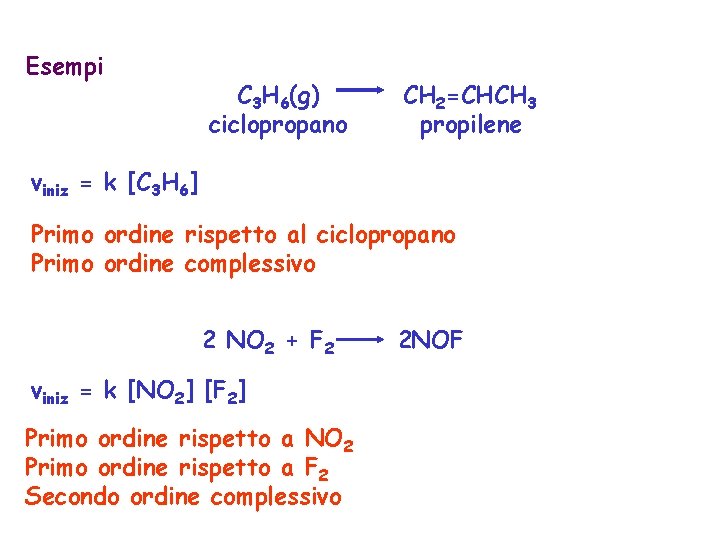
Esempi C 3 H 6(g) ciclopropano CH 2=CHCH 3 propilene viniz = k [C 3 H 6] Primo ordine rispetto al ciclopropano Primo ordine complessivo 2 NO 2 + F 2 viniz = k [NO 2] [F 2] Primo ordine rispetto a NO 2 Primo ordine rispetto a F 2 Secondo ordine complessivo 2 NOF

2 NO(g) + 2 H 2(g) N 2(g) + 2 H 2 O(g) viniz = k [NO]2[H 2] secondo ordine rispetto a NO primo ordine rispetto a H 2 Terzo ordine complessivo Se un reagente non compare nell’equazione cinetica per una data reazione questa è di ordine zero rispetto a tale reagente.

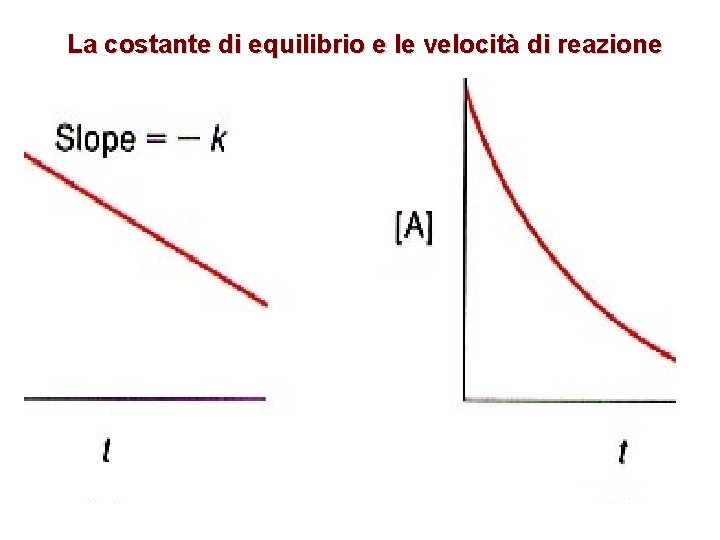
La costante di equilibrio e le velocità di reazione

Leggi cinetiche reazione di ORDINE ZERO A P vr = k unità di misura di k = mol L-1 s-1 reazione al PRIMO ORDINE: A P vr = k [A] unità di misura di k = s-1
![Leggi cinetiche reazione al SECONDO ORDINE 2 A P vr k A2 unità Leggi cinetiche reazione al SECONDO ORDINE: 2 A P vr = k [A]2 unità](https://slidetodoc.com/presentation_image_h/bde7e5cc47e9c9ceb009246866c19285/image-22.jpg)
Leggi cinetiche reazione al SECONDO ORDINE: 2 A P vr = k [A]2 unità di misura di k = L mol-1 s-1 • reazione al SECONDO ORDINE: ordine 1 in A e ordine 1 in B: A + B P vr = k [A] [B] unità di misura di k = L mol-1 s-1 [B] or [A] • reazione al SECONDO ORDINE: ordine 2 in A e ordine 0 in B: 2 A + B P vr = k [A]2 unità di misura di k = L mol-1 s-1

Aule prenotate: • Mercoledì 4 Dicembre Aula 102 dalle 14: 30 alle 16: 30 • Venerdì 13 Dicembre Aula 7 dalle 14: 30 alle 16: 30 • Giovedì 19 Dicembre Aula 6 dalle 14: 30 alle 16: 30 • Mercoledì 8 Gennaio Aula 3 dalle 9: 00 alle 11: 00 • Giovedì 9 Gennaio Aula 2 dalle 9: 00 alle 11: 00 • Venerdì 10 Gennaio Aula 3 dalle 14: 30 alle 16: 30 • Lunedì 13 Gennaio Aula 3 dalle 14: 30 alle 16: 30 • Martedì 14 Gennaio Aula 3 dalle 14: 30 alle 16: 30 • Giovedì 16 Gennaio Aula 3 dalle 9: 00 alle 11: 00 • Venerdì 17 Gennaio Aula 3 dalle 14: 30 alle 16: 30 Compitino • Martedì 21 Gennaio Aula 1 dalle 14: 30 alle 16: 30 Compito

005 SCIENZE BIOLOGICHE codice B 006409 Insegnamento CHIMICA GENERALE E INORGANICA Modulo (A-L) Docente/i Simone Ciofi Baffoni Data 20 Gennaio 2020 14 Febbraio 2020 7 Aprile 2020 22 Giugno 2020 20 Luglio 2020 7 Settembre 2020 Ora Sede 9: 00 Plesso Morgagni 9: 00 Plesso Morgagni 9: 00 Plesso Sesto Fiorentino
![1 dA v k Ax By Ck Dz a dt Legge cinetica della 1 d[A] v == k [A]x [B]y [C]k [D]z a dt Legge cinetica della](https://slidetodoc.com/presentation_image_h/bde7e5cc47e9c9ceb009246866c19285/image-25.jpg)
1 d[A] v == k [A]x [B]y [C]k [D]z a dt Legge cinetica della reazione Ordine della reazione rispetto al componente A Ordine della reazione rispetto al componente B 1 d[A] Viniz= = k [A]x [B]y Legge cinetica della reazione a dt x+y è l’ordine complessivo della reazione costante cinetica o costante di velocità, è indipendente dalla conc. dei reagenti, dipende da T

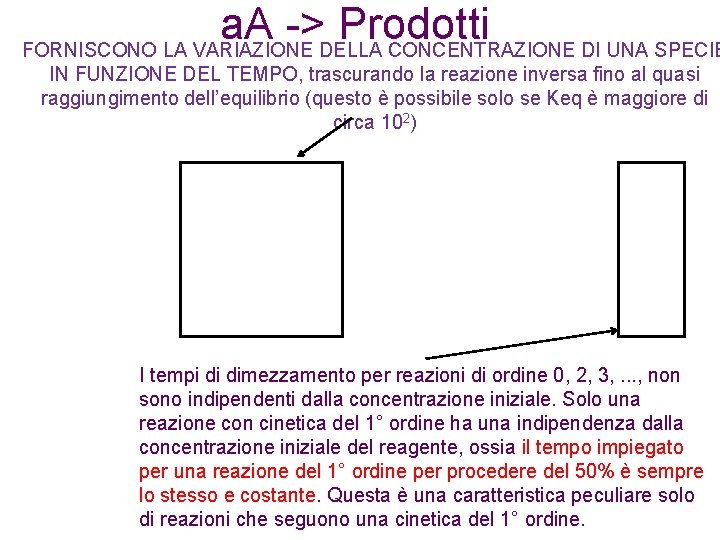
Leggi cinetiche integrate FORNISCONO LA VARIAZIONE DELLA CONCENTRAZIONE DI UNA SPECIE IN FUNZIONE DEL TEMPO, trascurando la reazione inversa fino al quasi raggiungimento dell’equilibrio (questo è possibile solo se Keq è maggiore di circa 102) 1. Reazioni di ordine zero: A P La concentrazione del reagente decade linearmente nel tempo. [A]0 k aumenta tempo

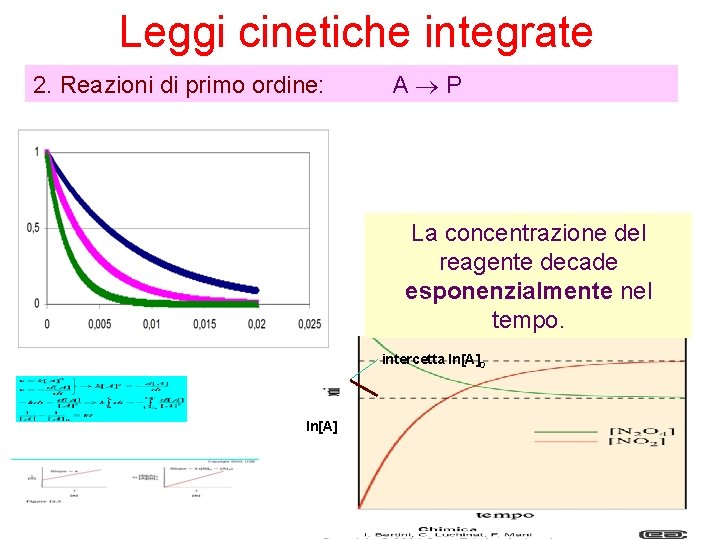
Leggi cinetiche integrate 2. Reazioni di primo ordine: A P La concentrazione del reagente decade esponenzialmente nel tempo. intercetta ln[A]0 ln[A]

Leggi cinetiche integrate 2. Reazioni di primo ordine: A P Il decadimento esponenziale di [A]0 è più veloce quanto più grande è il valore di k. [A]0 k aumenta tempo Le concentrazioni dei reagenti raggiungono lo zero più rapidamente per valori grandi della costante cinetica

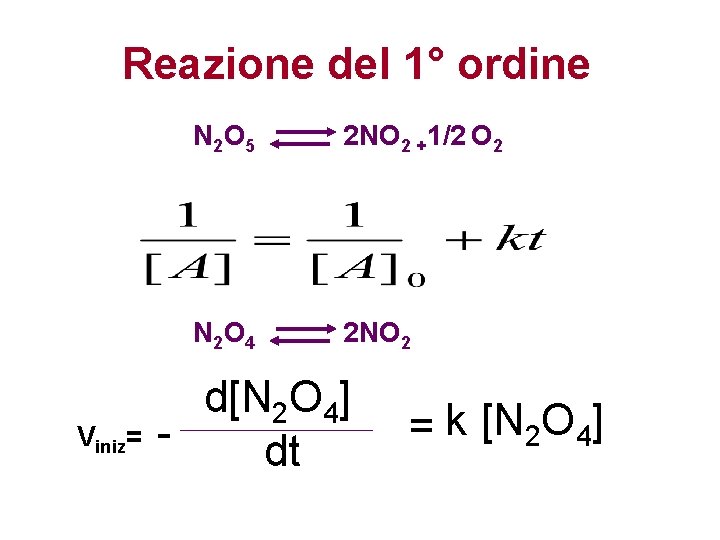
Reazione del 1° ordine Viniz= N 2 O 5 2 NO 2 +1/2 O 2 N 2 O 4 2 NO 2 d[N 2 O 4] dt = k [N 2 O 4]

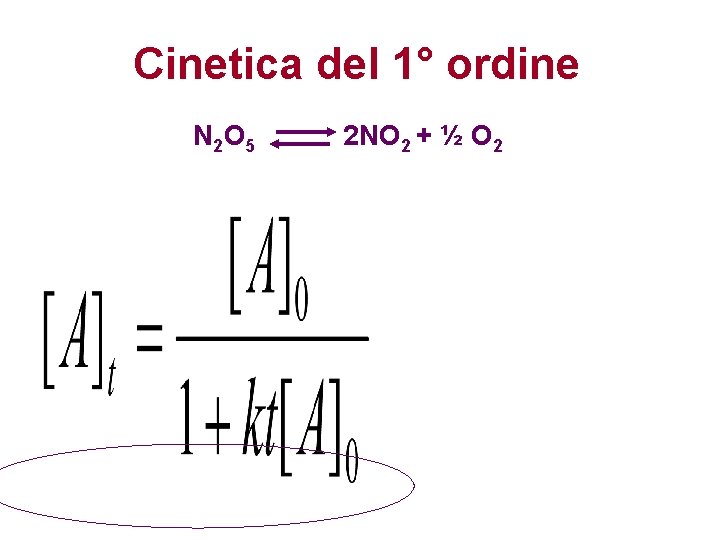
Cinetica del 1° ordine N 2 O 5 2 NO 2 + ½ O 2

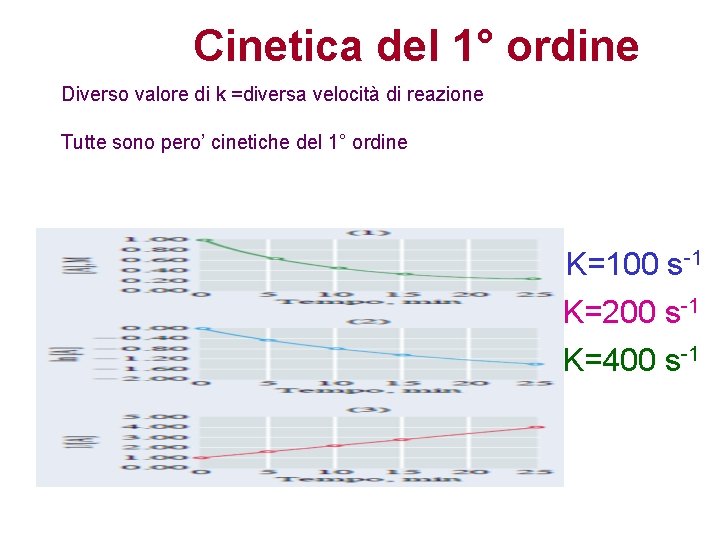
Cinetica del 1° ordine In una cinetica del 1° ordine, la variazione della concentrazione segue sempre un andamento ESPONENZIALE. -kt e

Cinetica del 1° ordine Diverso valore di k =diversa velocità di reazione Tutte sono pero’ cinetiche del 1° ordine K=100 s-1 K=200 s-1 K=400 s-1
![Leggi cinetiche integrate 3 Reazioni di secondo ordine A 2 P intercetta 1A0 Leggi cinetiche integrate 3. Reazioni di secondo ordine: A 2 P intercetta 1/[A]0](https://slidetodoc.com/presentation_image_h/bde7e5cc47e9c9ceb009246866c19285/image-33.jpg)
Leggi cinetiche integrate 3. Reazioni di secondo ordine: A 2 P intercetta 1/[A]0

Leggi cinetiche integrate 3. Reazioni di secondo ordine: A 2 P Il decadimento di [A]0 è più veloce all’inizio rispetto ad una reazione del primo ordine, ma successivamente tende a zero più lentamente [A]t [A]0 1° ordine K aumenta tempo



Tempo di semi-vita o tempo di dimezzamento t 1/2 di una sostanza (o di una reazione) è il tempo necessario perché la sostanza (o la concentrazione di un reagente) si riduca alla metà del suo valore originario

Tempo di semi-vita per una reazione del primo ordine o Per una reazione del primo ordine il tempo di dimezzamento di un reagente è indipendente dalla sua concentrazione iniziale (Poiché ln 2 = 0. 693… la concentrazione di [A] si ridurrà ad 1/2[A] dopo un tempo 0. 693/k, qualsiasi sia il valore effettivo di [A]) [A]0 1/2[A]0 1/4[A]0 1/8[A]0 I tempi di dimezzamento per reazioni di ordine 0, 2, 3, . . . , non sono indipendenti dalla concentrazione iniziale

Cinetica del 1° ordine Il tempo che una reazione impiega per procedere del 50% é costante. Quindi una cinetica del 1° ordine puo’ essere completamente descritta dal valore del Tempo di dimezzamento (il tempo che impiega la reazione per diminuire al 50% del valore iniziale la concentrazione del reagente) Tutte le reazioni di decadimento radioattivo sono TUTTE reazioni del 1° ordine

Reazione del 2° ordine H 2 + I 2 2 HI La velocità iniziale dipende dalla concentrazione di ENTRAMBI I REAGENTI Reazione di pseudoprimo ordine: uso alta concentrazione di uno dei due reagenti, di modo che in buona approssimazione la sua conc. rimane costante ossia uguale alla concentrazione iniziale, mentre la reazione procede: vr = k [H 2]0 [I 2] => v= k’ [I 2] con k’ = k [H 2]0

a. A -> Prodotti FORNISCONO LA VARIAZIONE DELLA CONCENTRAZIONE DI UNA SPECIE IN FUNZIONE DEL TEMPO, trascurando la reazione inversa fino al quasi raggiungimento dell’equilibrio (questo è possibile solo se Keq è maggiore di circa 102) I tempi di dimezzamento per reazioni di ordine 0, 2, 3, . . . , non sono indipendenti dalla concentrazione iniziale. Solo una reazione con cinetica del 1° ordine ha una indipendenza dalla concentrazione iniziale del reagente, ossia il tempo impiegato per una reazione del 1° ordine per procedere del 50% è sempre lo stesso e costante. Questa è una caratteristica peculiare solo di reazioni che seguono una cinetica del 1° ordine.

Tempo di dimezzamento (semi-vita) di una reazione o di una sostanza • Una sostanza radioattiva è una specie i cui nuclei sono instabili e quindi spontaneamente decadono a formare altri elementi la quantità di materiale radioattivo diminuisce nel tempo seguendo determinate leggi cinetiche • i materiali radioattivi sono “pericolosi” perchè hanno tempi di semivita lunghi

Reazione di decadimento radiattivo. Sono del 1° ordine 14 C si forma nell’atmosfera per azione dei vdecadimento = k [N] raggi cosmici sull’ 14 N e decade con cinetica del 1° ordine seguendo la reazione indicata: N= nuclide ln [N]t/[N]0 = -k t 146 C 147 N + b- t 1/2 = 5730 anni la vita media del C (pari al tempo di t 1/2 = 0. 693/k dimezzamento diviso 0. 693) indicata con t = 1/k: 5730/0. 693 = 8267 anni). t 1/2 / 0. 693= 1/k = t 14 C è radioattivo e la CO dell’aria contiene un L’isotopo 2 rapporto costante di 14 C/12 C = 10 -12 che è anche quello contenuto in qualunque animale che si ciba di vegetali o altri animali. Si ricava il tempo in cui l’organismo ha cessato di scambiare 14 C con l’atmosfera, ossia l’epoca della sua morte. 14


Sapendo che il tempo di dimezzamento del 14 C è pari a 5730 anni, calcolare la percentuale di 14 C rimasto dopo 10000 anni, nell'ipotesi che i processi di decadimento radioattivo seguano una cinetica del primo ordine. [A]t/[A]0 = e–kt Passando ai calcoli si ottiene: k = 0, 693/t 1/2 = 0, 693/5730 a [A]t/[A]0 = e–kt = e-(0, 693/5730 a)×(10000 a) = 0, 288 La percentuale di 14 C che rimane dopo 10000 anni è quindi 0, 288× 100 = 28, 8%. Ecco fatto!
 Cinetica chimica formule
Cinetica chimica formule Trieste umberto saba figure retoriche
Trieste umberto saba figure retoriche Lombardia aspetto fisico
Lombardia aspetto fisico La descrizione di una persona
La descrizione di una persona I due rami in cui si biforca la trachea
I due rami in cui si biforca la trachea Aspetto patrimoniale
Aspetto patrimoniale Aspetto finanziario ed economico
Aspetto finanziario ed economico Principio del duplice aspetto
Principio del duplice aspetto Aspetto monetario
Aspetto monetario La teoria cinetico molecolare della materia zanichelli
La teoria cinetico molecolare della materia zanichelli Modelo cinetico molecular
Modelo cinetico molecular Modelo cinetico de particulas
Modelo cinetico de particulas Vinhetas banda desenhada
Vinhetas banda desenhada Curva di riscaldamento dell'acqua zanichelli
Curva di riscaldamento dell'acqua zanichelli Teoría cinetico molecular
Teoría cinetico molecular Atrito cinetico
Atrito cinetico Planeta tierra como sistema termodinámico
Planeta tierra como sistema termodinámico Ciclo otto diesel
Ciclo otto diesel Equilibrio termodinamico
Equilibrio termodinamico Equilibrio termodinamico
Equilibrio termodinamico Quadrado termodinamico
Quadrado termodinamico Quadrado termodinamico
Quadrado termodinamico Quadrado termodinamico
Quadrado termodinamico Proceso termodinamico
Proceso termodinamico Fsica
Fsica O que é equilíbrio térmico
O que é equilíbrio térmico Equilibrio termodinamico
Equilibrio termodinamico Termodinamica
Termodinamica Una branca della chimica
Una branca della chimica Una branca della chimica
Una branca della chimica Stechiometria
Stechiometria Cv
Cv Cuando matias analiza el grafico de una onda
Cuando matias analiza el grafico de una onda Cinetica di ordine zero farmacologia
Cinetica di ordine zero farmacologia Urto completamente anelastico energia cinetica
Urto completamente anelastico energia cinetica Relacion entre trabajo y energia
Relacion entre trabajo y energia Holoenzima apoenzima y cofactor
Holoenzima apoenzima y cofactor Bomba alternativa
Bomba alternativa Energia potenziale per bambini
Energia potenziale per bambini Via corticopontocerebelosa funcion
Via corticopontocerebelosa funcion Energia cinetica relativista
Energia cinetica relativista Urto completamente anelastico energia cinetica
Urto completamente anelastico energia cinetica Cinetica etimologia
Cinetica etimologia Cinetica ordine zero
Cinetica ordine zero Formula urto elastico
Formula urto elastico Okc ckc
Okc ckc