Cinetica chimica Aspetto cinetico e termodinamico di una




![Ordine di reazione • ordine 0 • 1° ordine v=k v = k[A] • Ordine di reazione • ordine 0 • 1° ordine v=k v = k[A] •](https://slidetodoc.com/presentation_image/5d13382136b879712493f2a832dc191a/image-6.jpg)












![Reazioni di ordine 0 v=k -d[A]/dt = k [A] = [A]0 – kt t Reazioni di ordine 0 v=k -d[A]/dt = k [A] = [A]0 – kt t](https://slidetodoc.com/presentation_image/5d13382136b879712493f2a832dc191a/image-22.jpg)
![Reazioni di ordine 1 v = k [A] -d[A]/dt = k [A] = [A]0 Reazioni di ordine 1 v = k [A] -d[A]/dt = k [A] = [A]0](https://slidetodoc.com/presentation_image/5d13382136b879712493f2a832dc191a/image-23.jpg)
![Reazioni di ordine 2 v = k [A]2 -d[A]/dt = k [A] 2 1/[A] Reazioni di ordine 2 v = k [A]2 -d[A]/dt = k [A] 2 1/[A]](https://slidetodoc.com/presentation_image/5d13382136b879712493f2a832dc191a/image-24.jpg)
- Slides: 24

Cinetica chimica

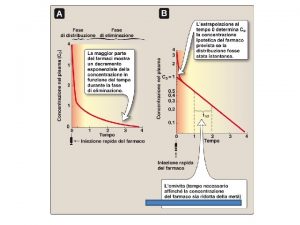
Aspetto cinetico e termodinamico di una reazione DG° e Keq ci dicono se una reazione avviene spontaneamente. È indispensabile però sapere anche quanto impiega una reazione a raggiungere il proprio stato di equilibrio. Spontaneità e velocità non hanno nessuna correlazione tra loro.

Velocità media e velocità istantanea v = s/t velocità media ds v = ____ dt velocità istantanea

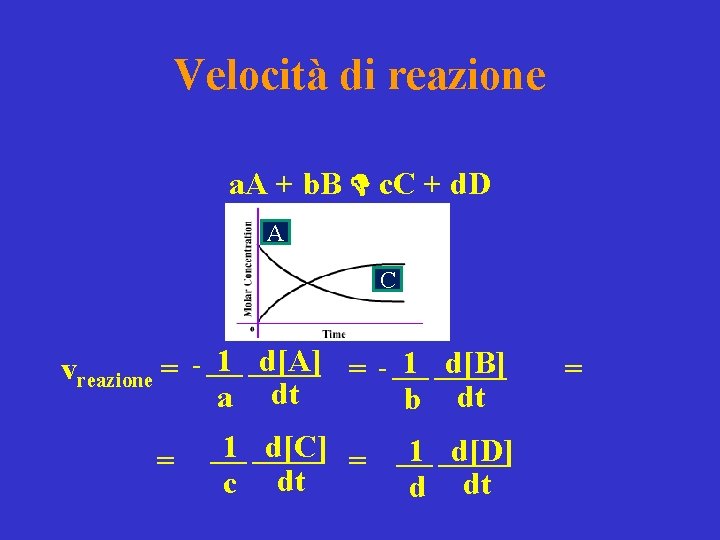
Velocità di reazione a. A + b. B c. C + d. D A C vreazione = 1 ______ d[A] - ___ = 1 ______ d[C] ___ a c dt dt = 1 ______ d[B] - ___ = 1 ______ d[D] ___ b d dt dt =

Legge cinetica della reazione La velocità di una reazione dipende dalla concentrazione dei reagenti secondo: vreazione = k [A]x[B]y k costante cinetica della reazione x ordine della reazione rispetto al componente A y ordine della reazione rispetto al componente B x+y ordine complessivo della reazione
![Ordine di reazione ordine 0 1 ordine vk v kA Ordine di reazione • ordine 0 • 1° ordine v=k v = k[A] •](https://slidetodoc.com/presentation_image/5d13382136b879712493f2a832dc191a/image-6.jpg)
Ordine di reazione • ordine 0 • 1° ordine v=k v = k[A] • 2° ordine v = k[A]2 v = k[A][B] v = k[A]3 v = k[A]2[B] v = k[A][B]2 v = k[A][B][C] • 3° ordine • oppure

Ordine di reazione In generale le costanti x e y non coincidono con i coefficienti stechiometrici. H 2 + Br 2 2 HBr vreazione = k [H 2][Br 2]1/2

Meccanismo delle reazioni È il modo dettagliato a livello molecolare con cui i reagenti si combinano per dare i prodotti e determina la velocità di reazione. In generale una reazione avviene attraverso uno o più passaggi intermedi detti processi elementari, che ne descrivono il meccanismo.

I processi elementari H 2 + Br 2 2 HBr Questa reazione avviene attraverso una serie di processi elementari: Br 2 2 Br Br 2 Br + H 2 HBr + H stadio lento H+ Br 2 HBr + Br

La velocità di reazione complessiva non può essere maggiore di quella dello stadio più lento. L’ordine di un processo elementare può essere dedotto dalla stechiometria. vreazione = k’ [H 2][Br] La concentrazione di Br non può però essere dedotta sperimentalmente, quindi va espressa in funzione di quella di Br 2. Keq = [Br]2/[Br 2] [Br] = Keq 1/2 [Br 2]1/2 vreazione = k’Keq 1/2 [H 2][Br 2]1/2 = k [H 2][Br 2]1/2 Corrisponde all’espressione ottenuta sperimentalmente.

Velocità della reazione diretta e inversa e Keq Se una reazione avviene in un singolo processo elementare, l’equilibrio è raggiunto quando la velocità della reazione diretta è uguale a quella della reazione inversa. NO 2 + CO NO + CO 2 k 1 [NO 2][CO] = k-1[NO][CO 2] k 1/ k-1 = [NO][CO 2]/ [NO 2][CO]= Keq In generale, per reazioni che avvengono attraverso più processi elementari, i singoli processi devono essere all’equilibrio e quindi: Keq = (k 1 k 2 k 3 …)/ (k-1 k-2 k-3 …)

Relazione di Arrhenius Esprime la dipendenza di k dalla temperatura: k = A e-E/RT R costante dei gas T temperatura assoluta E energia di attivazione A fattore di frequenza

L’energia di attivazione Modello teorico: teoria delle collisioni Per poter reagire due particelle devono collidere tra loro. Si avrà reazione solo se le particelle collidenti possiedono una energia maggiore di un valore minimo detto energia di attivazione. In questo caso si parla di urto efficace.

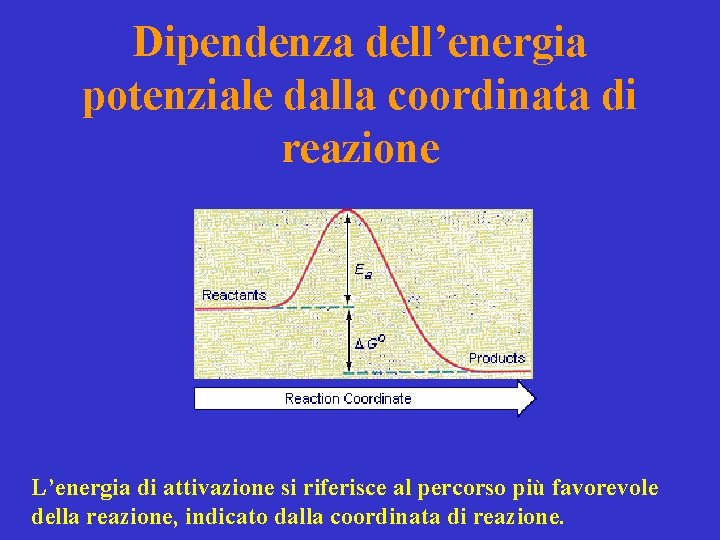
Dipendenza dell’energia potenziale dalla coordinata di reazione L’energia di attivazione si riferisce al percorso più favorevole della reazione, indicato dalla coordinata di reazione.

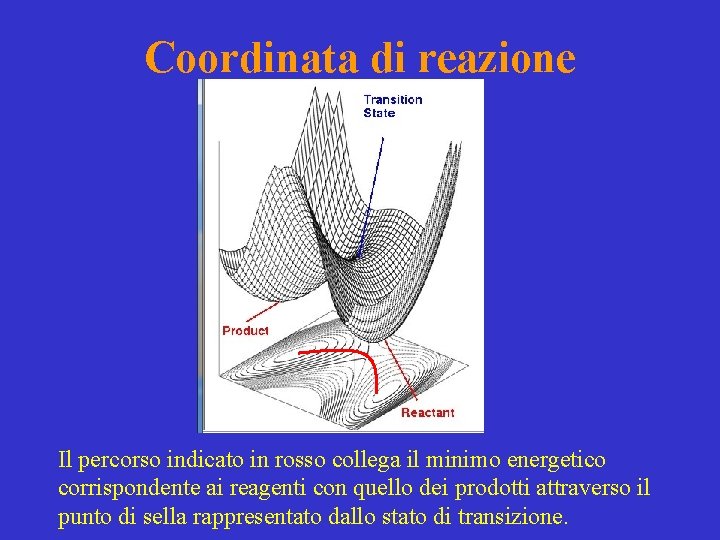
Coordinata di reazione Rappresenta il percorso che va dai reagenti ai prodotti, lungo il quale l’energia di attivazione è minima. Il percorso comprende rottura e formazione di legami chimici determinando il meccanismo di reazione in termini di processi elementari.

Coordinata di reazione Il percorso indicato in rosso collega il minimo energetico corrispondente ai reagenti con quello dei prodotti attraverso il punto di sella rappresentato dallo stato di transizione.

Stato di transizione Punto di sella = massimo di energia lungo la coordinata di reazione, ma minimo di energia lungo le altre direzioni.

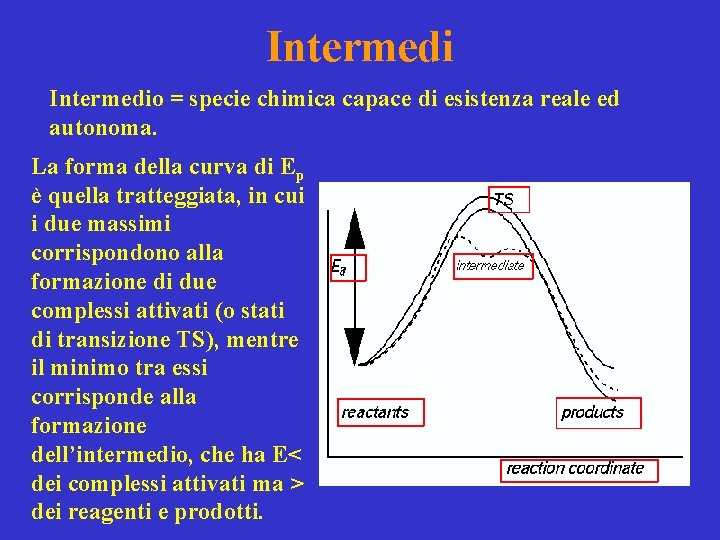
Intermedio = specie chimica capace di esistenza reale ed autonoma. La forma della curva di Ep è quella tratteggiata, in cui i due massimi corrispondono alla formazione di due complessi attivati (o stati di transizione TS), mentre il minimo tra essi corrisponde alla formazione dell’intermedio, che ha E< dei complessi attivati ma > dei reagenti e prodotti.

Come si può aumentare la velocità di una reazione termodinamicamente permessa ma che procede lentamente? Un aumento di T fa sempre aumentare la velocità di reazione. Ma esistono limitazioni pratiche. Inoltre, se la reazione è esotermica l’aumento di T fa spostare l’equilibrio a sinistra.

Catalizzatore = sostanza che fa aumentare la velocità di raggiungimento dell’equilibrio facendo percorrere alla reazione un percorso diverso da quello che sarebbe spontaneo e che implichi una energia di attivazione minore. L’uso di catalizzatori non comporta variazioni termodinamiche allo stato di equilibrio. Catalisi Il catalizzatore si ritrova inalterato alla fine della reazione.

Catalisi omogenea, eterogenea, ed enzimatica • Catalisi eterogenea quando il catalizzatore è in una fase diversa da reagenti e prodotti (es. solido per reazioni gassose). • Catalisi omogenea quando il catalizzatore è nella stessa fase di reagenti e prodotti. • Catalisi enzimatica quando il catalizzatore è una proteina, che in questo caso viene detta enzima.
![Reazioni di ordine 0 vk dAdt k A A0 kt t Reazioni di ordine 0 v=k -d[A]/dt = k [A] = [A]0 – kt t](https://slidetodoc.com/presentation_image/5d13382136b879712493f2a832dc191a/image-22.jpg)
Reazioni di ordine 0 v=k -d[A]/dt = k [A] = [A]0 – kt t 1/2 = [A]0/(2 k) Equazione di una retta con pendenza –k e intercetta [A]0
![Reazioni di ordine 1 v k A dAdt k A A0 Reazioni di ordine 1 v = k [A] -d[A]/dt = k [A] = [A]0](https://slidetodoc.com/presentation_image/5d13382136b879712493f2a832dc191a/image-23.jpg)
Reazioni di ordine 1 v = k [A] -d[A]/dt = k [A] = [A]0 e– kt ln[A] = ln[A]0 – kt t 1/2 = ln 2/k Equazione di una retta con pendenza –k e intercetta ln[A]0
![Reazioni di ordine 2 v k A2 dAdt k A 2 1A Reazioni di ordine 2 v = k [A]2 -d[A]/dt = k [A] 2 1/[A]](https://slidetodoc.com/presentation_image/5d13382136b879712493f2a832dc191a/image-24.jpg)
Reazioni di ordine 2 v = k [A]2 -d[A]/dt = k [A] 2 1/[A] = 1/[A]0 + kt t 1/2 = ln 2/k Equazione di una retta con pendenza +k e intercetta 1/[A]0
 Cinetica chimica formule
Cinetica chimica formule Dico al mio cuore intanto che t'aspetto
Dico al mio cuore intanto che t'aspetto Aspetto fisico lombardia
Aspetto fisico lombardia La descrizione di una persona
La descrizione di una persona Hanno un aspetto spugnoso e forma conica
Hanno un aspetto spugnoso e forma conica Aspetto patrimoniale
Aspetto patrimoniale Aspetto finanziario ed economico
Aspetto finanziario ed economico Principio del duplice aspetto
Principio del duplice aspetto Aspetto monetario
Aspetto monetario La teoria cinetico-molecolare della materia zanichelli
La teoria cinetico-molecolare della materia zanichelli Modelo cinetico molecular
Modelo cinetico molecular Modelo cinetico de particulas
Modelo cinetico de particulas Elementos de uma banda desenhada
Elementos de uma banda desenhada La teoria cinetico molecolare della materia zanichelli
La teoria cinetico molecolare della materia zanichelli Cinética química
Cinética química Atrito cinetico
Atrito cinetico Planeta tierra como sistema termodinámico
Planeta tierra como sistema termodinámico Ciclo termodinamico otto
Ciclo termodinamico otto Sistema termodinamico isolato esempio
Sistema termodinamico isolato esempio Equilibrio termodinamico
Equilibrio termodinamico Quadrado termodinamico
Quadrado termodinamico Quadrado termodinamico
Quadrado termodinamico Quadrado termodinamico
Quadrado termodinamico Propiedades intensivas
Propiedades intensivas Valor de la constante r
Valor de la constante r