ANORGANICK CHEMIE Dvouprvkov sloueniny VY32INOVACE17 DVOUPRVKOV SLOUENINY DVOUPRVKOV













- Slides: 18

ANORGANICKÁ CHEMIE Dvouprvkové sloučeniny VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

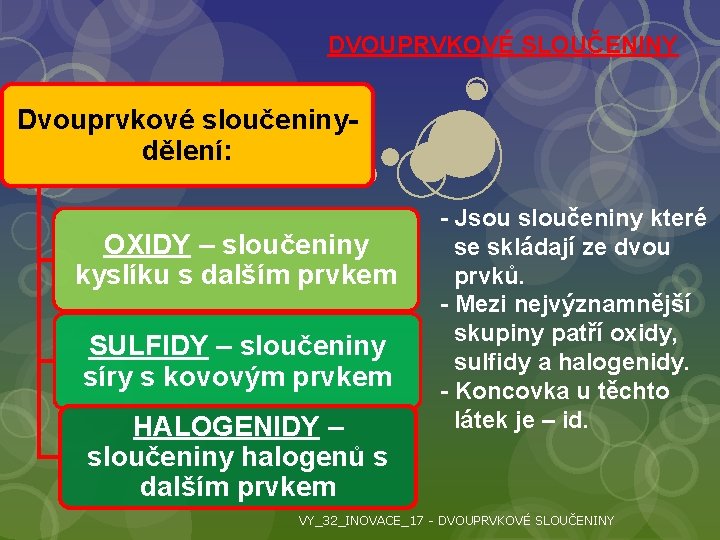
DVOUPRVKOVÉ SLOUČENINY Dvouprvkové sloučeninydělení: - Jsou sloučeniny které OXIDY – sloučeniny se skládají ze dvou prvků. kyslíku s dalším prvkem - Mezi nejvýznamnější skupiny patří oxidy, SULFIDY – sloučeniny sulfidy a halogenidy. síry s kovovým prvkem - Koncovka u těchto látek je – id. HALOGENIDY – sloučeniny halogenů s dalším prvkem VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

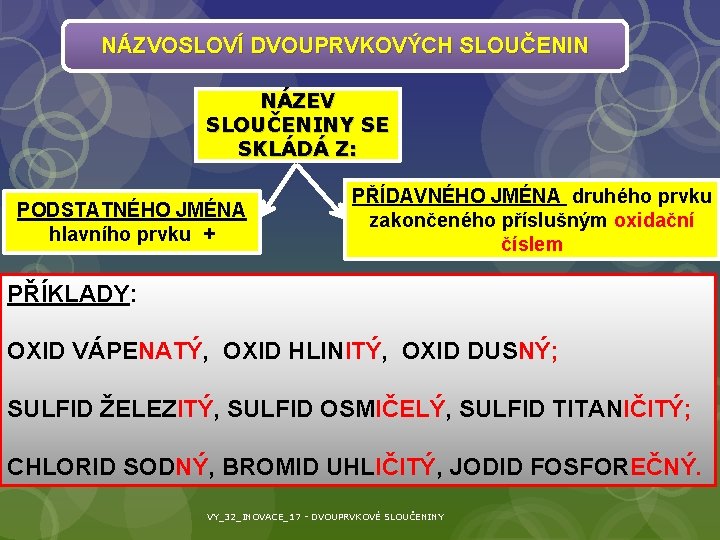
NÁZVOSLOVÍ DVOUPRVKOVÝCH SLOUČENIN NÁZEV SLOUČENINY SE SKLÁDÁ Z: PODSTATNÉHO JMÉNA hlavního prvku + PŘÍDAVNÉHO JMÉNA druhého prvku zakončeného příslušným oxidační číslem PŘÍKLADY: OXID VÁPENATÝ, OXID HLINITÝ, OXID DUSNÝ; SULFID ŽELEZITÝ, SULFID OSMIČELÝ, SULFID TITANIČITÝ; CHLORID SODNÝ, BROMID UHLIČITÝ, JODID FOSFOREČNÝ. VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

OXIDAČNÍ ČÍSLO VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY Ø Ø OXIDAČNÍ ČÍSLO (mocenství prvku, oxidační stupeň) Je jedním z významných informací o stavu prvku. udává stupeň oxidace atomu ve sloučenině či molekule. Jde o součet + a – nábojů. Oxidační číslo dosahuje velikosti od 0 do +- 8. OPAKOVÁNÍ: U atomu znázorňujeme s pomocí horních a dolních indexů různé údaje o stavu atomu. UKAŽ NA X, pod který index patří: - nukleové číslo, - atomové číslo, - protonové číslo - oxidační číslo? Vysvětli tyto pojmy! ? ? NUKLEOVÉ ČÍSLO X PROTONOVÉ ČÍSLO ? ? OXIDAČNÍ ČÍSLO ATOMOVÉ ČÍSLO

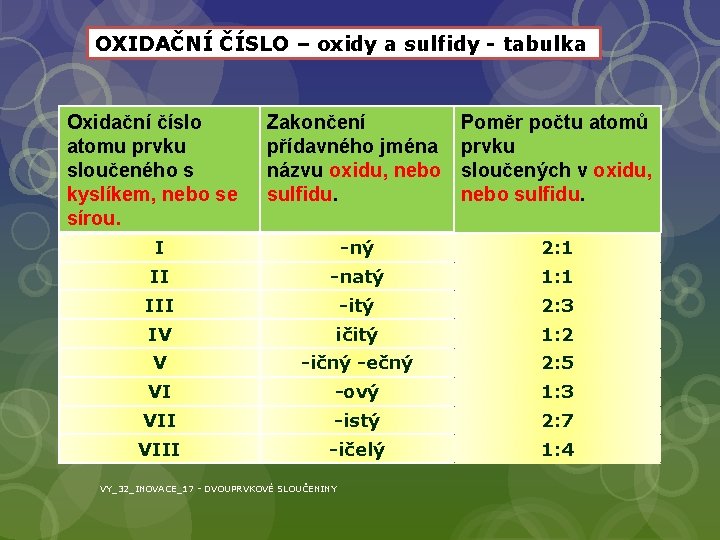
OXIDAČNÍ ČÍSLO – oxidy a sulfidy - tabulka Oxidační číslo atomu prvku sloučeného s kyslíkem, nebo se sírou. Zakončení přídavného jména názvu oxidu, nebo sulfidu. Poměr počtu atomů prvku sloučených v oxidu, nebo sulfidu. I -ný 2: 1 II -natý 1: 1 III -itý 2: 3 IV ičitý 1: 2 V -ičný -ečný 2: 5 VI -ový 1: 3 VII -istý 2: 7 VIII -ičelý 1: 4 VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

OXIDY jsou dvouprvkové sloučeniny kyslíku a dalšího prvku. OXIDY Oxidy Atomy kyslíku mají oxidační číslo –II. V českém jazyce se pro pojmenování oxidů používá unikátní chemické názvosloví, autorem je E. Votoček. Tvoří se: Oxid siřičitý Přídavné jméno od síry v příslušném oxid. čísle - ičitý S+IV Oxid dusnatý +II N Podstatné jméno oxid v oxid. čísle -2 O-II O VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

OXIDY Oxid siřičitý SO 2 Je to bezbarvá, plynná, ostře zapáchající látka, dráždí ke kašli a je jedovatá! Vznik: hořením síry ve vzduchu (jde zejména o méně kvalitní hnědé uhlí, ale i naftu) Využití: při výrobě celulózy a papíru ze dřeva Oxid siřičitý se průmyslově připravuje především spalováním síry S + O 2 → SO 2 VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

OXIDY Oxid uhličitý CO 2 Plynná, nedýchatelná, bezbarvá látka Je přirozenou součástí vzduchu Vznik: vzniká při dýchání organismů a při hoření uhlíkatých látek. Využití: v chladicích zařízení k výrobě sody a osvěžujících nápojů. Vzniká reakcí uhlíku s kyslíkem (spalováním): C + O 2 → CO 2 VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

SULFIDY Sulfidy Jsou to dvouprvkové sloučeniny síry s kovovým prvkem Atomy síry mají oxidační číslo S−II. „Sirník“ je starší název sulfidu. SULFID OLOVITÝ +III Pb -II S VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

SULFIDY Sulfid sodný Na 2 S Je to bezbarvá pevná látka rozpustná ve vodě, ale technická je žlutě zabarvena Průmyslově se vyrábí redukcí síranu sodného Na 2 SO 4 + 4 C → Na 2 S + 4 CO Využití: v papírenství při extrakci celulózy VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

Sulfid olovnatý Pb. S V přírodě se vyskytuje v podobě minerálu galenitu je hnědočerná práškovitá látka, nerozpustná ve vodě Využití: pražením při výrobě olova VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY SULFIDY

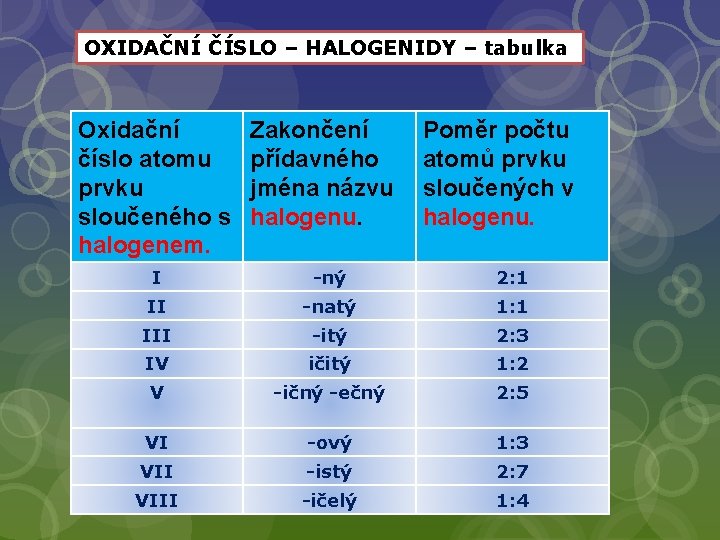
OXIDAČNÍ ČÍSLO – HALOGENIDY – tabulka Oxidační číslo atomu prvku sloučeného s halogenem. Zakončení přídavného jména názvu halogenu. I -ný 2: 1 II -natý 1: 1 III -itý 2: 3 IV ičitý 1: 2 V -ičný -ečný 2: 5 VI -ový 1: 3 VII -istý 2: 7 VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY VIII -ičelý Poměr počtu atomů prvku sloučených v halogenu. 1: 4

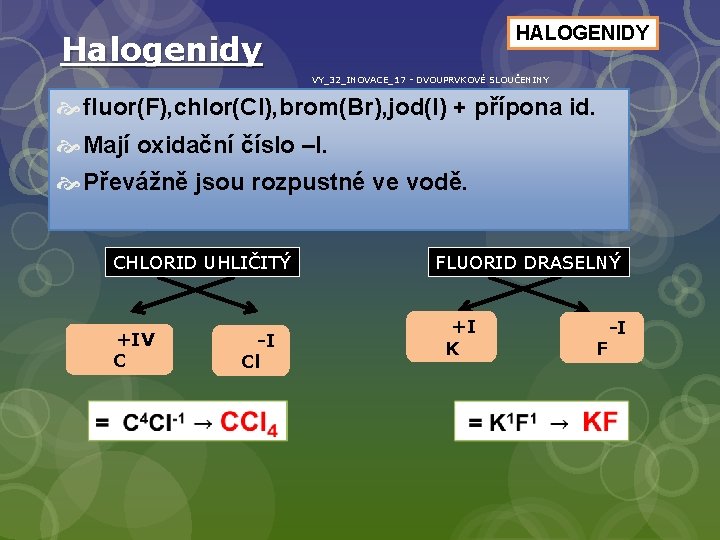
HALOGENIDY Halogenidy VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY fluor(F), chlor(Cl), brom(Br), jod(I) + přípona id. Mají oxidační číslo –I. Převážně jsou rozpustné ve vodě. CHLORID UHLIČITÝ +IV C -I Cl FLUORID DRASELNÝ +I K -I F

Chlorid sodný HALOGENIDY Na. Cl bílá krystalická látka, rozpustná ve vodě v přírodě se vyskytuje jako nerost sůl kamenná (halit) získává se odpařováním mořské vody nebo těžbou nezbytná složka potravy Využití: k výrobě chloru, hydroxidu sodného, k odstraňování námrazy z vozovek VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

Fluorit vápenatý HALOGENIDY Ca. F 2 Bílá krystalická látka V přírodě se vyskytuje jako fialový nebo zelenomodrý nerost kazivec Využití: v hutnictví, optika a při výrobě fluorovodíku HF VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

OPAKOVÁNÍ – Názvosloví dvouprvkových sloučenin Oxid chloričitý - Cl. O 2 Oxid sirnatý - SO Oxid fosforitý - P 2 O 3 Sulfid vápenatý - Ca. S Sulfid stříbrný - Ag 2 S Bromid sodný - Na. Br Sulfid mědnatý - Cu. S Oxid hořečnatý - Bromid draselný - KBr Jodid hlinitý - Chlorid chromitý - Cr. Cl 3 Mg. O Al. I 3 Sulfid titnatý - VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY Ti. S

VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY

ZDROJE http: //cs. wikipedia. org/wiki/Sulfid_sodn%C 3%BD#V. C 3. BDroba http: //cs. wikipedia. org/wiki/Soubor: Sulfur-dioxide-3 Dvd. W. png http: //cs. wikipedia. org/wiki/Soubor: Carbon-dioxide-3 Dvd. W. svg http: //cs. wikipedia. org/wiki/Sulfid_%C 5%BEeleznat%C 3 %BD http: //cs. wikipedia. org/wiki/Sulfid_olovnat%C 3%BD http: //www. google. com/imgres? q=galenit&num=10&hl= cs&gbv=2&biw=1280&bih=619&tbm=isch&tbnid=Rm. Qp 5 s. DZVq_49 M: &imgrefurl=http: //www. mineraly. org/klubj m/muzeum/012/text. htm& VY_32_INOVACE_17 - DVOUPRVKOVÉ SLOUČENINY
 Chemie
Chemie Chemie
Chemie Impuls chemie
Impuls chemie Stöchiometrische wertigkeit
Stöchiometrische wertigkeit Chemie einfach alles
Chemie einfach alles Bahenní plyn
Bahenní plyn Boeken over kwantumchemie en theoretische chemie
Boeken over kwantumchemie en theoretische chemie Nernstova rovnice
Nernstova rovnice Lnky
Lnky Concept cartoon chemie
Concept cartoon chemie Mechanismus
Mechanismus Chemie
Chemie Impuls chemie 4
Impuls chemie 4 Pulsar chemie
Pulsar chemie Tenside definition
Tenside definition Dobrý sluha ale zlý pán chemie
Dobrý sluha ale zlý pán chemie Soli chemie 9. ročník
Soli chemie 9. ročník Impuls chemie
Impuls chemie Magnesiumhydrogencarbonat formel
Magnesiumhydrogencarbonat formel