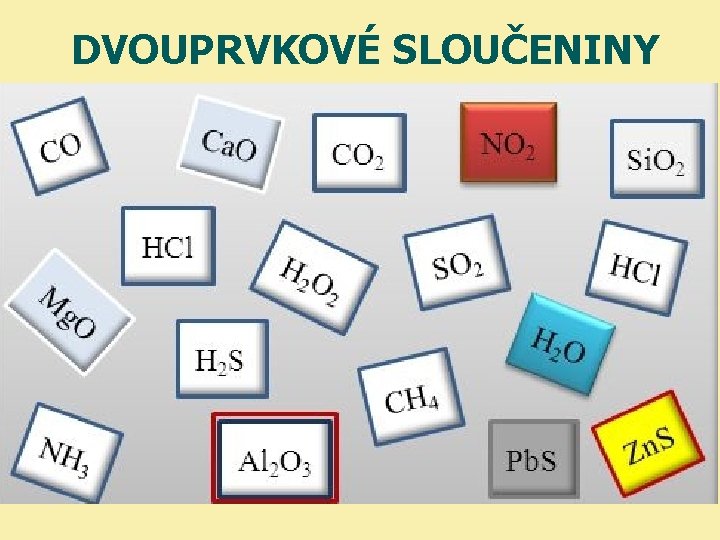
DVOUPRVKOV SLOUENINY Dvouprvkov sloueniny sloeny ze 2 atom













- Slides: 25

DVOUPRVKOVÉ SLOUČENINY

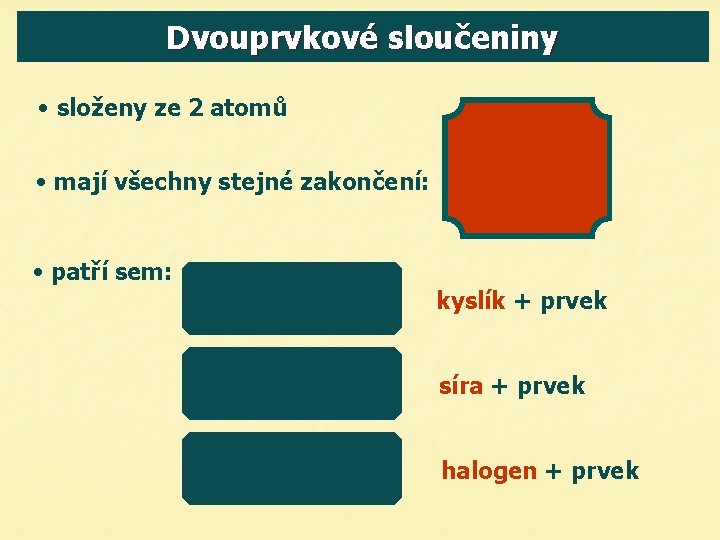
Dvouprvkové sloučeniny • složeny ze 2 atomů • mají všechny stejné zakončení: • patří sem: kyslík + prvek síra + prvek halogen + prvek

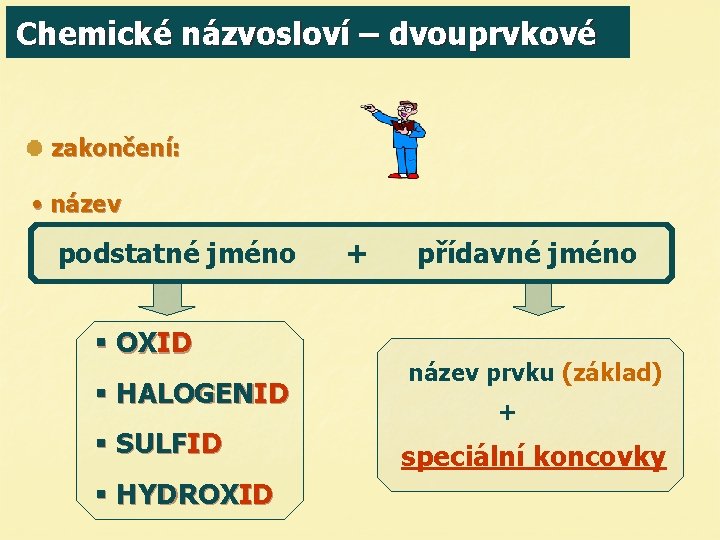
Chemické názvosloví – dvouprvkové zakončení: • název podstatné jméno § OXID § HALOGENID § SULFID § HYDROXID + přídavné jméno název prvku (základ) + speciální koncovky

základní pojem: OXIDAČNÍ ČÍSLO H N H 2 O • atom nebo molekula má OČ rovno nule • římskou číslicí • prvek s větší ENG má záporné OČ ☜ • vodík má vždy +I • ve sloučeninách • kyslík má vždy – II S

Doplňte oxidační čísla: II -II Pb S 0 Fe I Na Ar 0 Mg O-II II Cl-I III Fe 2 O 3 -II

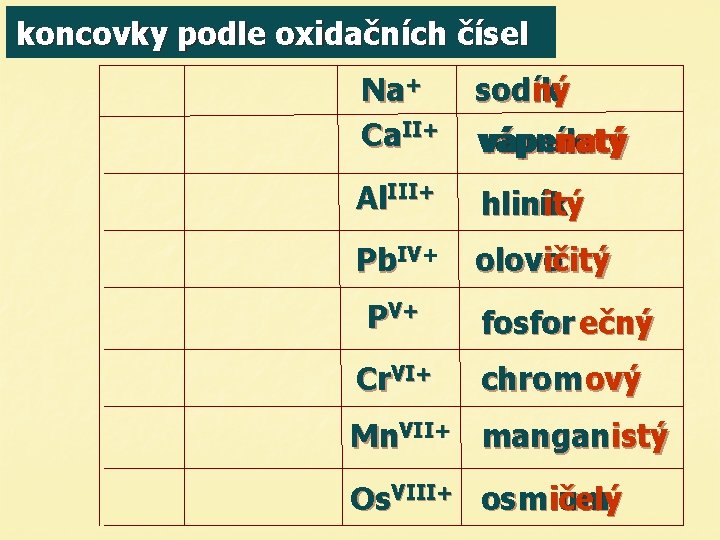
koncovky podle oxidačních čísel Na+ Ca. II+ sodný ík Al. III+ hliník itý Pb. IV+ olovičitý o ičitý vápn vápenatý ík natý PV+ fosfor ečný Cr. VI+ chrom ový Mn. VII+ manganistý Os. VIII+ osm ičelý ium

Li+ lithium ný Mg. II+ hořeč hořčík natý Br. III+ bromitý Si. IV+ křem ičitý ík As. V+ arsen ečný Se. VI+ selenový Cl. VII+ chlor istý

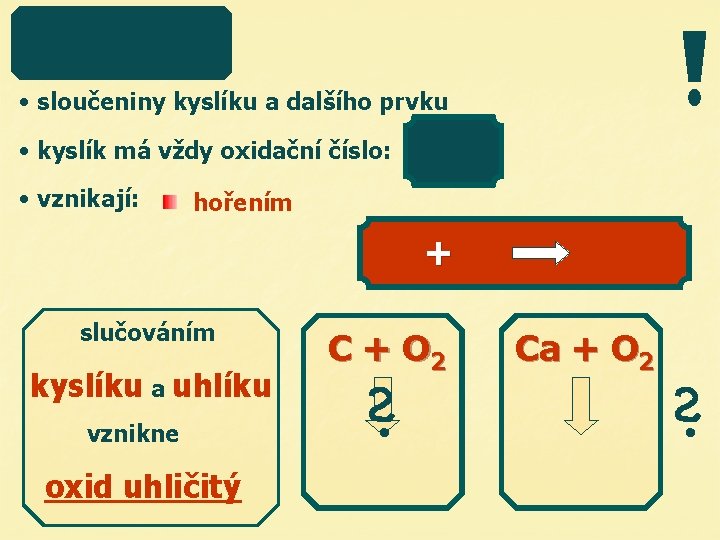
• sloučeniny kyslíku a dalšího prvku • kyslík má vždy oxidační číslo: • vznikají: hořením + slučováním kyslíku a uhlíku vznikne oxid uhličitý C + O 2 Ca + O 2

1) Vzorec z názvu oxid manganistý

1) Vzorec z názvu a) pořadí prvků ve vzorci (obr!) b) oxidační číslo kyslíku oxid železitý c) koncovku přídavného jména d) oxidační číslo prvku e) křížové pravidlo f) „krácení“ oxid sodný ný oxid sírový

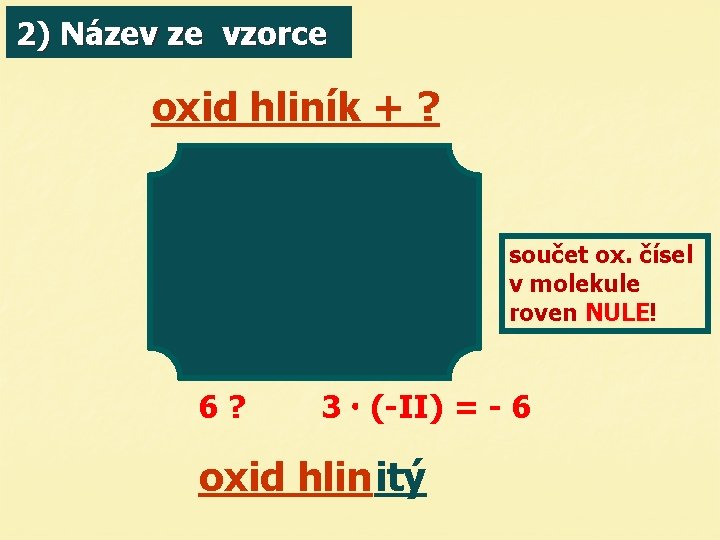
2) Název ze vzorce oxid hliník + ? součet ox. čísel v molekule roven NULE! 6? 3 (-II) = - 6 oxid hlinitý

2) Název ze vzorce a) oxid + přídavné jméno b) pořadí prvků je obrácené c) součet ox. č. = O d) oxidační číslo prvků e) koncovku přídavného jména oxid chromový oxid bromičný oxid měďnatý

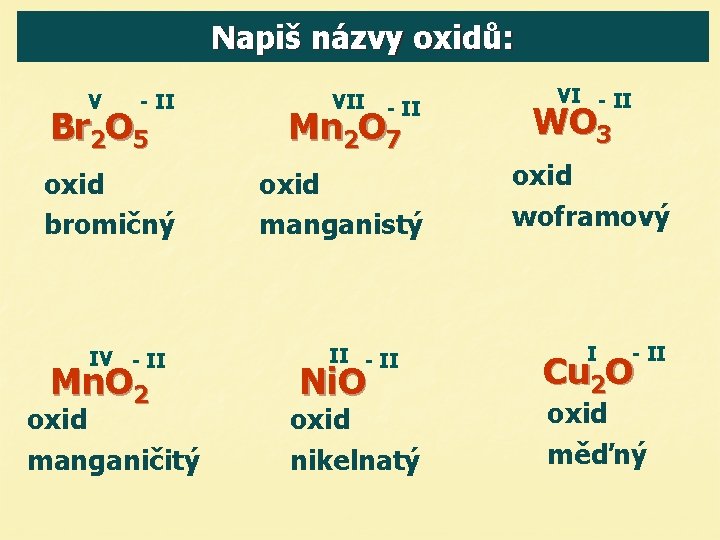
Napiš názvy oxidů: V - II Br 2 O 5 oxid bromičný IV - II Mn. O 2 oxid manganičitý VII - II Mn 2 O 7 oxid manganistý II - II Ni. O oxid nikelnatý VI - II WO 3 oxid woframový I - II Cu 2 O oxid měďný

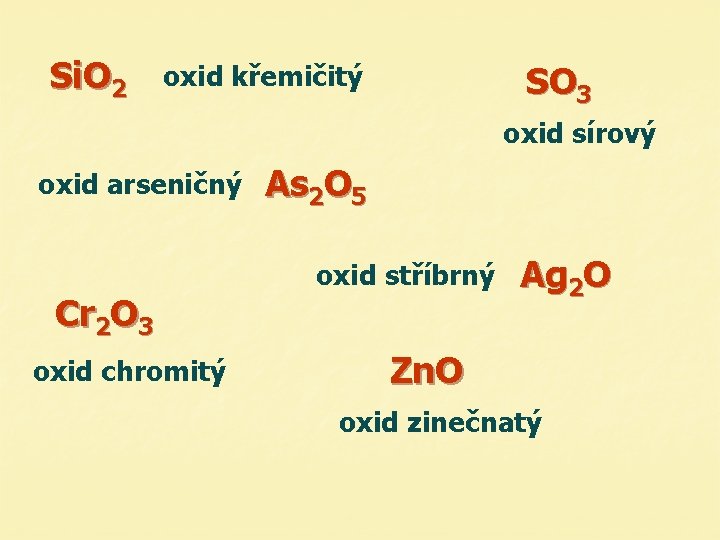
Si. O 2 SO 3 oxid křemičitý oxid sírový oxid arseničný As 2 O 5 oxid stříbrný Cr 2 O 3 oxid chromitý Ag 2 O Zn. O oxid zinečnatý

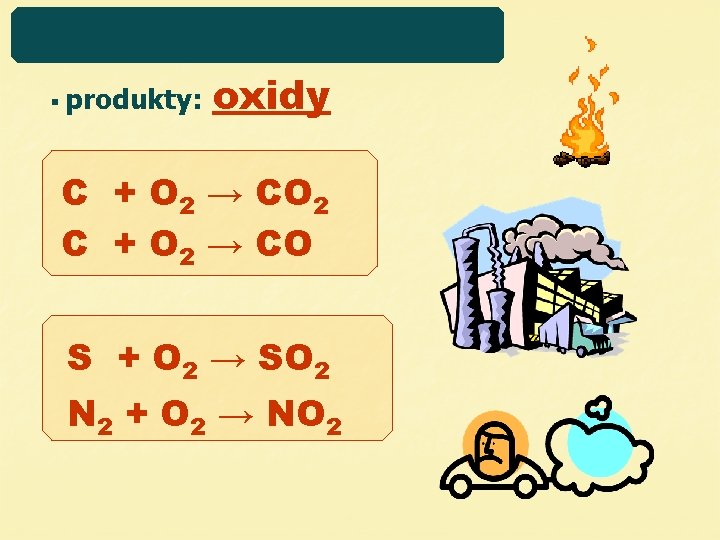
§ produkty: oxidy C + O 2 → CO 2 C + O 2 → CO S + O 2 → SO 2 N 2 + O 2 → NO 2

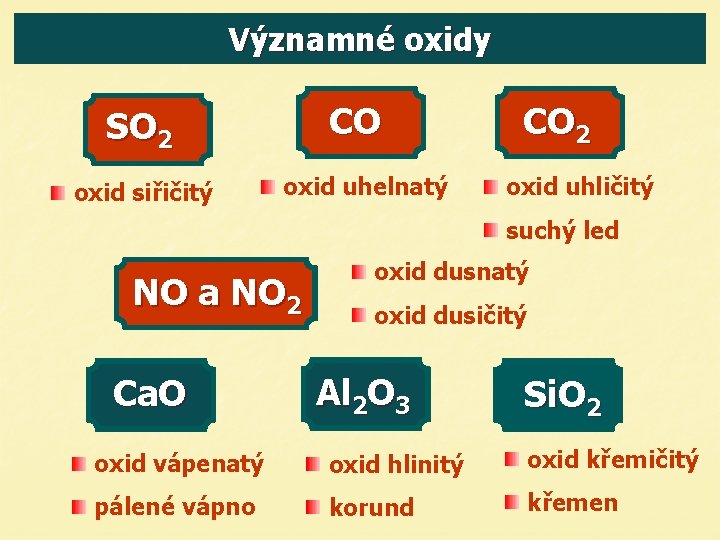
Významné oxidy CO SO 2 oxid siřičitý oxid uhelnatý CO 2 oxid uhličitý suchý led NO a NO 2 Ca. O oxid dusnatý oxid dusičitý Al 2 O 3 Si. O 2 oxid vápenatý oxid hlinitý oxid křemičitý pálené vápno korund křemen

Oxid siřičitý SO 2 n n n bezbarvý plyn štiplavě zapáchající S + O 2 → SO 2 jedovatý vzniká hořením síry, při spalovaní méně kvalitního hnědého uhlí výroba kyseliny sírové, síření sudů a sklepů, bělení KYSELÉ DEŠTĚ: SO 2 + H 2 O → kyselina sírová

Oxid dusnatý NO a oxid dusičitý NO 2 n NO je bezbarvý, NO 2 je červenohnědý n unikají při výrobách n výfukové plyny n KYSELÉ DEŠTĚ: NO 2 + H 2 O → kyselina dusičná

Pokus – příprava oxidu dusičitého Ve škole bychom si červenohnědý oxid dusičitý připravili reakcí mědi s kyselinou dusičnou. Oxid dusičitý je jedovatý, takže bychom museli hodně větrat. Můžeš se alespoň podívat na video: https: //www. youtube. com/watch? v=aw 5 gib. HH Xp 0 Příprava probíhá podle reakce (nemusíš se učit): Cu + HNO 3 → Cu(NO 3)2 + NO 2 + H 2 O měď kyselina dusičná dusičnan měďnatý oxid dusičitý voda

Oxid uhelnatý CO n n bezbarvý jedovatý plyn vzniká nedokonalým spalováním (málo kyslíku) C + O 2 → CO n n součást výfukových plynů váže se na krevní barvivo (hemohlobin) → zabraňuje vazbě kyslíku → OTRAVA

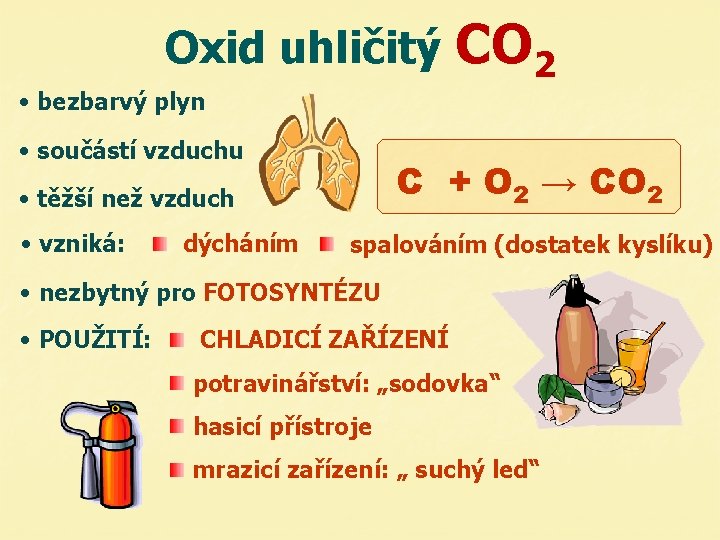
Oxid uhličitý CO 2 • bezbarvý plyn • součástí vzduchu C + O 2 → CO 2 • těžší než vzduch • vzniká: dýcháním spalováním (dostatek kyslíku) • nezbytný pro FOTOSYNTÉZU • POUŽITÍ: CHLADICÍ ZAŘÍZENÍ potravinářství: „sodovka“ hasicí přístroje mrazicí zařízení: „ suchý led“

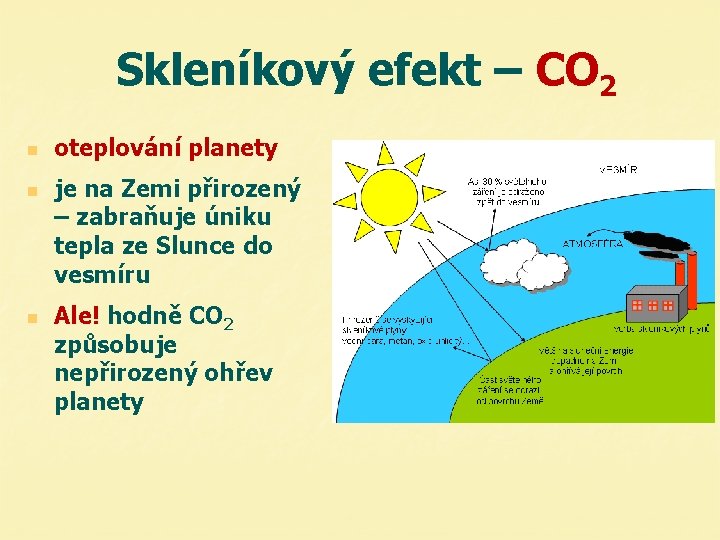
Skleníkový efekt – CO 2 n n n oteplování planety je na Zemi přirozený – zabraňuje úniku tepla ze Slunce do vesmíru Ale! hodně CO 2 způsobuje nepřirozený ohřev planety

Oxid vápenatý Ca. O n pevná bílá látka n silná žíravina n pálené vápno: n n VÁPENEC Ca. CO 3 → Ca. O + CO 2 stavebnictví: pálené vápno, hašené vápno, cement vápnění překyselené půdy

Oxid hlinitý Al 2 O 3 n tvrdý nerost korund n hornina bauxit n smirkový papír (odrůda smirek) n šperky (drahé kameny safír a rubín) n surovina pro výrobu hliníku (bauxit)

Oxid křemičitý Si. O 2 n těžko tavitelná látka n odolná vůči vodě a kyselinám n nerost KŘEMEN n horniny písek, pískovec, žula n výroba skla stavebnictví (písek do malty a betonu) n
 The structure of the atom section 2 defining the atom
The structure of the atom section 2 defining the atom Perkembangan model atom rutherford
Perkembangan model atom rutherford Reaksi pembatas
Reaksi pembatas Periodic table atomic structure
Periodic table atomic structure Atom d525 vs raspberry pi 4
Atom d525 vs raspberry pi 4 Tibbiyot fizikasi fakulteti
Tibbiyot fizikasi fakulteti Bohr model for calcium
Bohr model for calcium Bohr electron configuration
Bohr electron configuration Quantum mechanic model
Quantum mechanic model Atom economy
Atom economy Teori bohr
Teori bohr History of atom discovery
History of atom discovery Lambang atom no 31
Lambang atom no 31 Heavy atom
Heavy atom Ampermérő leolvasása
Ampermérő leolvasása Atom economy formula
Atom economy formula What holds an atom together
What holds an atom together Atom and its structure
Atom and its structure Lego atomic model
Lego atomic model An atom that carries an electrical charge is
An atom that carries an electrical charge is Polihidroksilni alkoholi
Polihidroksilni alkoholi Aldopentoze
Aldopentoze Dwi atom
Dwi atom Teori atom dalton
Teori atom dalton Atom definition
Atom definition Displacements per atom
Displacements per atom