AMINOSAVAK n n a fehrjket aminosavak ptik fel
























- Slides: 47

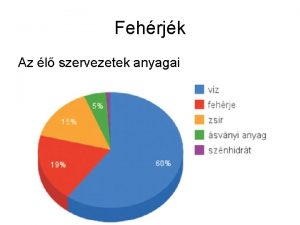
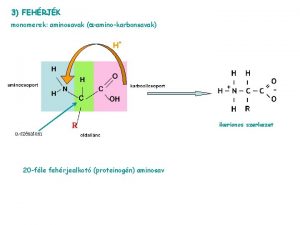
AMINOSAVAK

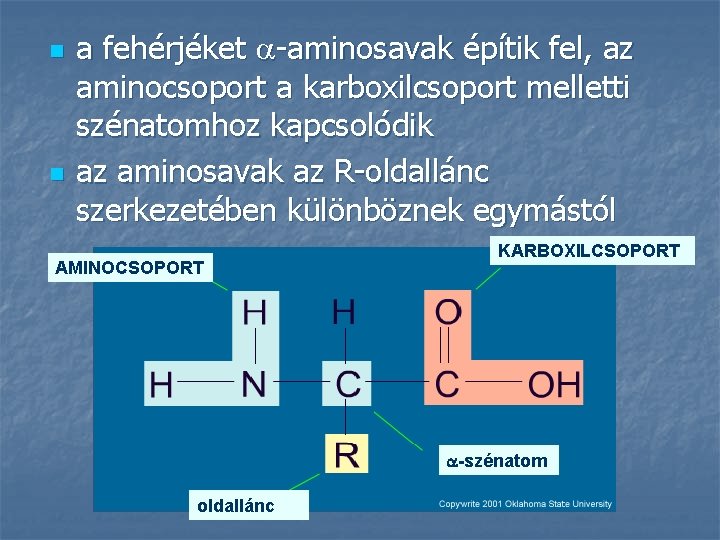
n n a fehérjéket -aminosavak építik fel, az aminocsoport a karboxilcsoport melletti szénatomhoz kapcsolódik az aminosavak az R-oldallánc szerkezetében különböznek egymástól AMINOCSOPORT KARBOXILCSOPORT -szénatom oldallánc

Az aminosavak rövidítései (hárombetűs ill. egybetűs) Alanin: Ala; A Izoleucin: Ile; I Arginin: Arg; R Leucin: Leu; L Aszparagin: Asn; N Aszparaginsav (aszpartát): Asp; D Lizin: Lys; K Metionin: Met; M Cisztein: Cys; C Prolin: Pro; P Fenilalanin: Phe; F Szerin: Ser; S Glutamin: Gln; Q Treonin: Thr; T Glutaminsav (glutamát): Glu; E Triptofán: Trp; W Glicin: Gly; G Tirozin: Tyr; Y Hisztidin: His; H Valin: Val; V

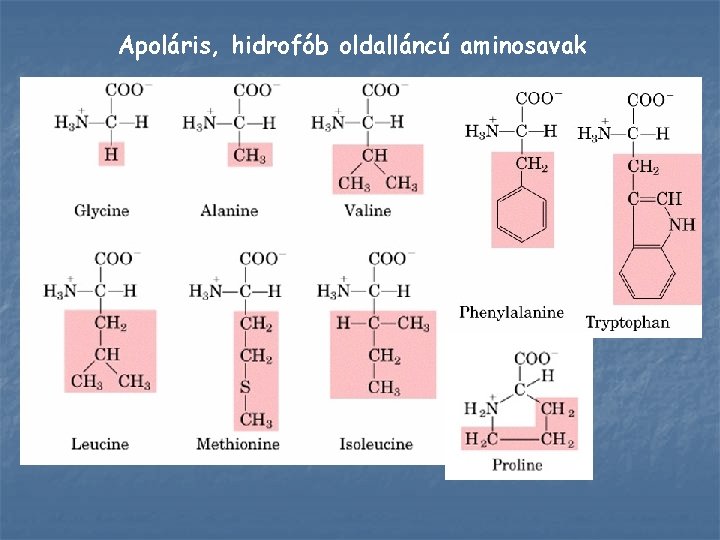
Apoláris, hidrofób oldalláncú aminosavak

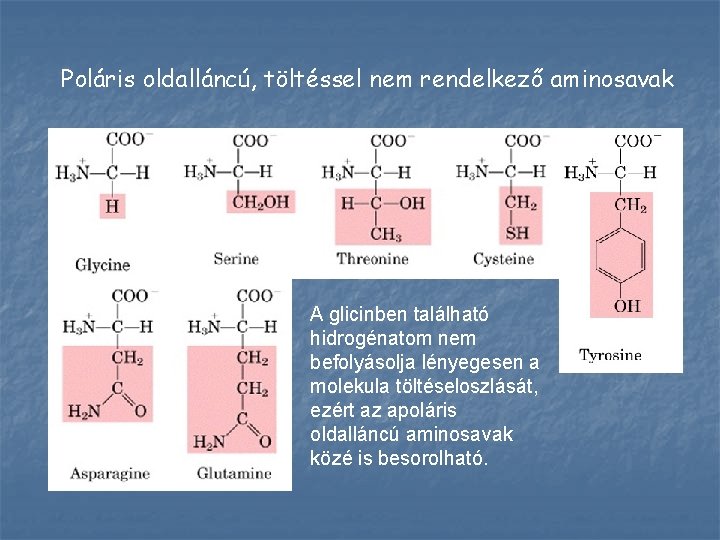
Poláris oldalláncú, töltéssel nem rendelkező aminosavak A glicinben található hidrogénatom nem befolyásolja lényegesen a molekula töltéseloszlását, ezért az apoláris oldalláncú aminosavak közé is besorolható.

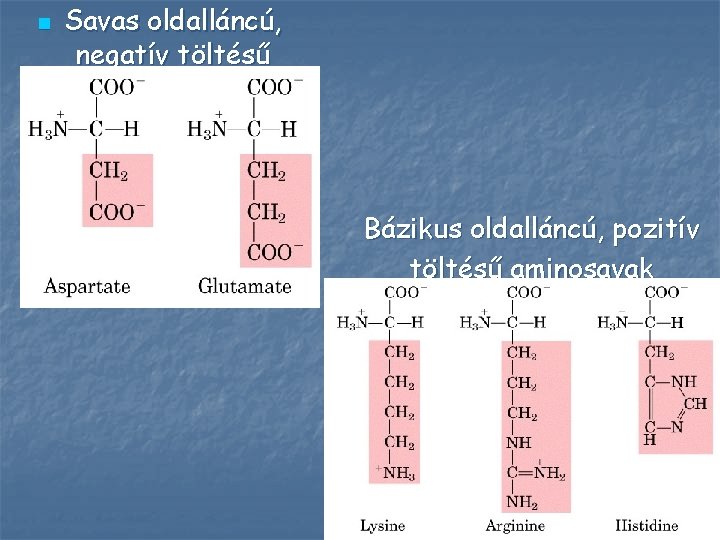
n Savas oldalláncú, negatív töltésű aminosavak Bázikus oldalláncú, pozitív töltésű aminosavak

Néhány ritka aminosav n N-metil-lizin n N-metil-hisztidin n 4 -hidroxi-prolin n 5 -hidroxi-lizin n -karboxi-glutamát

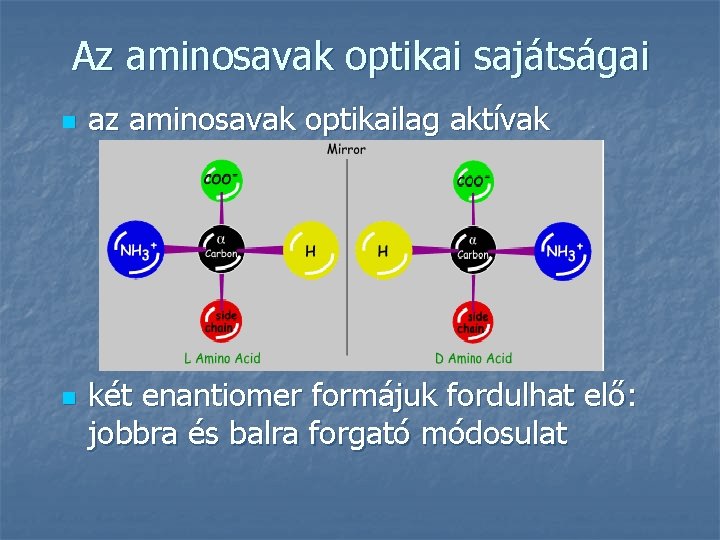
Az aminosavak optikai sajátságai n n az aminosavak optikailag aktívak két enantiomer formájuk fordulhat elő: jobbra és balra forgató módosulat

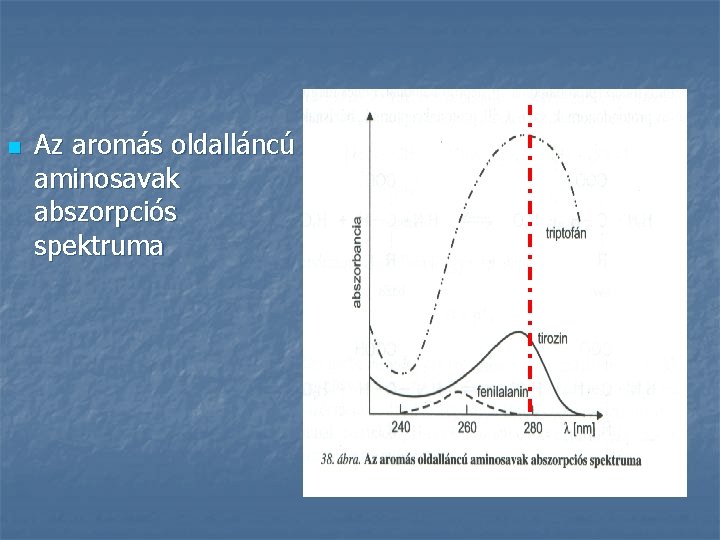
n Az aromás oldalláncú aminosavak abszorpciós spektruma

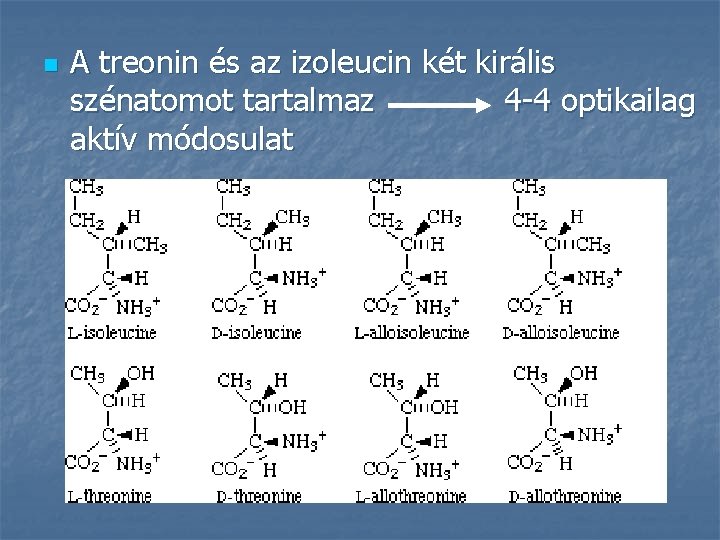
n A treonin és az izoleucin két királis szénatomot tartalmaz 4 -4 optikailag aktív módosulat

Az aminosavak sav-bázis jellege n n Mindkét funkciós csoport reverzíbilisen protonálódhat, ill. deprotonálódhat az aminosavak amfoter tulajdonsága alakítja ki az ikerionos szerkezetet

n n azt a p. H-értéket, ahol az aminosav teljes mennyisége ikerion formában van jelen izoelektromos pontnak nevezzük a Henderson-Hasselbach egyenlet segítségével kiszámíthatók az amino- és karboxilcsoportra jellemző savi disszociációs állandók:

n Az izoelektromos pontot (IP) a p. KCOOH és p. KNH 2 értéke határozza meg:

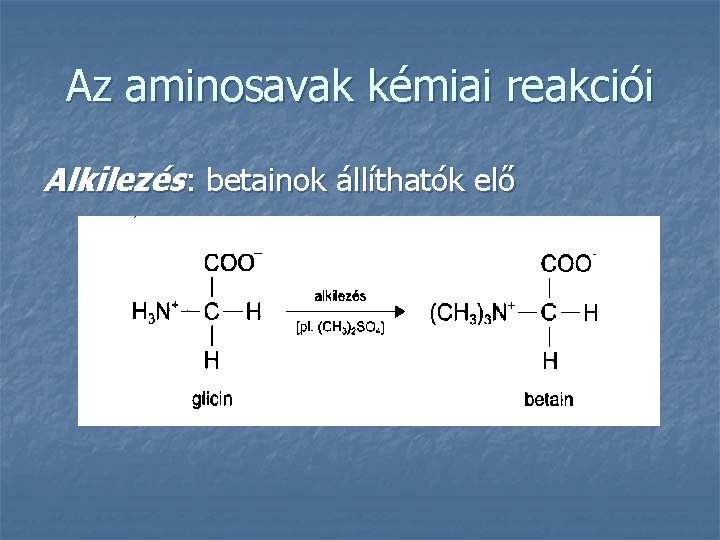
Az aminosavak kémiai reakciói Alkilezés: betainok állíthatók elő

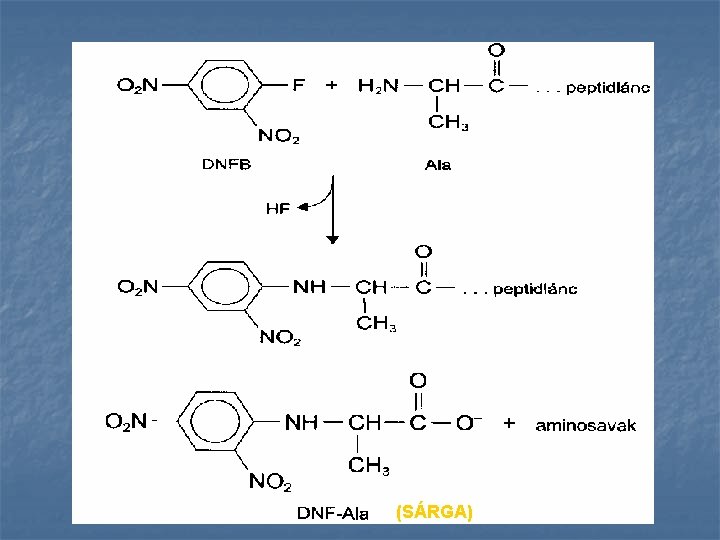
n Arilezés: aromás oldallánc kapcsolódik az aminosavak aminocsoportjához n A folyamat lépései: amino-terminális aminosav jelölése n peptid vagy fehérje hidrolízise n dinitro-fenil-aminosav azonosítása n

(SÁRGA)

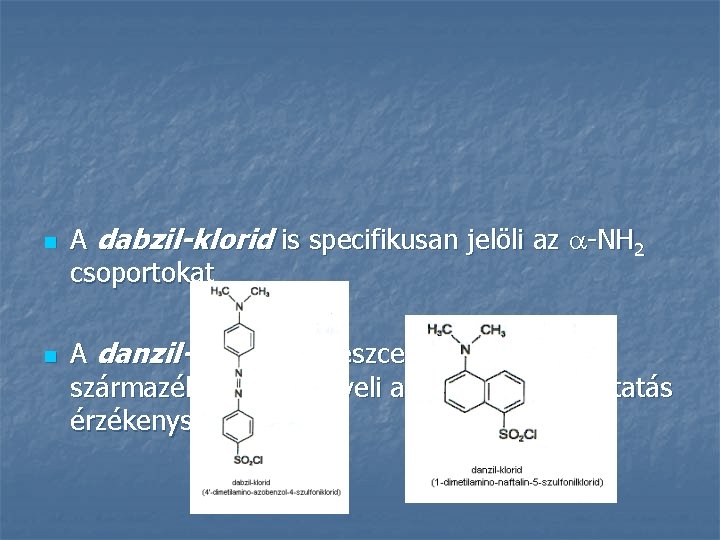
n n A dabzil-klorid is specifikusan jelöli az -NH 2 csoportokat A danzil-klorid fluoreszcens szulfonsavszármazék, tovább növeli az aminosav-kimutatás érzékenységét:

Az N-terminális aminosavak meghatározásának főbb lépései fluoreszcens származék segítségével: amino-terminális aminosav jelölése Ø peptid vagy fehérje hidrolízise Ø a módosított aminosav fotometriás vagy fluorimetriás azonosítása Ø


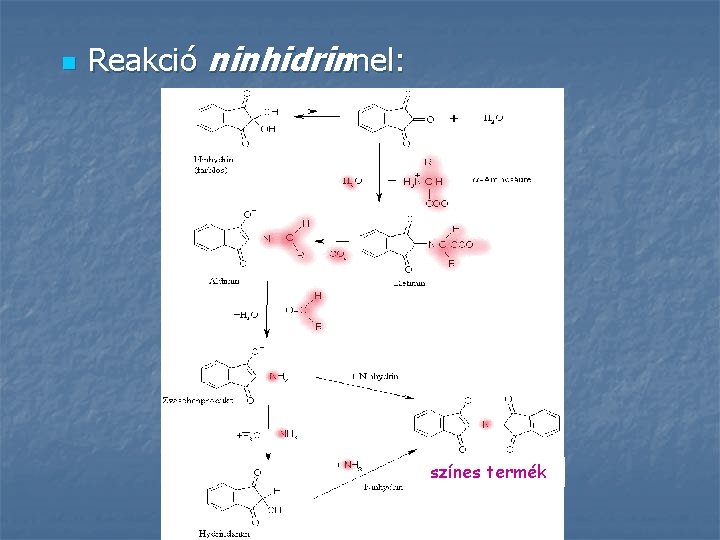
n Reakció ninhidrinnel: színes termék

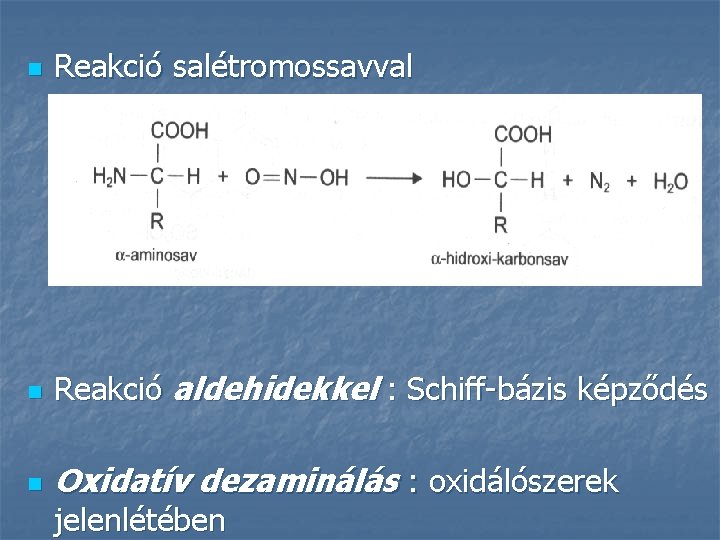
n Reakció salétromossavval n Reakció aldehidekkel : Schiff-bázis képződés n Oxidatív dezaminálás : oxidálószerek jelenlétében

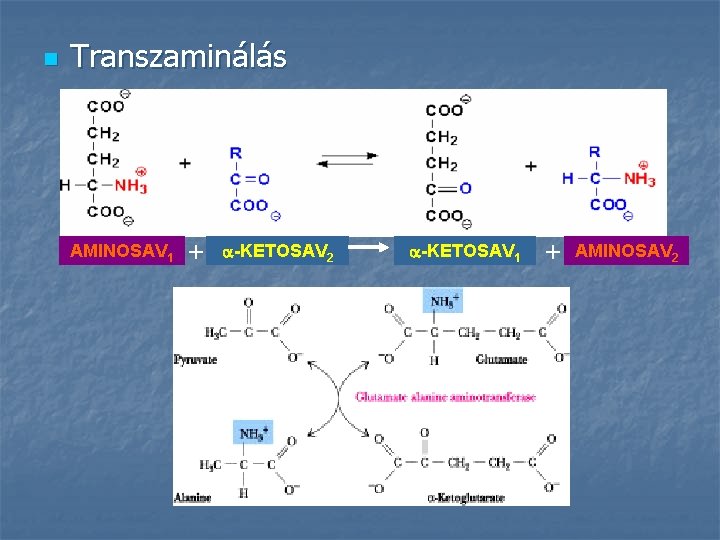
n Transzaminálás AMINOSAV 1 + -KETOSAV 2 -KETOSAV 1 + AMINOSAV 2

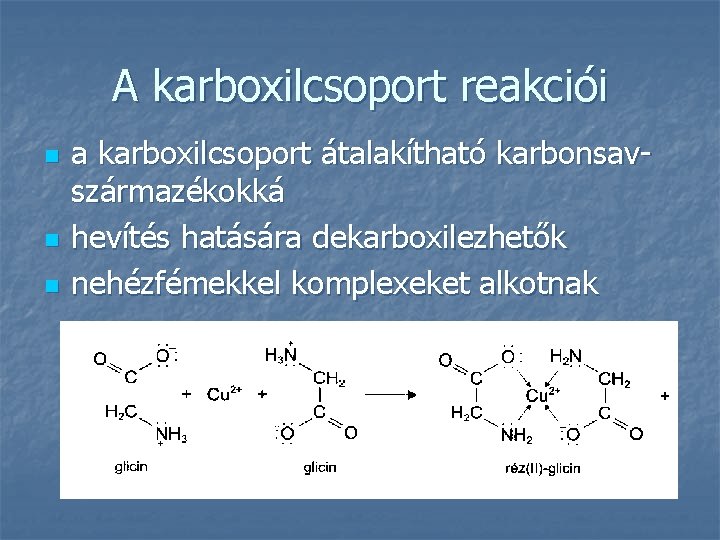
A karboxilcsoport reakciói n n n a karboxilcsoport átalakítható karbonsavszármazékokká hevítés hatására dekarboxilezhetők nehézfémekkel komplexeket alkotnak

Aminosavelegyek analízise n Elektroforézis n Ioncserélő kromatográfia n HPLC (High Performance Liquid Chromatograpy)

PEPTIDEK ÉS FEHÉRJÉK

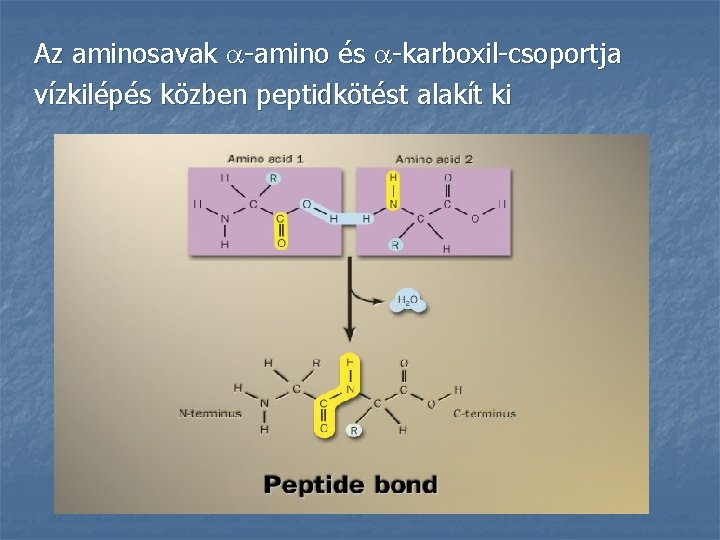
Az aminosavak -amino és -karboxil-csoportja vízkilépés közben peptidkötést alakít ki

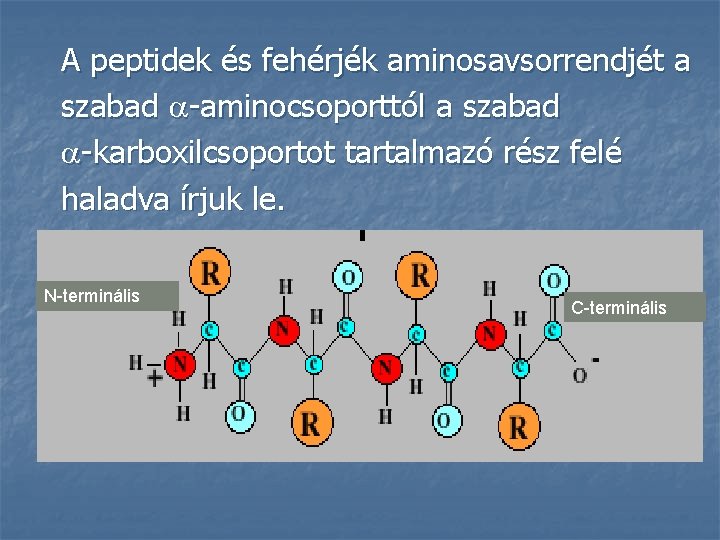
A peptidek és fehérjék aminosavsorrendjét a szabad -aminocsoporttól a szabad -karboxilcsoportot tartalmazó rész felé haladva írjuk le. N-terminális C-terminális

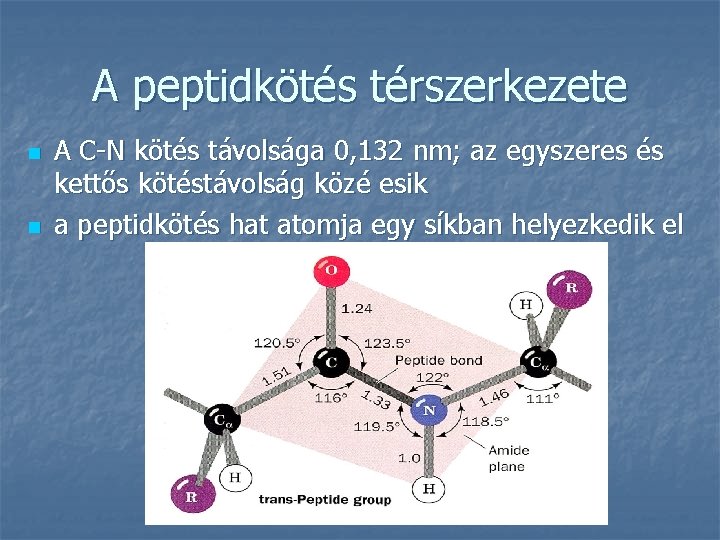
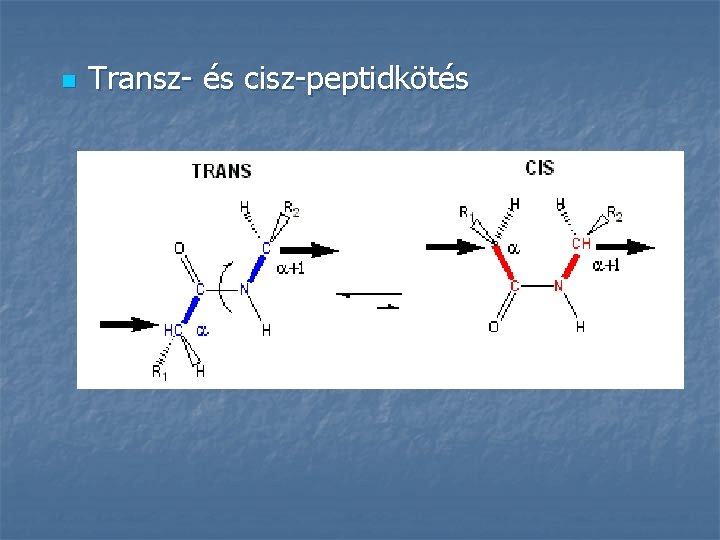
A peptidkötés térszerkezete n n A C-N kötés távolsága 0, 132 nm; az egyszeres és kettős kötéstávolság közé esik a peptidkötés hat atomja egy síkban helyezkedik el

n Transz- és cisz-peptidkötés

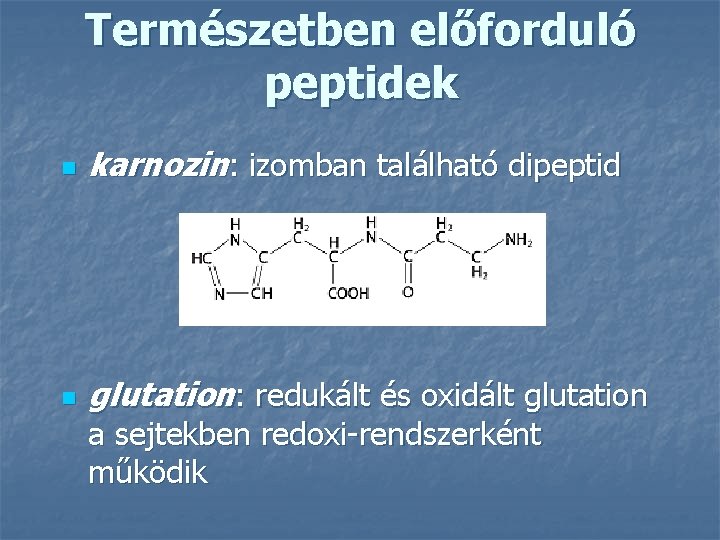
Természetben előforduló peptidek n karnozin: izomban található dipeptid n glutation: redukált és oxidált glutation a sejtekben redoxi-rendszerként működik


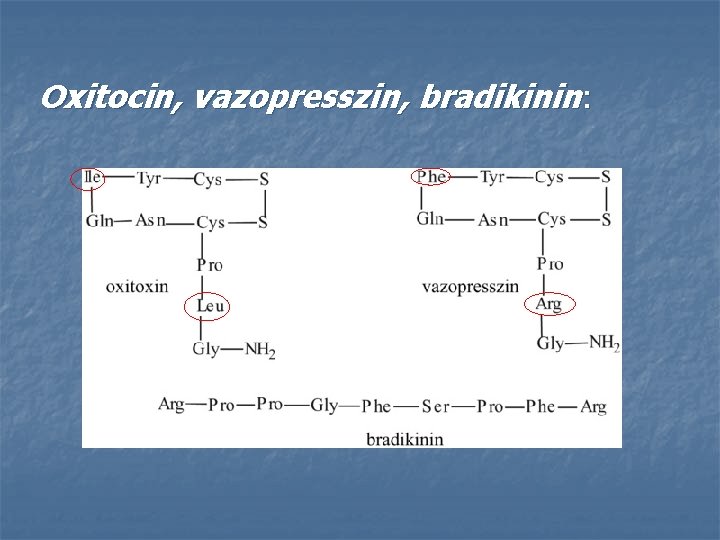
Oxitocin, vazopresszin, bradikinin:

Inzulin: n n két polipeptid-láncból épül fel, amelyeket két diszulfidhíd köt össze fémionok (pl. Zn 2+) stabilizálják a szerkezetét

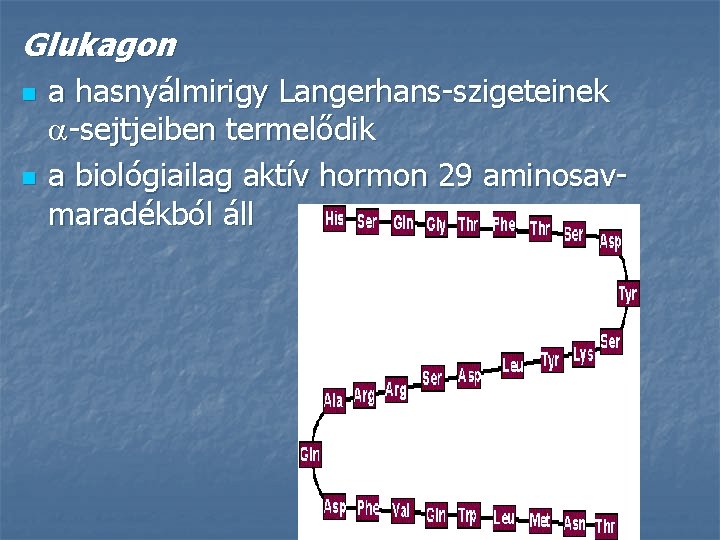
Glukagon n n a hasnyálmirigy Langerhans-szigeteinek -sejtjeiben termelődik a biológiailag aktív hormon 29 aminosavmaradékból áll

Fehérjék (proteinek) n makromolekulák n az egyszerű fehérjék n összetett fehérjék (proteidek)

Csoportosítás Biológiai funkció alapján: 2. Enzimek (tripszin) Transzportfehérjék 3. Kontraktilis fehérjék 1. 4. 5. 6. 7. Alak szerint: n n (hemoglobin) (miozin) Vázfehérjék (kollagén) Tartalékfehérje (kazein) Védőfehérjék (ellenanyagok) Hormonok (inzulin) globuláris fehérjék n pl. enzimek fibrilláris fehérjék n pl. kollagén

Fizikai és kémiai tulajdonságok: n a molekulatömeg széles határok között változik n elválasztásukra és kimutatásukra gyakran alkalmazzák a fehérjék kicsapási reakcióit n a kicsapás reverzíbilis és irreverzíbilis lehet reverzíbilis: kisózás neutrális sókkal, kicsapás szerves oldószerekkel n irreverzíbilis: melegítéssel, tömény ásványi savakkal, lúgokkal, nehézfémsókkal, rázással n

A fehérjék kimutatása színreakciókkal: n Xantoprotein-reakció: aromás aminosavakat tartalmazó fehérjék tömény salétromsav hatására kicsapódnak. Sárga színreakció. n Millon-reakció: tirozint tartalmazó fehérjék Millon- n Adamkiewicz-próba: a triptofán tartalmú fehérjék n Kéntartalom kimutatása: ólom-acetáttal és nátrium- n Ninhidrin: pozitív reakció esetén kékesibolya n Biuret-reakció: lúgos közegben réz-szulfát oldat reagens hatására vörös csapadékot képeznek. tömény kénsav és glioxilsav jelenlétében ibolyaszínű kondenzációs terméket képeznek. hidroxiddal melegítve fekete csapadék képződik. elszíneződés. hatására ibolyaszín elszíneződés.

Fehérjék térszerkezete n n Elsődleges szerkezet: aminosavsorrend Másodlagos szerkezet: a polipeptidlánc periodikus rendezettsége -hélix: a polipeptidlánc csavarmenetszerűen rendeződik n -szerkezet: két vagy több polipeptidlánc , polipeptidlánc-szakasz között kialakuló redőzött lemez, lehet paralel és antiparalel n



n A másodlagos szerkezet fontos elemei a hajtűkanyarok vagy -kanyarok, melyek lehetővé teszik a polipeptidlánc visszahajlását

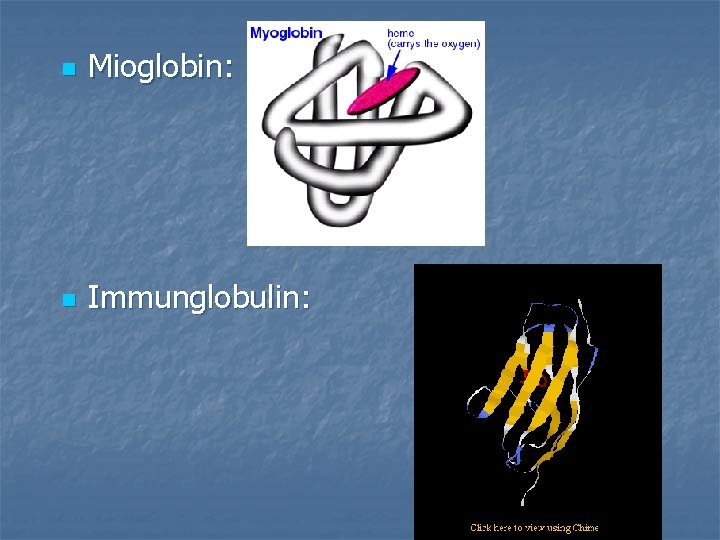
Harmadlagos szerkezet: n a polipeptidlánc periodikusan rendezett és periodikus rendezettséget nem mutató szakaszai egymás közelébe kerülnek és háromdimenziós globuláris térszerkezetet hoznak létre n a térszerkezet kialakításában szerepet játszanak: diszulfidhidak, hirdrogénkötések, elektrosztatikus kölcsönhatások, és hidrofób kölcsönhatások


n Mioglobin: n Immunglobulin:

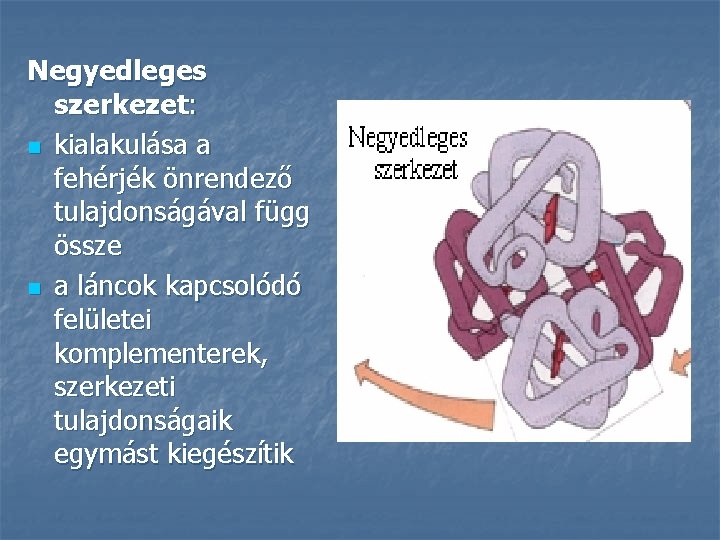
Negyedleges szerkezet: n kialakulása a fehérjék önrendező tulajdonságával függ össze n a láncok kapcsolódó felületei komplementerek, szerkezeti tulajdonságaik egymást kiegészítik

 Befordított metszet
Befordított metszet Sister unm makassar
Sister unm makassar Ptik.ft.unm
Ptik.ft.unm Trias ptik
Trias ptik Pte ptik
Pte ptik Fel moodle
Fel moodle Fel front end loading
Fel front end loading Sorolj fel természettudományokat
Sorolj fel természettudományokat Adstipulatio
Adstipulatio Leo fel
Leo fel Verificador publico de dte sat
Verificador publico de dte sat Leo fel
Leo fel Sase fel
Sase fel Felning
Felning Qo'shma fel
Qo'shma fel Tuturor pronume
Tuturor pronume Moodle fel
Moodle fel Ki itt belépsz hagyj fel minden reménnyel
Ki itt belépsz hagyj fel minden reménnyel Fel fac
Fel fac Otgan zamon
Otgan zamon Fel 1
Fel 1 Sodda fe'llar
Sodda fe'llar Swiss fel
Swiss fel Habarcs megkötésekor keletkezik
Habarcs megkötésekor keletkezik Teorema conservarii energiei mecanice
Teorema conservarii energiei mecanice Zárójelfelbontás feladatok
Zárójelfelbontás feladatok Hány féle aminosav építi fel a fehérjéket
Hány féle aminosav építi fel a fehérjéket