ALKANA 1 2 Alkana senyawa organik yang miskin










![Penentuan bilangan oksidasi ] 1. Untuk setiap atom dalam ikatan, atom elektropositif bilangan oksidasinya Penentuan bilangan oksidasi ] 1. Untuk setiap atom dalam ikatan, atom elektropositif bilangan oksidasinya](https://slidetodoc.com/presentation_image_h2/4847cda4fc8aed5bace9dc93b28fcc60/image-31.jpg)

- Slides: 36

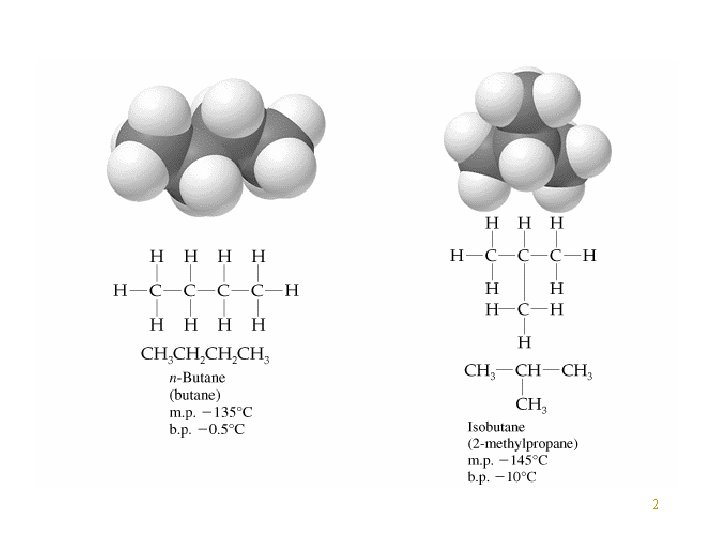
ALKANA 1

2

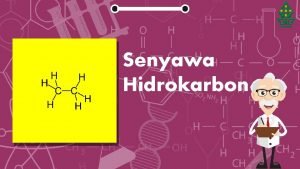
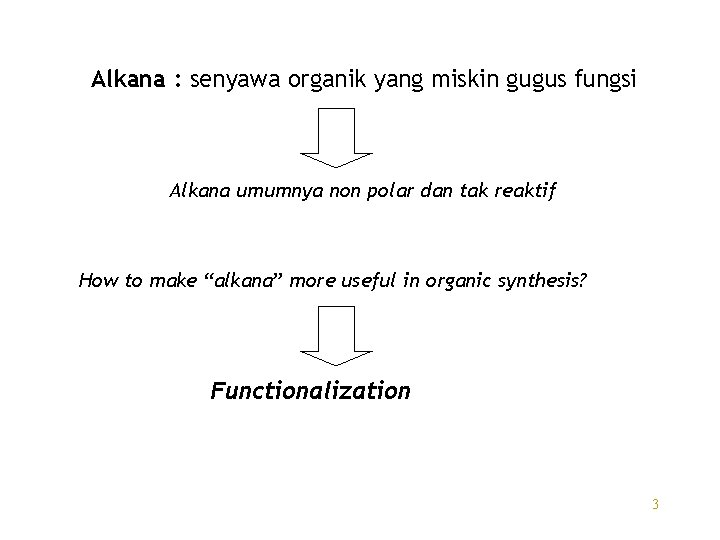
Alkana : senyawa organik yang miskin gugus fungsi Alkana umumnya non polar dan tak reaktif How to make “alkana” more useful in organic synthesis? Functionalization 3

Review Jenis pemutusan ikatan: - homolitik (terjadi pada pelarut non polar dan fasa gas) - heterolitik (terjadi pada pelarut polar dan terbatas pada situasi di mana keelektronegatifan A dan B dan gugus-gugus yang terikat pada mereka saling menstabilkan muatan (+) dan (-)) Kestabilan radikal menentukan kekuatan ikatan C-H Energi ikatan kekuatan berkurang : CH 4> 1 o. C > 2 o. C > 3 o. C Kestabilan radikal ditentukan oleh delokalisasi elektron di mana orbital p pada pusat radikal overlapping dengan ikatan C-H di sebelahnya ……… hiperkonyugasi >>>struktur hampir planar, dengan posisi elektron tunggal pada orbital p pada posisi tegak lurus terhadap bidang molekul 4

Resonansi dan hiperkonyugasi: - pada keduanya terjadi interaksi elektron pada orbital p yang memberikan delokalisasi elektron stabil - terdapat perbedaan pada tipe orbital: pada resonansi tipe p overlap dengan orbital p pada hiperkonyugasi overlap orbital-orbital ikatan tipe s Kestabilan radikal -pengaruh terjejalnya halangan antara substituen-substituen pada radikal alkil sekunder dan alkil tersier (steric crowding) yang semakin leluasa karena pengaruh perubahan geometri tetrahedral planar (dalam radikal) (pada radikal tersier, substituen-substituen semakin berjauhan halangan sterik makin berkurang, jadi makin stabil) 5

6

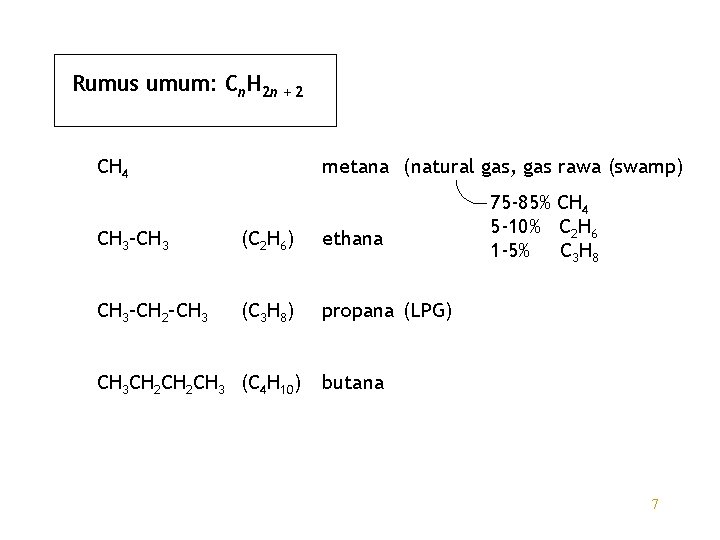
Rumus umum: Cn. H 2 n + 2 CH 4 metana (natural gas, gas rawa (swamp) CH 3–CH 3 (C 2 H 6) ethana CH 3–CH 2–CH 3 (C 3 H 8) propana (LPG) CH 3 CH 2 CH 3 (C 4 H 10) 75 -85% CH 4 5 -10% C 2 H 6 1 -5% C 3 H 8 butana 7

8

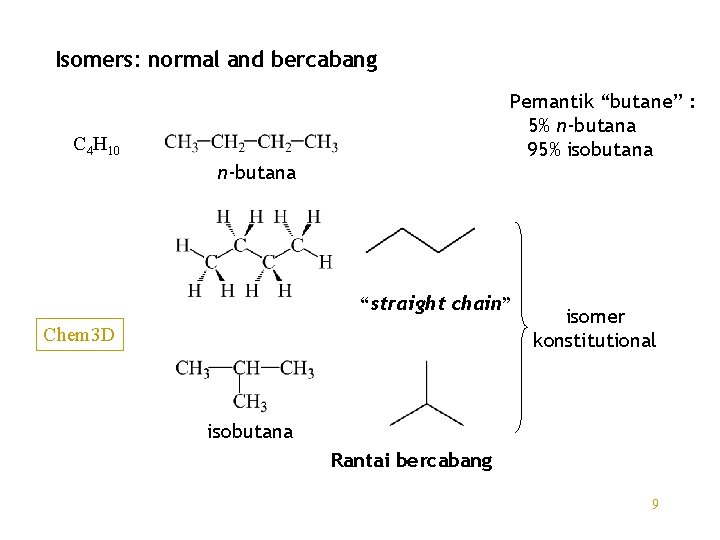
Isomers: normal and bercabang Pemantik “butane” : 5% n-butana 95% isobutana C 4 H 10 n-butana “straight chain” Chem 3 D isomer konstitutional isobutana Rantai bercabang 9

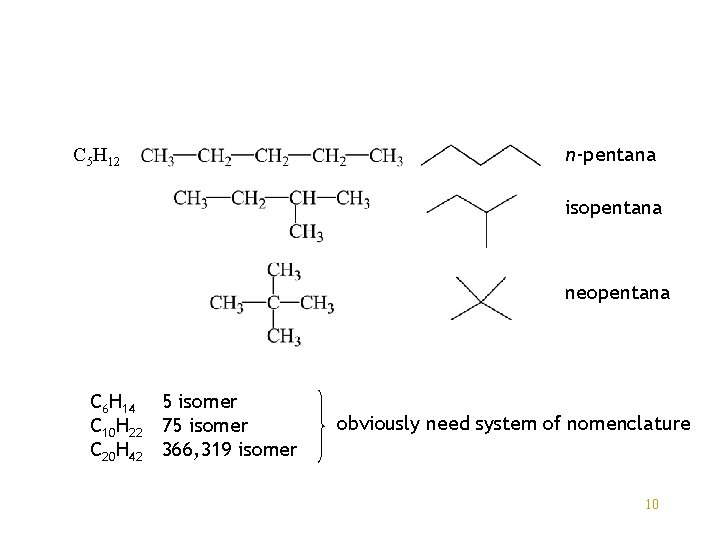
C 5 H 12 n-pentana isopentana neopentana C 6 H 14 5 isomer C 10 H 22 75 isomer C 20 H 42 366, 319 isomer obviously need system of nomenclature 10

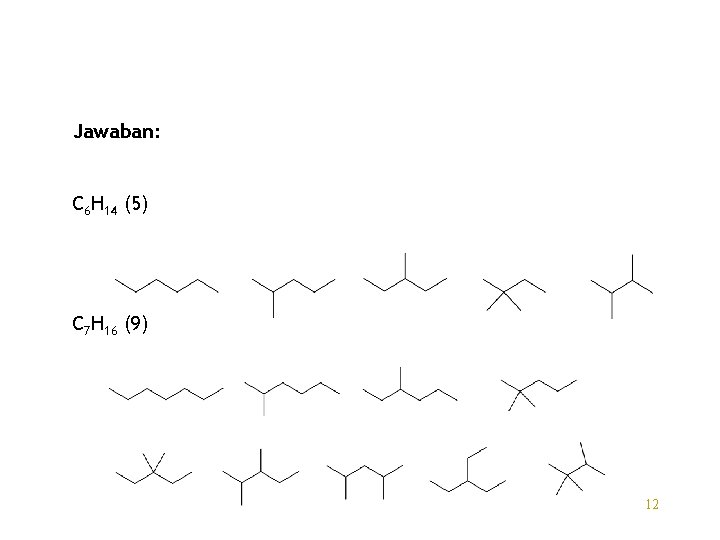
Contoh soal: Gambarkan isomer konstitusional berikut. C 6 H 14 (5) C 7 H 16 (9) Check Answer 11

Jawaban: C 6 H 14 (5) C 7 H 16 (9) 12

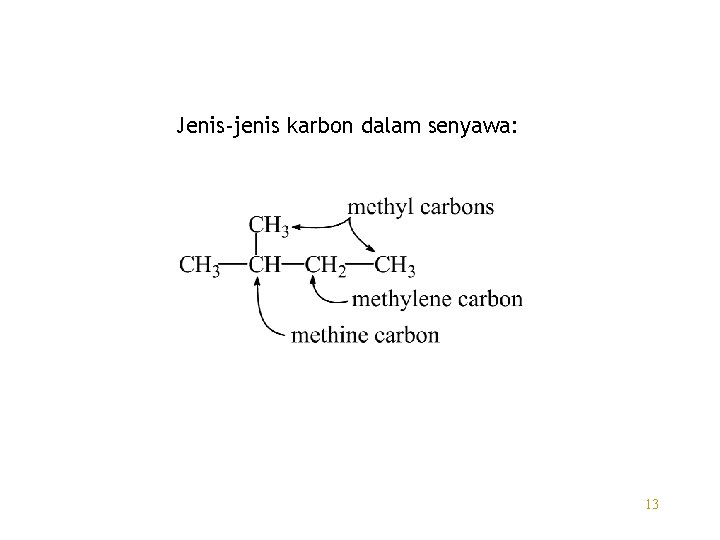
Jenis-jenis karbon dalam senyawa: 13

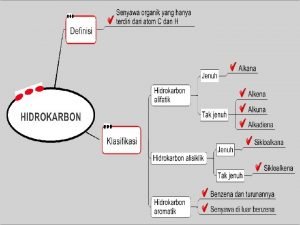
Senyawa hidrokarbon hanya mengandung karbon dan hidrogen : ikatan tunggal (ikatan s) …………. Alkana Cn. H 2 n+2 Ø Hidrokarbon jenuh Ø Hidrokarbon tak jenuh : mengandung ikatan ganda (ikatan p) ……Cn. H 2 n Ø Hidrokarbon alifatik : rantai terbuka (lurus atau bercabang) Ø Hidrokarbon siklik : Cn. H 2 n Cincin atau ikatan rangkap mengurangi 2 H pada ikatan rangkap atau tiap cincin Contoh: CH 3 CH 2 CH 3 CH 2 CH=CH 2 C 4 H 10 C 4 H 8 Cn. H 2 n C 4 H 8 mengandung 1 double bond equivalen (DBE) atau 1 ikatan rangkap atau 1 cincin Cn. H 2 n-2 mengandung 2 double bond equivalen (DBE) atau 1 ikatan rangkap, 1 cincin, 2 ikatan rangkap, atau 2 cincin 14

15

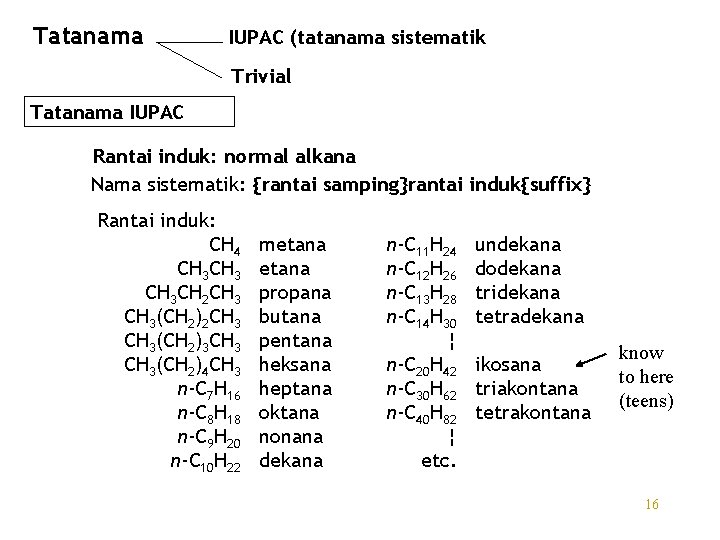
Tatanama IUPAC (tatanama sistematik Trivial Tatanama IUPAC Rantai induk: normal alkana Nama sistematik: {rantai samping}rantai induk{suffix} Rantai induk: CH 4 CH 3 CH 2 CH 3(CH 2)3 CH 3(CH 2)4 CH 3 n-C 7 H 16 n-C 8 H 18 n-C 9 H 20 n-C 10 H 22 metana propana butana pentana heksana heptana oktana nonana dekana n-C 11 H 24 n-C 12 H 26 n-C 13 H 28 n-C 14 H 30 ¦ n-C 20 H 42 n-C 30 H 62 n-C 40 H 82 ¦ etc. undekana dodekana tridekana tetradekana ikosana triakontana tetrakontana know to here (teens) 16

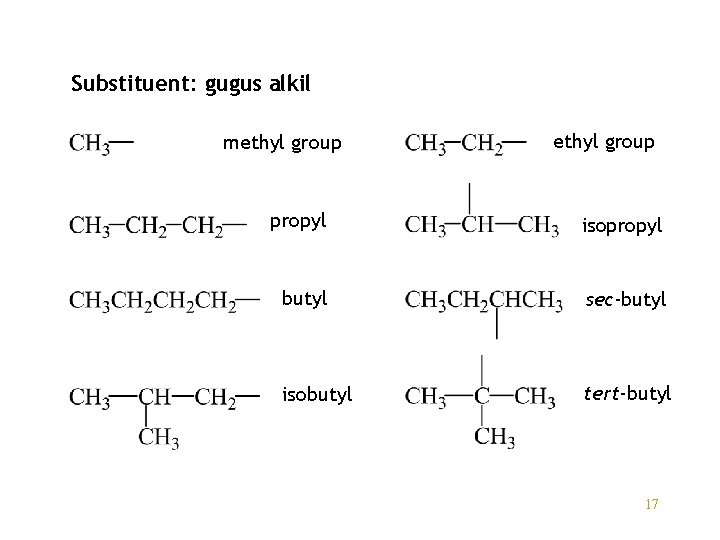
Substituent: gugus alkil methyl group propyl isopropyl butyl sec-butyl isobutyl tert-butyl 17

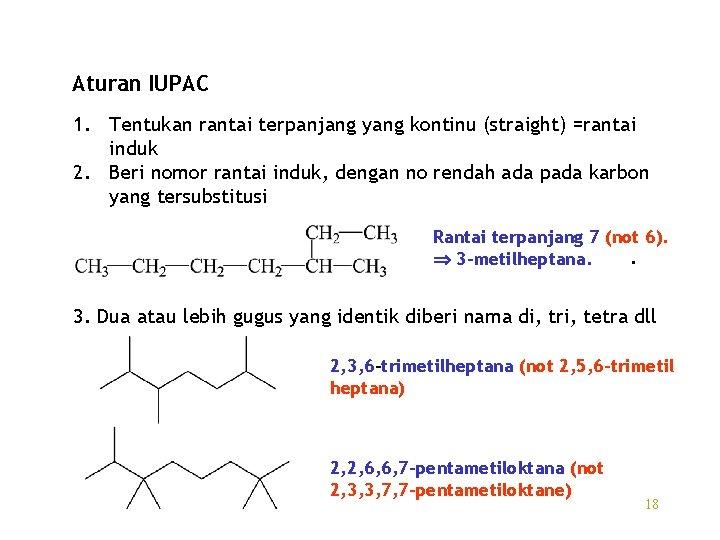
Aturan IUPAC 1. Tentukan rantai terpanjang yang kontinu (straight) =rantai induk 2. Beri nomor rantai induk, dengan no rendah ada pada karbon yang tersubstitusi Rantai terpanjang 7 (not 6). . 3 -metilheptana. 3. Dua atau lebih gugus yang identik diberi nama di, tri, tetra dll 2, 3, 6 -trimetilheptana (not 2, 5, 6 -trimetil heptana) 2, 2, 6, 6, 7 -pentametiloktana (not 2, 3, 3, 7, 7 -pentametiloktane) 18

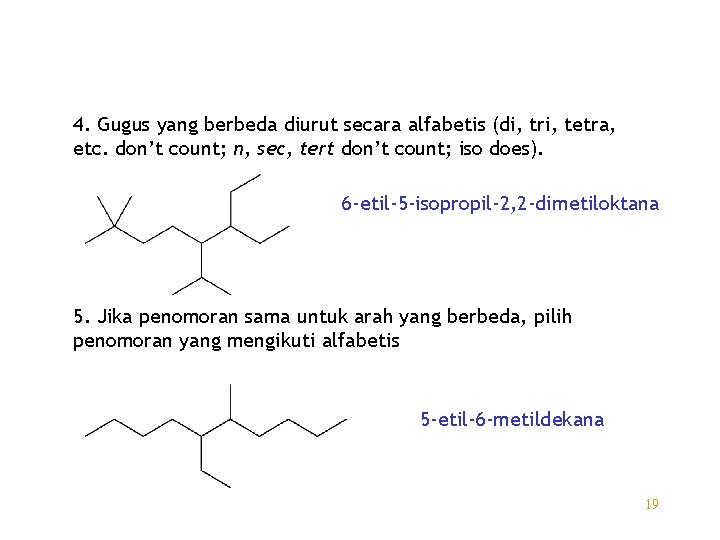
4. Gugus yang berbeda diurut secara alfabetis (di, tri, tetra, etc. don’t count; n, sec, tert don’t count; iso does). 6 -etil-5 -isopropil-2, 2 -dimetiloktana 5. Jika penomoran sama untuk arah yang berbeda, pilih penomoran yang mengikuti alfabetis 5 -etil-6 -metildekana 19

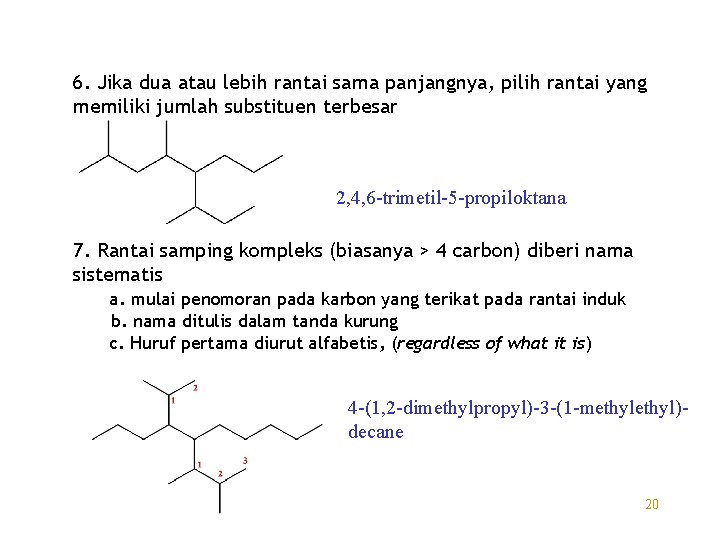
6. Jika dua atau lebih rantai sama panjangnya, pilih rantai yang memiliki jumlah substituen terbesar 2, 4, 6 -trimetil-5 -propiloktana 7. Rantai samping kompleks (biasanya > 4 carbon) diberi nama sistematis a. mulai penomoran pada karbon yang terikat pada rantai induk b. nama ditulis dalam tanda kurung c. Huruf pertama diurut alfabetis, (regardless of what it is) 4 -(1, 2 -dimethylpropyl)-3 -(1 -methyl)decane 20

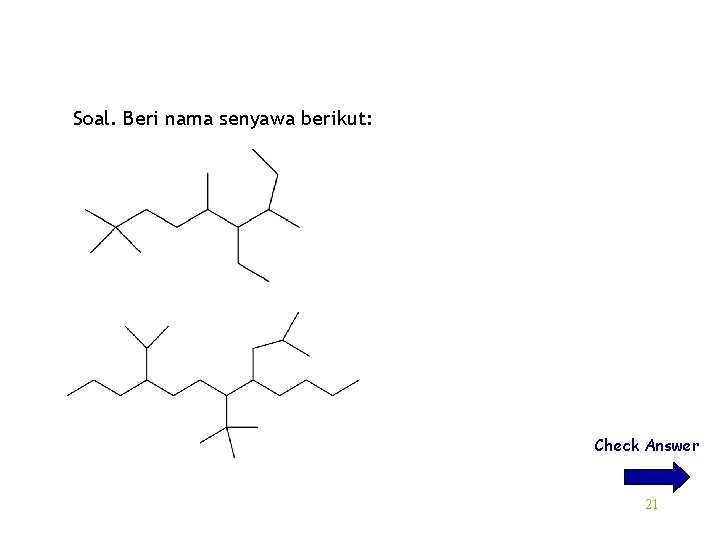
Soal. Beri nama senyawa berikut: Check Answer 21

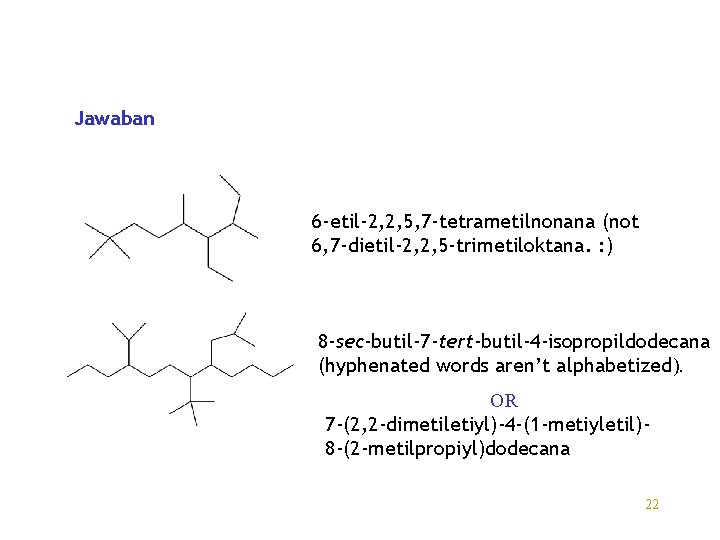
Jawaban 6 -etil-2, 2, 5, 7 -tetrametilnonana (not 6, 7 -dietil-2, 2, 5 -trimetiloktana. : ) 8 -sec-butil-7 -tert-butil-4 -isopropildodecana (hyphenated words aren’t alphabetized). OR 7 -(2, 2 -dimetiletiyl)-4 -(1 -metiyletil)8 -(2 -metilpropiyl)dodecana 22

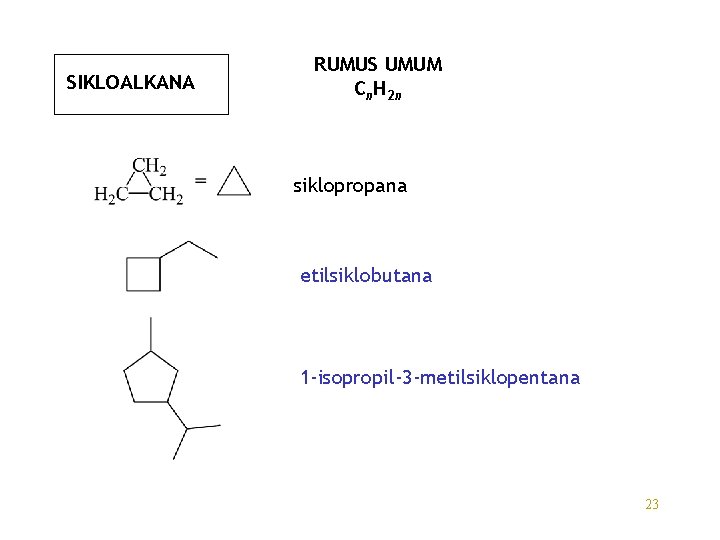
SIKLOALKANA RUMUS UMUM Cn. H 2 n siklopropana etilsiklobutana 1 -isopropil-3 -metilsiklopentana 23

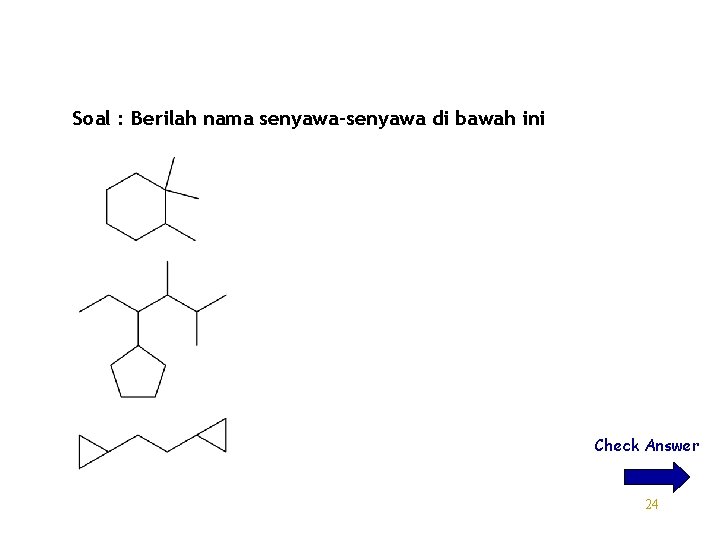
Soal : Berilah nama senyawa-senyawa di bawah ini Check Answer 24

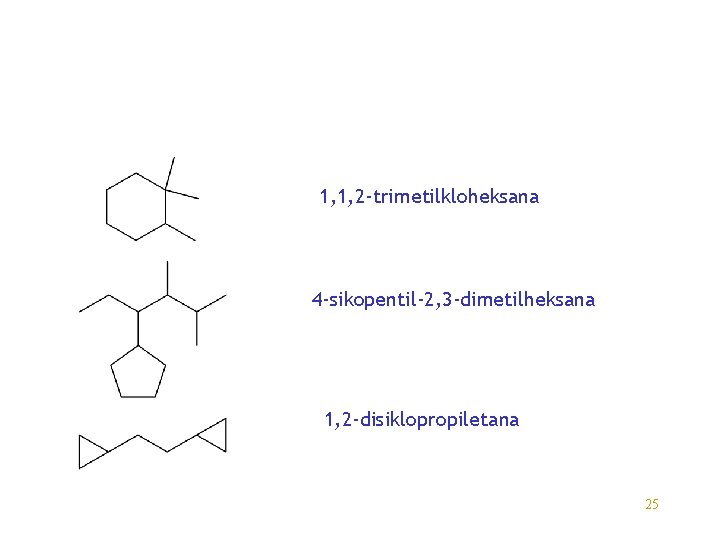
1, 1, 2 -trimetilkloheksana 4 -sikopentil-2, 3 -dimetilheksana 1, 2 -disiklopropiletana 25

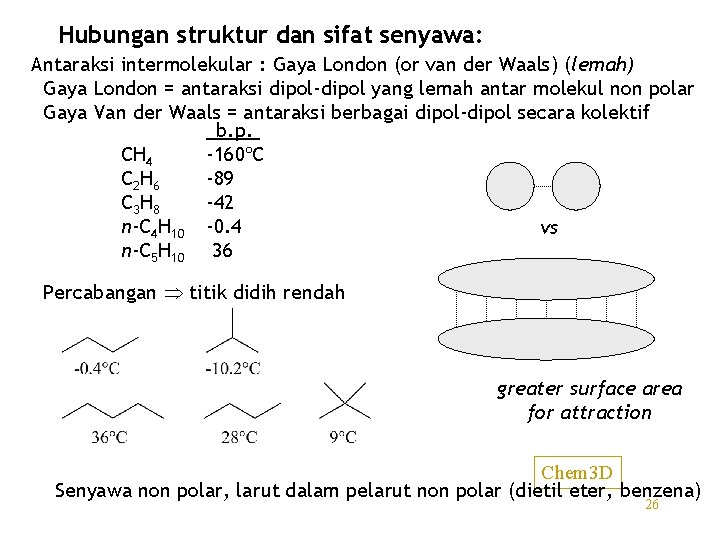
Hubungan struktur dan sifat senyawa: Antaraksi intermolekular : Gaya London (or van der Waals) (lemah) Gaya London = antaraksi dipol-dipol yang lemah antar molekul non polar Gaya Van der Waals = antaraksi berbagai dipol-dipol secara kolektif b. p. CH 4 -160ºC C 2 H 6 -89 C 3 H 8 -42 n-C 4 H 10 -0. 4 vs n-C 5 H 10 36 Percabangan titik didih rendah greater surface area for attraction Chem 3 D Senyawa non polar, larut dalam pelarut non polar (dietil eter, benzena) 26

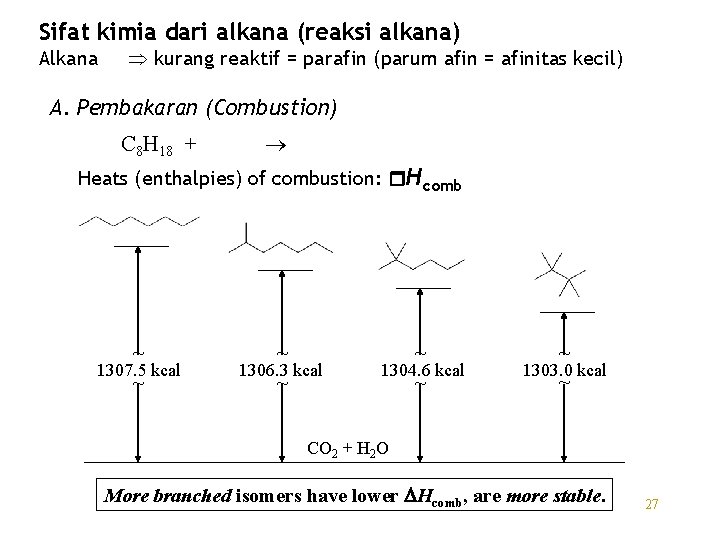
Sifat kimia dari alkana (reaksi alkana) Alkana kurang reaktif = parafin (parum afin = afinitas kecil) A. Pembakaran (Combustion) C 8 H 18 + Heats (enthalpies) of combustion: Hcomb ~ 1307. 5 kcal ~ ~ 1306. 3 kcal ~ ~ 1304. 6 kcal ~ ~ 1303. 0 kcal ~ CO 2 + H 2 O More branched isomers have lower DHcomb, are more stable. 27

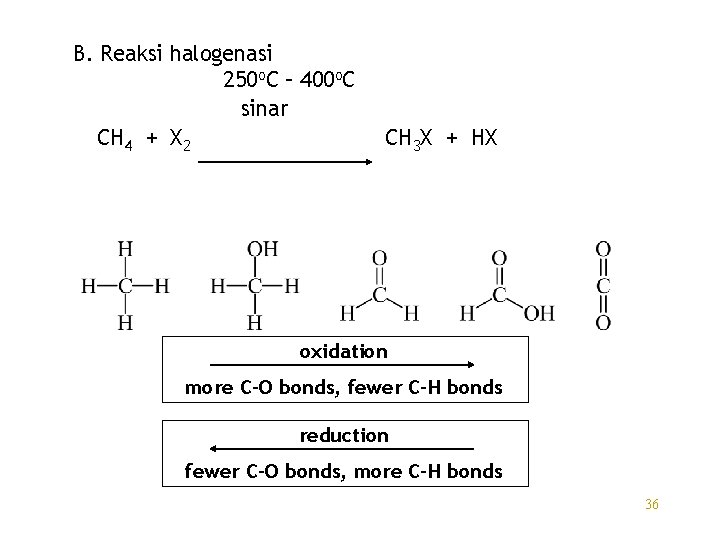
B. Reaksi halogenasi 250 o. C – 400 o. C sinar CH 4 + X 2 CH 3 X + HX Reaktivitas X 2 : Cl 2> Br 2 (iodinasi tak terjadi) H : 3 o > 2 o > 1 o 250 o. C – 400 o. C sinar CH 4 + Cl 2 CH 3 Cl + HCl 28

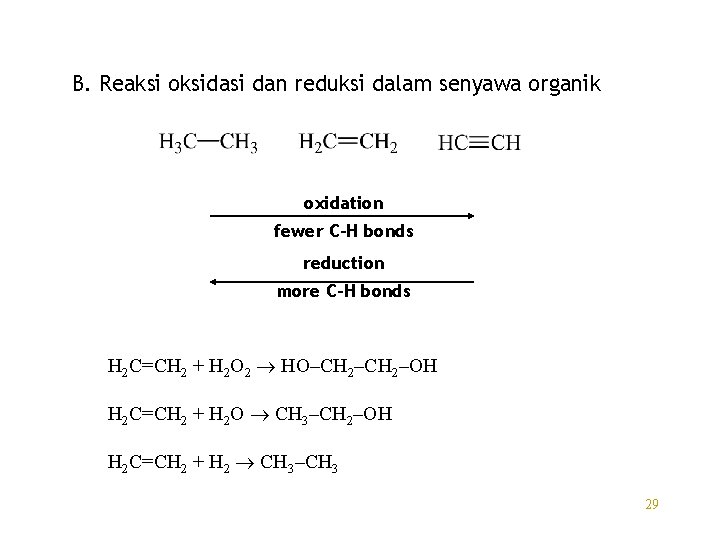
B. Reaksi oksidasi dan reduksi dalam senyawa organik oxidation fewer C-H bonds reduction more C-H bonds H 2 C=CH 2 + H 2 O 2 HO–CH 2–OH H 2 C=CH 2 + H 2 O CH 3–CH 2–OH H 2 C=CH 2 + H 2 CH 3–CH 3 29

30
![Penentuan bilangan oksidasi 1 Untuk setiap atom dalam ikatan atom elektropositif bilangan oksidasinya Penentuan bilangan oksidasi ] 1. Untuk setiap atom dalam ikatan, atom elektropositif bilangan oksidasinya](https://slidetodoc.com/presentation_image_h2/4847cda4fc8aed5bace9dc93b28fcc60/image-31.jpg)
Penentuan bilangan oksidasi ] 1. Untuk setiap atom dalam ikatan, atom elektropositif bilangan oksidasinya +1, dan atom yang elektronegatif bilangan oksidasi -1 (If the atoms are the same, each atom gets a 0. ) 2. Jumlah atom total. Oxidation number of carbon is +1 +1 +1 -1 = +2 31

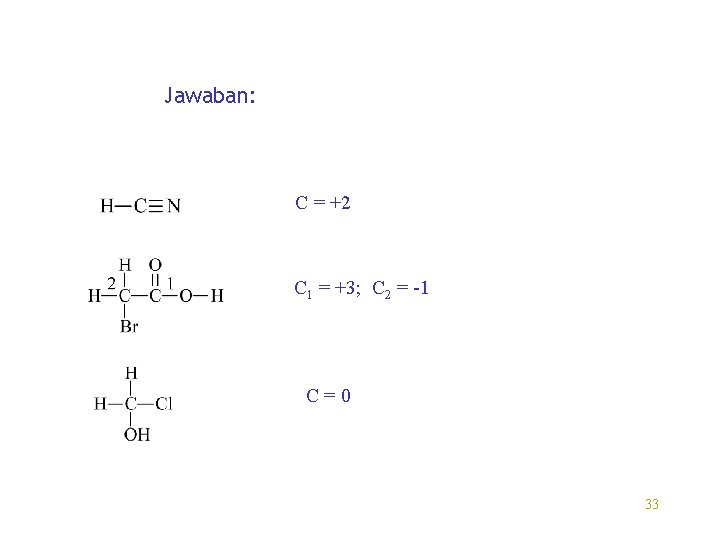
Soal : tentukan bilangan oksidasi untuk karbon dalam tiap molekul Check Answer 32

Jawaban: C = +2 C 1 = +3; C 2 = -1 C=0 33

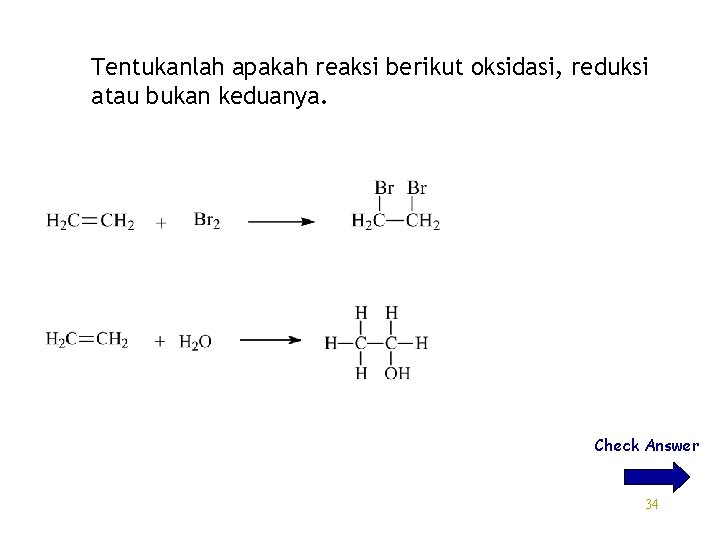
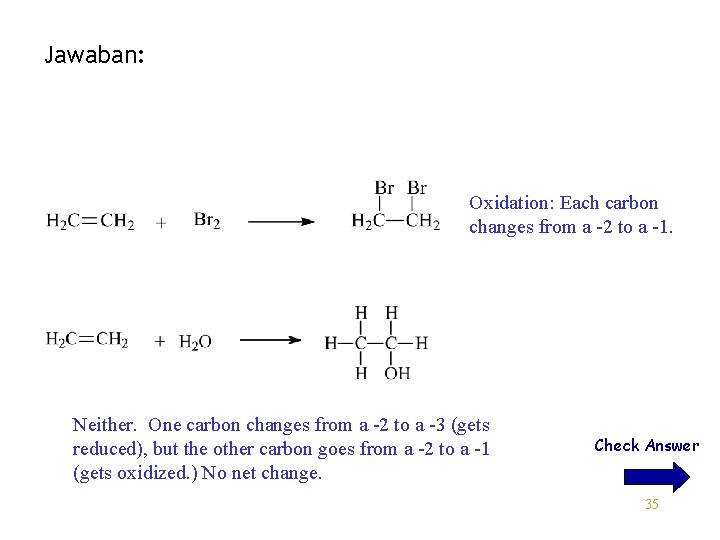
Tentukanlah apakah reaksi berikut oksidasi, reduksi atau bukan keduanya. Check Answer 34

Jawaban: Oxidation: Each carbon changes from a -2 to a -1. Neither. One carbon changes from a -2 to a -3 (gets reduced), but the other carbon goes from a -2 to a -1 (gets oxidized. ) No net change. Check Answer 35

B. Reaksi halogenasi 250 o. C – 400 o. C sinar CH 4 + X 2 CH 3 X + HX oxidation more C-O bonds, fewer C-H bonds reduction fewer C-O bonds, more C-H bonds 36
 Respirasi menghasilkan
Respirasi menghasilkan Enzim merupakan senyawa organik
Enzim merupakan senyawa organik Vertical
Vertical Isomer 2 metilsiklopentanol
Isomer 2 metilsiklopentanol Nama senyawa organik
Nama senyawa organik Lengkapilah dengan atom h
Lengkapilah dengan atom h Enzim senyawa organik atau anorganik
Enzim senyawa organik atau anorganik Turunan alkana kelas 12
Turunan alkana kelas 12 Peta konsep senyawa hidrokarbon dan penjelasannya
Peta konsep senyawa hidrokarbon dan penjelasannya Senyawa
Senyawa Tentukan jumlah atom cp cs ct ck
Tentukan jumlah atom cp cs ct ck Ruth miskin fred talk games
Ruth miskin fred talk games Alkana
Alkana Senyawa yang bersifat optis aktif
Senyawa yang bersifat optis aktif Senyawa non humik
Senyawa non humik Apa yang dimaksud dengan senyawa hidrokarbon? *
Apa yang dimaksud dengan senyawa hidrokarbon? * Rumus bangun alkuna
Rumus bangun alkuna Apa yang dimaksud dengan senyawa hidrokarbon? *
Apa yang dimaksud dengan senyawa hidrokarbon? * Teknologi bahan penyegar
Teknologi bahan penyegar Disakarida yang terdapat di dalam susu adalah
Disakarida yang terdapat di dalam susu adalah Apa yang dimaksud dengan senyawa hidrokarbon? *
Apa yang dimaksud dengan senyawa hidrokarbon? * Apa yang dimaksud dengan senyawa
Apa yang dimaksud dengan senyawa Heptasan obat apa
Heptasan obat apa Apa itu tekstur dalam menggambar
Apa itu tekstur dalam menggambar Pengulangan rupa
Pengulangan rupa Penilaian stabilitas suspensi
Penilaian stabilitas suspensi Sni pupuk organik padat
Sni pupuk organik padat Non air atau non air
Non air atau non air Alkenler tollens ve fehling
Alkenler tollens ve fehling Alkinlerde izomeri
Alkinlerde izomeri Tiyofen aromatik mi
Tiyofen aromatik mi Alkan alken alkin asitlik sıralaması
Alkan alken alkin asitlik sıralaması Metanın klorlanması
Metanın klorlanması General chemistry ders notları
General chemistry ders notları Elemen pembentuk kota organik
Elemen pembentuk kota organik Cis trans izomeri şartları
Cis trans izomeri şartları Sumber bahan organik
Sumber bahan organik