AGNCIA NACIONAL DE VIGIL NCIA SANITRIA Gerncia Geral
























- Slides: 25

AGÊNCIA NACIONAL DE VIGIL NCIA SANITÁRIA Gerência Geral de Medicamentos Gerência de Avaliação de Segurança e Eficácia Coordenação de Produtos Biológicos Regulamentação dos medicamentos biológicos no Brasil Simpósio anual de Pesquisa e Atualização Departamento de Oftalmologia Universidade Federal de São Paulo Março, 2012 Agência Nacional de Vigilância Sanitária Marcelo Moreira www. anvisa. gov. br

Registro de Medicamentos Bases legais Lei nº 6360/76 “ Art. 12. Nenhum dos produtos de que trata esta Lei, inclusive os importados, poderá ser industrializado, exposto à venda ou entregue ao consumo antes de registrado no Ministério da Saúde” Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Registro de Medicamentos Bases legais Lei nº 6360/76 “Art. 16. O registro de drogas, medicamentos, insumos farmacêuticos e correlatos, dadas as suas características sanitárias, medicamentosas ou profiláticas, curativas, paliativas, ou mesmo para fins de diagnóstico, fica sujeito, além do atendimento das exigências próprias, aos seguintes requisitos específicos: (Redação dada pela Lei nº 10. 742, de 6 de outubro de 2003) Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Registro de Medicamentos Bases legais Lei nº 6360/76 “Art. 16. (. . . ) II - que o produto, através de comprovação científica e de análise, seja reconhecido como seguro e eficaz para o uso a que se propõe, e possua a identidade, atividade, qualidade, pureza e inocuidade necessárias; ”. (Redação dada pela Lei nº 10. 742, de 6 de outubro de 2003) Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Registro de Medicamentos Bases legais Lei nº 6360/76 - VALIDADE: 5 anos e poderá ser revalidado por períodos iguais e sucessivos, mantido o número do registro inicial; - REVALIDAÇÃO: 6 meses antes de expirar a validade. Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Registro de Medicamentos Bases legais Decreto nº 79. 094/77 “Art. 17 - O registro dos produtos submetidos ao sistema de vigilância sanitária fica sujeito à observância dos seguintes requisitos: . . . X - Comprovação, por intermédio de inspeção sanitária, de que o estabelecimento de produção cumpre as boas práticas de fabricação e controle. ” Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Evolução da Legislação de Registro de Medicamentos - Mesmos critérios para diferentes categorias de medicamentos; - Criação da ANVISA em 1999 (Lei 9. 782/99); Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Evolução da Legislação de Registro de Medicamentos - Medicamentos Genéricos – Lei 9. 787/99; - Hemoderivados – RDC 46/00; Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Evolução da Legislação de Registro de Produtos Biológicos - Produtos Biológicos – RDC 80/02 (primeiro marco normativo); - Produtos Biológicos – RDC 315/2005 (segundo marco normativo); - Produtos Biológicos – RDC 55/2010 e RDC 49/2011 (resoluções vigentes). Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Regulamentação de Produtos Biológicos O que é registrado como produto biológico no Brasil? 1. Vacinas; 2. Soros Hiperimunes; 3. Hemoderivados; 4. Biomedicamentos: derivados de fluidos biológicos ou de tecidos de origem animal, procedimentos biotecnológicos; Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Regulamentação de Produtos Biológicos O que é registrado como medicamento biológico no Brasil? 5. Anticorpos monoclonais; 6. Medicamentos contendo microorganismos vivos, atenuados ou mortos; 7. Probióticos; 8. Alergênicos. Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

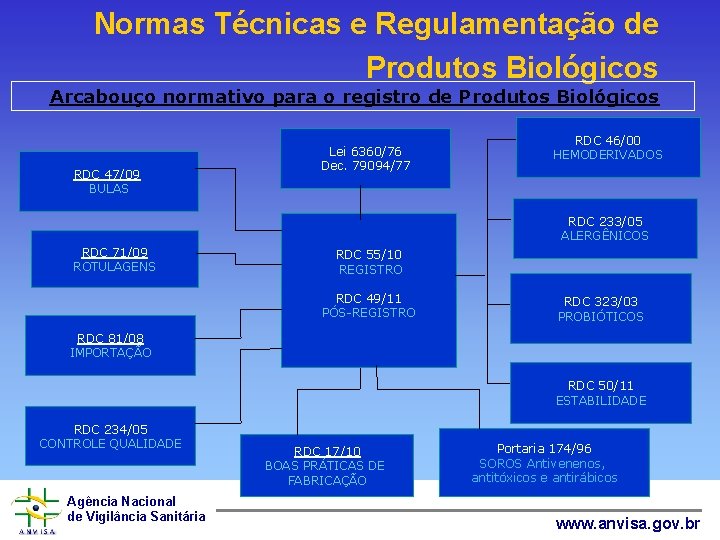
Normas Técnicas e Regulamentação de Produtos Biológicos Arcabouço normativo para o registro de Produtos Biológicos RDC 47/09 BULAS Lei 6360/76 Dec. 79094/77 RDC 46/00 HEMODERIVADOS RDC 233/05 ALERGÊNICOS RDC 71/09 ROTULAGENS RDC 55/10 REGISTRO RDC 49/11 PÓS-REGISTRO RDC 323/03 PROBIÓTICOS RDC 81/08 IMPORTAÇÃO RDC 50/11 ESTABILIDADE RDC 234/05 CONTROLE QUALIDADE Agência Nacional de Vigilância Sanitária RDC 17/10 BOAS PRÁTICAS DE FABRICAÇÃO Portaria 174/96 SOROS Antivenenos, antitóxicos e antirábicos www. anvisa. gov. br

Registro de Produtos Biológicos Resolução da Diretoria Colegiada – RDC nº. 55/2010 Dispõe sobre o registro de produtos biológicos novos e produtos biológicos e dá outras providências. Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Registro de Produtos Biológicos Resolução da Diretoria Colegiada – RDC nº. 55/2010 Definições (capítulo I, Seção II, Art. 2º) XX - Produto biológico novo: medicamento biológico que contém molécula com atividade biológica conhecida, ainda não registrado no Brasil e que tenha passado por todas as etapas de fabricação. Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Registro de Produtos Biológicos Resolução da Diretoria Colegiada – RDC nº. 55/2010 Definições (capítulo I, Seção II, Art. 2º) XV - Produto biológico: medicamento biológico não novo ou conhecido que contém molécula com atividade biológica conhecida, já registrado no Brasil e (. . . ) etapas de fabricação. Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Registro de Produtos Biológicos Resolução da Diretoria Colegiada – RDC nº. 55/2010 Art. 16. O registro de produto fabricado em outros países somente poderá ser concedido pela Anvisa se o medicamento estiver registrado e liberado para uso em seu país de fabricação. Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Registro de Produtos Biológicos Resolução da Diretoria Colegiada – RDC nº. 55/2010 Art. 17. Todas as empresas envolvidas na fabricação de um produto biológico novo ou produto biológico devem cumprir as boas práticas de fabricação, e apresentar o Certificado de Boas Práticas de Fabricação (CBPF) emitido pela Anvisa. Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Registro de Produtos Biológicos Resolução da Diretoria Colegiada – RDC nº. 55/2010 Art. 18. Todas as indicações terapêuticas solicitadas no registro, para o produto biológico novo ou produto biológico, devem estar documentalmente demonstradas nos relatórios dos estudos clínicos. Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Alterações Pós-Registro de Produtos Biológicos Área: Medicamento Assunto: 1519 - PRODUTO BIOLÓGICO - Inclusão de Nova Apresentação Comercial Relação de Documentos de Instrução 1 - Formulários de petição FP 1 e FP 2 devidamente preenchidos 2 - Via original do comprovante de pagamento da taxa de fiscalização de vigilância sanitária - GRU 3 - Justificativa do requerimento, contemplando a descrição detalhada e as razões de ordem técnica, de acordo com o modelo constante na RDC nº 49/2011. 4 - 1(um) CD-ROM com a mesma informação documentada gravada em linguagem eletrônica tipo pdf 5 - Cópia da Licença de Funcionamento da Empresa e/ou Alvará Sanitário Atualizado 6 - Cópia do Certificado de Autorização de Funcionamento da Empresa ou de sua publicação em D. O. U Fundamentação Legal Lei nº 6360, de 23/09/1976; Decreto nº 79. 094, de 05/01/1977; RDC nº 305, de 14/11/2022; RDC nº 68, de 28/03/2003; RDC nº 222, de 28/12/2006; RDC nº 49, de 22/09/2011, RDC nº 50, de 22/09/2011 Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Alterações Pós-Registro de Produtos Biológicos Área: Medicamento Assunto: 1519 - PRODUTO BIOLÓGICO - Inclusão de Nova Apresentação Comercial Relação de Documentos de Instrução 7 - Código de barras GTIN para as apresentações 8 - Relatório dos estudos de estabilidade para produtos líquidos ou liofilizados, no caso de alteração da proporção de volume ou peso por embalagem, respectivamente 9 - Modelos de rotulagem e embalagem, conforme RDC nº. 71/2009, e suas posteriores atualizações. 10 - Modelo de texto de bula atualizado, conforme RDC nº. 47/2009 e suas posteriores atualizações. 11 - Cópia do CBPF, expedido pela ANVISA para todos os fabricantes do princípio ativo, do produto biológico a granel, do produto biológico em sua embalagem primária, do produto biológico terminado, do diluente e do adjuvante. Fundamentação Legal Lei nº 6360, de 23/09/1976; Decreto nº 79. 094, de 05/01/1977; RDC nº 305, de 14/11/2022; RDC nº 68, de 28/03/2003; RDC nº 222, de 28/12/2006; RDC nº 49, de 22/09/2011, RDC nº 50, de 22/09/2011 Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Alterações Pós-Registro de Produtos Biológicos Área: Medicamento Assunto: 1615 - PRODUTO BIOLÓGICO - Inclusão de Nova Indicação Terapêutica no País Relação de Documentos de Instrução 1 - Formulários de petição FP 1 e FP 2 devidamente preenchidos 2 - Via original do comprovante de pagamento da taxa de fiscalização de vigilância sanitária (GRU) 3 - Justificativa do requerimento, contemplando a descrição detalhada e as razões de ordem técnica, de acordo com o modelo constante na RDC nº 49/2011. 4 - 1(um) CD-ROM com a mesma informação documentada gravada em linguagem eletrônica tipo pdf 5 - Cópia da Licença de Funcionamento da Empresa e/ou Alvará Sanitário Atualizado 6 - Cópia do certificado de autorização de funcionamento da empresa ou de sua publicação em Diário Oficial da União (DOU) Fundamentação Legal Lei nº 6360, de 23/09/1976; Decreto nº 79. 094, de 05/01/1977; RDC nº 305, de 14/11/2022; RDC nº 68, de 28/03/2003; RDC nº 222, de 28/12/2006; RDC nº 49, de 22/09/2011, RDC nº 50, de 22/09/2011 Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Alterações Pós-Registro de Produtos Biológicos Área: Medicamento Assunto: 1615 - PRODUTO BIOLÓGICO - Inclusão de Nova Indicação Terapêutica no País Relação de Documentos de Instrução 7 - Relatório de Experimentação Terapêutica 8 - Modelo de texto de bula atualizado, conforme RDC nº. 47/2009 e suas posteriores atualizações. 9 - Cópia do CBPF, expedido pela ANVISA para todos os fabricantes do princípio ativo, do produto biológico a granel, do produto biológico em sua embalagem primária, do produto biológico terminado, do diluente e do adjuvante. Fundamentação Legal Lei nº 6360, de 23/09/1976; Decreto nº 79. 094, de 05/01/1977; RDC nº 305, de 14/11/2022; RDC nº 68, de 28/03/2003; RDC nº 222, de 28/12/2006; RDC nº 49, de 22/09/2011, RDC nº 50, de 22/09/2011 Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Alterações Pós-Registro de Produtos Biológicos Área: Medicamento Assunto: 1948 - PRODUTO BIOLÓGICO - Inclusão da Via de Administração Relação de Documentos de Instrução 1 - Formulários de petição FP 1 e FP 2 devidamente preenchidos 2 - Via original do comprovante de pagamento da Taxa de Fiscalização de Vigilância Sanitária (GRU) 3 - Justificativa do requerimento, contemplando a descrição detalhada e as razões de ordem técnica, de acordo com o modelo constante na RDC nº 49/2011. 4 - 1(um) CD-ROM com a mesma informação documentada gravada em linguagem eletrônica tipo pdf 5 - Cópia da Licença de Funcionamento da Empresa e/ou Alvará Sanitário Atualizado 6 - Cópia do certificado de autorização de funcionamento da empresa ou de sua publicação em Diário Oficial da União (DOU) Fundamentação Legal Lei nº 6360, de 23/09/1976; Decreto nº 79. 094, de 05/01/1977; RDC nº 305, de 14/11/2022; RDC nº 68, de 28/03/2003; RDC nº 222, de 28/12/2006; RDC nº 49, de 22/09/2011, RDC nº 50, de 22/09/2011 Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

Alterações Pós-Registro de Produtos Biológicos Área: Medicamento Assunto: 1948 - PRODUTO BIOLÓGICO - Inclusão da Via de Administração Relação de Documentos de Instrução 7 - Relatório de experimentação terapêutica para a nova via de administração. 8 - Modelos de rotulagem e embalagem, conforme RDC nº. 71/2009, e suas posteriores atualizações. 9 - Modelo de texto de bula atualizado, conforme RDC nº. 47/2009 e suas posteriores atualizações. 10 - Cópia do CBPF, expedido pela ANVISA para todos os fabricantes do princípio ativo, do produto biológico a granel, do produto biológico em sua embalagem primária, do produto biológico terminado, do diluente e do adjuvante. Fundamentação Legal Lei nº 6360, de 23/09/1976; Decreto nº 79. 094, de 05/01/1977; RDC nº 305, de 14/11/2022; RDC nº 68, de 28/03/2003; RDC nº 222, de 28/12/2006; RDC nº 49, de 22/09/2011, RDC nº 50, de 22/09/2011 Agência Nacional de Vigilância Sanitária www. anvisa. gov. br

“É sempre muito cedo parar. ” Norman Vincent Peale Obrigado, produtos. biologicos@anvisa. gov. br Agência Nacional de Vigilância Sanitária www. anvisa. gov. br
 Ncia
Ncia %22+%22+fal�ncia
%22+%22+fal�ncia Mariah vigil
Mariah vigil Vigil enfermagem
Vigil enfermagem Serpentis forlorn den
Serpentis forlorn den Schoolager
Schoolager Sadesvs
Sadesvs Dr carlos vigil
Dr carlos vigil Chapters 20-21 to kill a mockingbird
Chapters 20-21 to kill a mockingbird Vigil honor petition
Vigil honor petition Haleto organico
Haleto organico Taxa de mortalidade geral formula
Taxa de mortalidade geral formula Exemplos de objetivos específicos
Exemplos de objetivos específicos Objetivo geral e especifico
Objetivo geral e especifico Ginástica geral
Ginástica geral Bh3 geometria
Bh3 geometria Marcelo speziali
Marcelo speziali Modelo geral de comunicação
Modelo geral de comunicação Gastrulação
Gastrulação Objetivos específicos
Objetivos específicos Formula de taxa de mortalidade
Formula de taxa de mortalidade Termo geral do binomio
Termo geral do binomio Problema do tcc
Problema do tcc Ginástica geral características
Ginástica geral características O que é a regra do octeto
O que é a regra do octeto Objetivo geral do folclore
Objetivo geral do folclore