Acuerdo Comercial Trans Pacfico TPP Impacto potencial en
















- Slides: 29

Acuerdo Comercial Trans Pacífico (TPP) Impacto potencial en el acceso a productos farmacéuticos Capítulo 18: Propiedad Intelectual Opinión de DIGEMID / Ministerio de Salud Q. F. Maruja Crisante N. Directora General(e) - DIGEMID

Índice • Sección 1: Salud y acceso a medicamentos como derecho fundamental • Sección 2: Epidemiología de las enfermedades no transmisibles y oncológicas en el Perú • Sección 3: Mercado de productos biotecnológicos y biosimilares, incluyendo vacunas • Sección 4: Estudios de Impacto Potencial de la Protección de Datos de Prueba en el Perú • Sección 5: Análisis de los artículos del capítulo de Propiedad Intelectual (Capítulo 18) desde una perspectiva sanitaria • Sección 6: Conclusiones

Sección 1: Salud y acceso a medicamentos como derecho fundamental

Acceso como Derecho Humano: El derecho a la salud es un derecho concreto e inclusivo, que se expresa en la prevención y el tratamiento de enfermedades, incluido el acceso a los medicamentos. A nivel internacional, el derecho a la salud se encuentra reconocido principalmente en: 1) La Declaración Universal de Derechos Humanos: Párrafo 1 del artículo 25 2) El Pacto Internacional de Derechos Económicos, Sociales y Culturales: Artículo 12 En el caso del Perú: 1) Constitución Política: Artículos 7° y 9° el derecho de las personas a la protección de su salud y la competencia del Estado para determinar la política nacional de salud, 2) Política Nacional de Medicamentos: Primer lineamiento “Acceso universal a los medicamentos esenciales”. 3) Ley 29459 “Ley de los productos farmacéuticos, dispositivos médicos y productos sanitarios”: Artículo 27

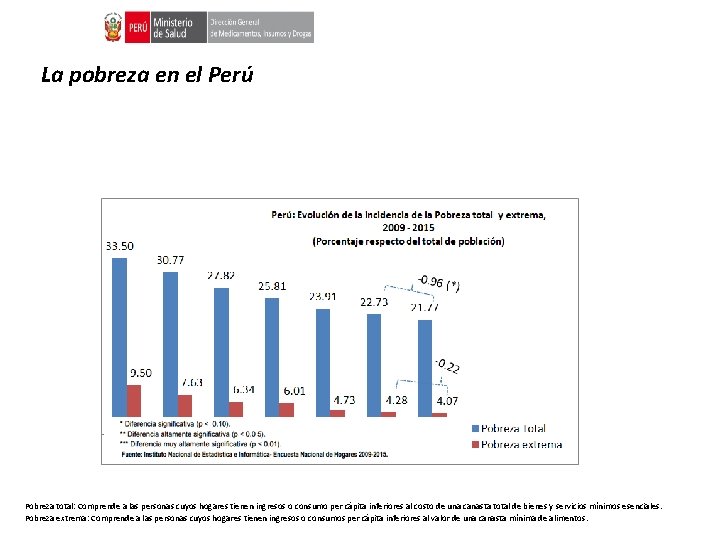
La pobreza en el Perú Pobreza total: Comprende a las personas cuyos hogares tienen ingresos o consumo per cápita inferiores al costo de una canasta total de bienes y servicios mínimos esenciales. Pobreza extrema: Comprende a las personas cuyos hogares tienen ingresos o consumos per cápita inferiores al valor de una canasta mínima de alimentos.

El aseguramiento de salud en el Perú: Setiembre del 2015: 7, 5 millones de peruanos sin un seguro de salud Fuente: INEI: Encuesta nacional de Hogares (ENAHO) 2004 – 2015.

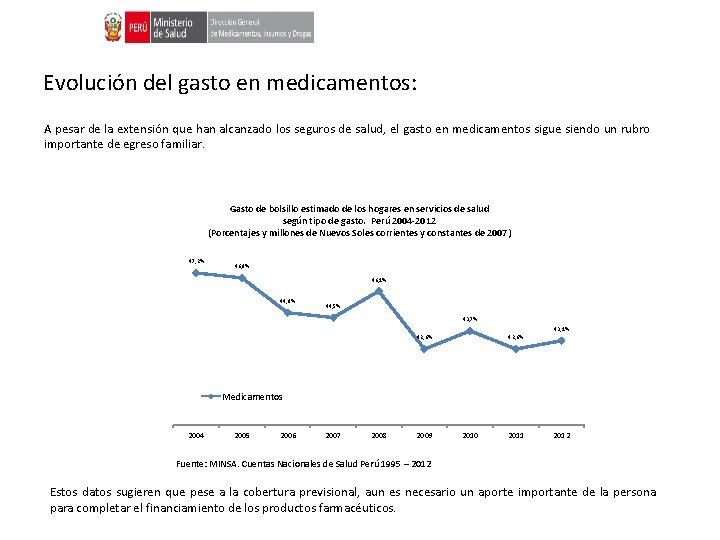
Evolución del gasto en medicamentos: A pesar de la extensión que han alcanzado los seguros de salud, el gasto en medicamentos sigue siendo un rubro importante de egreso familiar. Gasto de bolsillo estimado de los hogares en servicios de salud según tipo de gasto. Perú 2004 -2012 (Porcentajes y millones de Nuevos Soles corrientes y constantes de 2007) 47, 2% 46, 9% 46, 1% 44, 8% 44, 5% 43, 7% 43, 1% 42, 6% Medicamentos 2004 2005 2006 2007 2008 2009 2010 2011 2012 Fuente: MINSA. Cuentas Nacionales de Salud Perú 1995 – 2012 Estos datos sugieren que pese a la cobertura previsional, aun es necesario un aporte importante de la persona para completar el financiamiento de los productos farmacéuticos.

Sección 2: Epidemiología de las enfermedades no transmisibles y oncológicas en el Perú

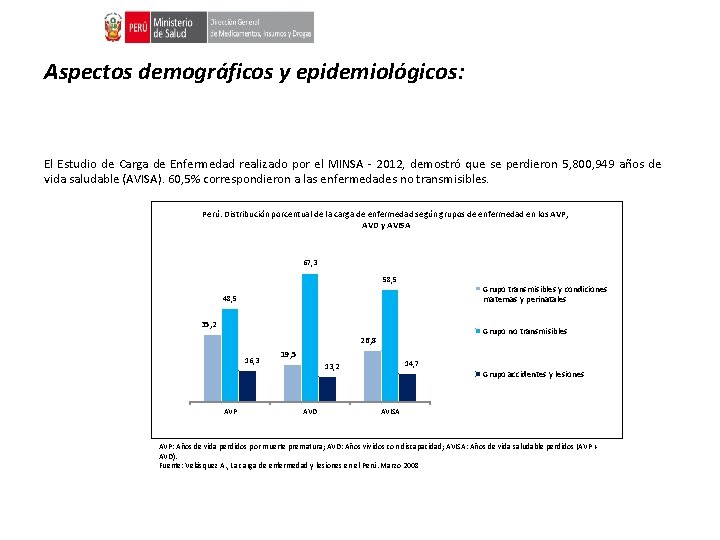
Aspectos demográficos y epidemiológicos: El Estudio de Carga de Enfermedad realizado por el MINSA - 2012, demostró que se perdieron 5, 800, 949 años de vida saludable (AVISA). 60, 5% correspondieron a las enfermedades no transmisibles. Perú: Distribución porcentual de la carga de enfermedad según grupos de enfermedad en los AVP, AVD y AVISA 67, 3 58, 5 Grupo transmisibles y condiciones maternas y perinatales 48, 5 35, 2 Grupo no transmisibles 26, 8 16, 3 AVP 19, 5 14, 7 13, 2 AVD Grupo accidentes y lesiones AVISA AVP: Años de vida perdidos por muerte prematura; AVD: Años vividos con discapacidad; AVISA: Años de vida saludable perdidos (AVP + AVD). Fuente: Velásquez A. , La carga de enfermedad y lesiones en el Perú. Marzo 2008

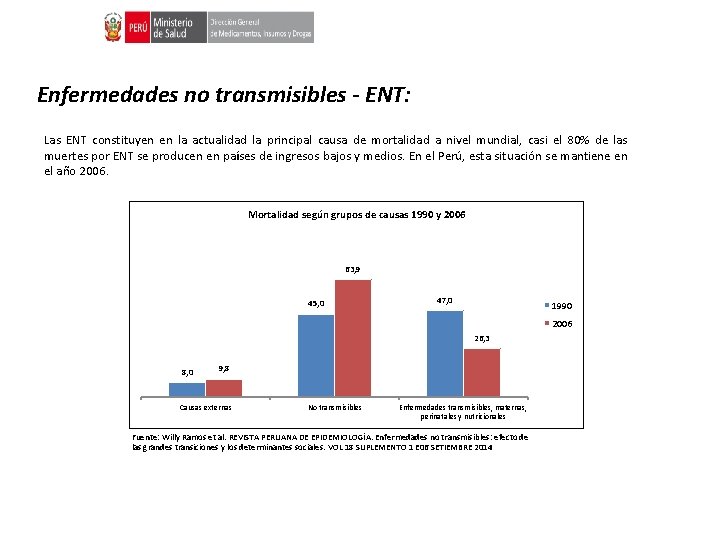
Enfermedades no transmisibles - ENT: Las ENT constituyen en la actualidad la principal causa de mortalidad a nivel mundial, casi el 80% de las muertes por ENT se producen en países de ingresos bajos y medios. En el Perú, esta situación se mantiene en el año 2006. Mortalidad según grupos de causas 1990 y 2006 63, 9 45, 0 47, 0 1990 2006 26, 3 8, 0 9, 8 Causas externas No transmisibles Enfermedades transmisibles, maternas, perinatales y nutricionales Fuente: Willy Ramos et al. REVISTA PERUANA DE EPIDEMIOLOGÍA. Enfermedades no transmisibles: efecto de las grandes transiciones y los determinantes sociales. VOL 18 SUPLEMENTO 1 E 06 SETIEMBRE 2014

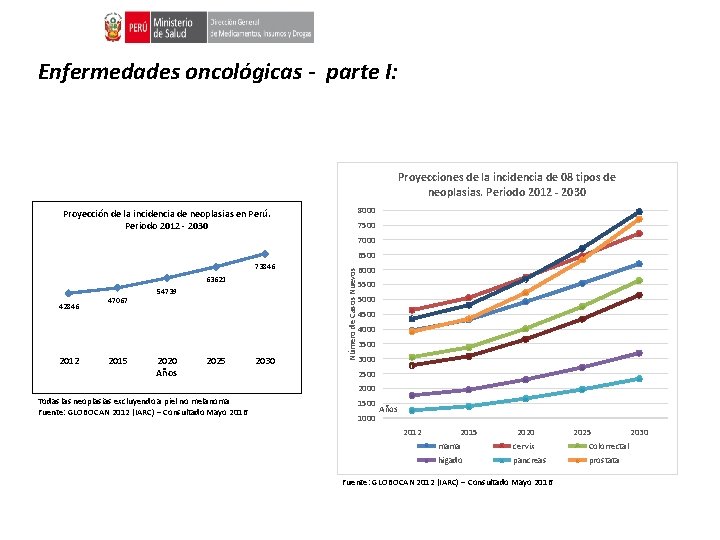
Enfermedades oncológicas - parte I: Proyecciones de la incidencia de 08 tipos de neoplasias. Periodo 2012 - 2030 8000 Proyección de la incidencia de neoplasias en Perú. Periodo 2012 - 2030 7500 7000 63621 42846 2012 47067 2015 54739 2020 Años 2025 2030 Número de Casos Nuevos 6500 73846 6000 5500 5000 4500 4000 3500 3000 2500 2000 Todas las neoplasias excluyendo a piel no melanoma Fuente: GLOBOCAN 2012 (IARC) – Consultado Mayo 2016 1500 1000 Años 2012 2015 2020 2025 mama cervix Colorrectal higado pancreas prostata Fuente: GLOBOCAN 2012 (IARC) – Consultado Mayo 2016 2030

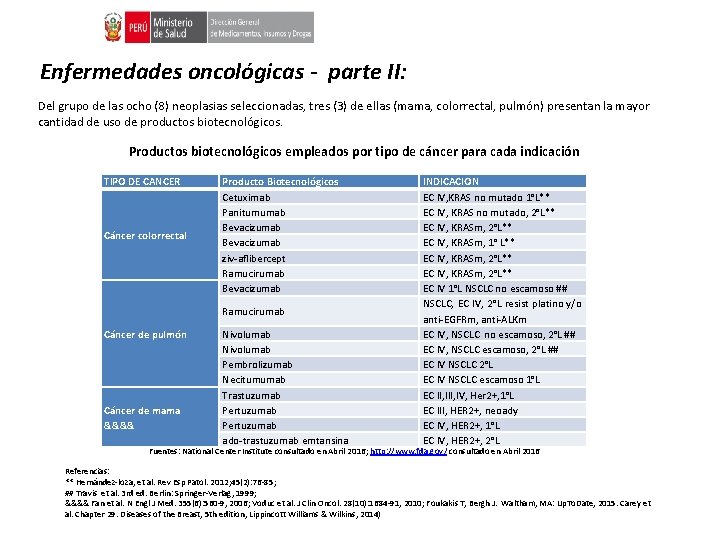
Enfermedades oncológicas - parte II: Del grupo de las ocho (8) neoplasias seleccionadas, tres (3) de ellas (mama, colorrectal, pulmón) presentan la mayor cantidad de uso de productos biotecnológicos. Productos biotecnológicos empleados por tipo de cáncer para cada indicación TIPO DE CANCER Cáncer colorrectal Producto Biotecnológicos Cetuximab Panitumumab Bevacizumab ziv-aflibercept Ramucirumab Bevacizumab Ramucirumab Cáncer de pulmón Cáncer de mama &&&& Nivolumab Pembrolizumab Necitumumab Trastuzumab Pertuzumab ado-trastuzumab emtansina INDICACION EC IV, KRAS no mutado 1°L** EC IV, KRAS no mutado, 2°L** EC IV, KRASm, 1° L** EC IV, KRASm, 2°L** EC IV 1°L NSCLC no escamoso ## NSCLC, EC IV, 2°L resist platino y/o anti-EGFRm, anti-ALKm EC IV, NSCLC no escamoso, 2°L ## EC IV, NSCLC escamoso, 2°L ## EC IV NSCLC 2°L EC IV NSCLC escamoso 1°L EC II, IV, Her 2+, 1°L EC III, HER 2+, neoady EC IV, HER 2+, 1°L EC IV, HER 2+, 2°L Fuentes: National Center Institute consultado en Abril 2016; http: //www. fda. gov/ consultado en Abril 2016 Referencias: ** Hernández-loza, et al. Rev Esp Patol. 2012; 45(2): 76 -85; ## Travis et al. 3 rd ed. Berlin: Springer-Verlag, 1999; &&&& Fan et al. N Engl J Med. 355(6): 560 -9, 2006; Voduc et al. J Clin Oncol. 28(10): 1684 -91, 2010; Foukakis T, Bergh J. Waltham, MA: Up. To. Date, 2015. Carey et al. Chapter 29. Diseases of the Breast, 5 th edition, Lippincott Williams & Wilkins, 2014)

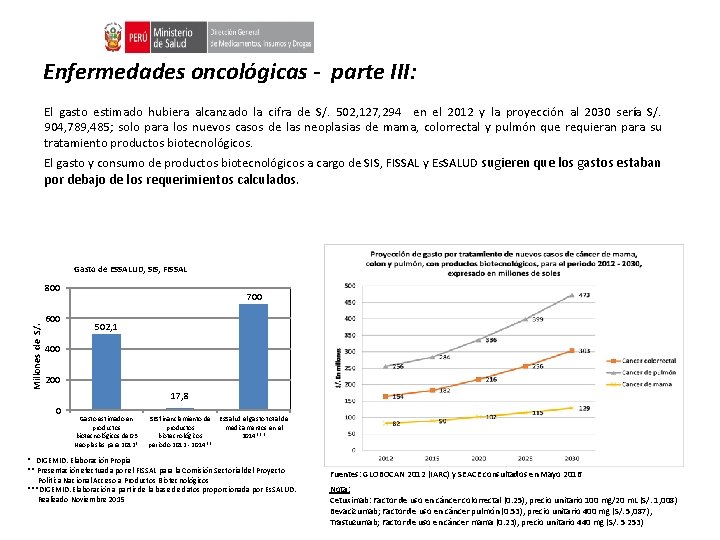
Enfermedades oncológicas - parte III: El gasto estimado hubiera alcanzado la cifra de S/. 502, 127, 294 en el 2012 y la proyección al 2030 sería S/. 904, 789, 485; solo para los nuevos casos de las neoplasias de mama, colorrectal y pulmón que requieran para su tratamiento productos biotecnológicos. El gasto y consumo de productos biotecnológicos a cargo de SIS, FISSAL y Es. SALUD sugieren que los gastos estaban por debajo de los requerimientos calculados. Gasto de ESSALUD, SIS, FISSAL Millones de S/. 800 600 700 502, 1 400 200 17, 8 0 Gasto estimado en productos biotecnológicos de 03 Neoplasias para 2012* SIS financiamiento de Es. Salud el gasto total de productos medicamentos en el biotecnológicos 2014*** periodo 2012 - 2014** * DIGEMID. Elaboración Propia ** Presentación efectuada por el FISSAL para la Comisión Sectorial del Proyecto Política Nacional Acceso a Productos Biotecnológicos ***DIGEMID. Elaboración a partir de la base de datos proporcionada por Es. SALUD. Realizado Noviembre 2015 Fuentes: GLOBOCAN 2012 (IARC) y SEACE consultados en Mayo 2016 Nota: Cetuximab: Factor de uso en cáncer colorrectal (0. 25), precio unitario 100 mg/20 m. L (S/. 1, 008) Bevacizumab; Factor de uso en cáncer pulmón (0. 53), precio unitario 400 mg (S/. 5, 087), Trastuzumab; Factor de uso en cáncer mama (0. 23), precio unitario 440 mg (S/. 5 253)

Sección 3: Mercado de productos biotecnológicos y biosimilares, incluyendo vacunas

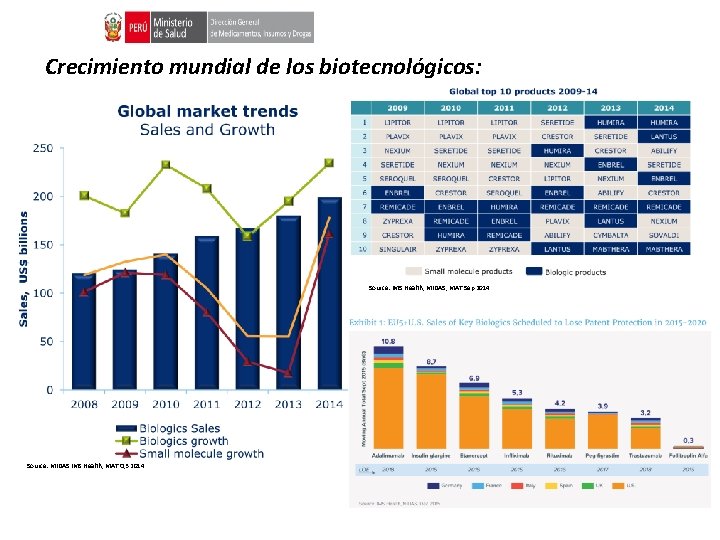
Crecimiento mundial de los biotecnológicos: Source: IMS Health, MIDAS, MAT Sep 2014 Source: MIDAS IMS Health, MAT Q 3 2014

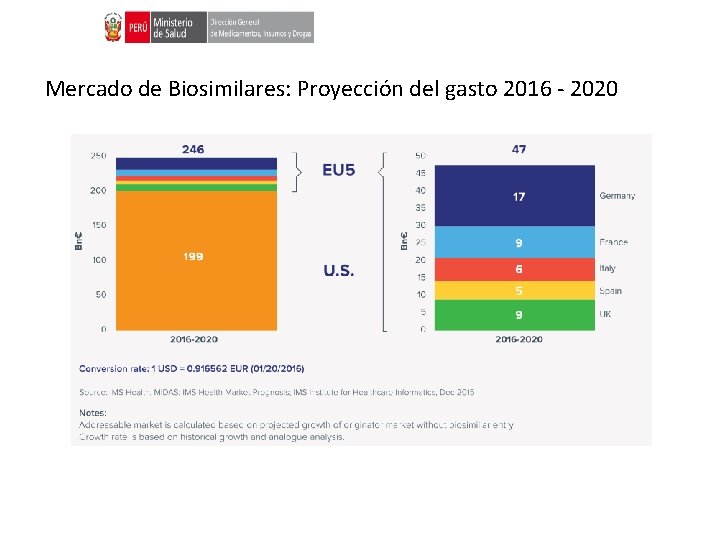
Mercado de Biosimilares: Proyección del gasto 2016 - 2020

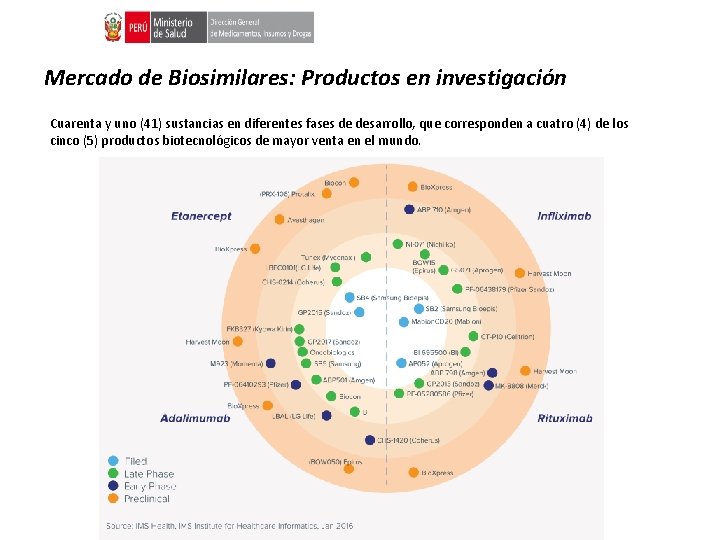
Mercado de Biosimilares: Productos en investigación Cuarenta y uno (41) sustancias en diferentes fases de desarrollo, que corresponden a cuatro (4) de los cinco (5) productos biotecnológicos de mayor venta en el mundo.

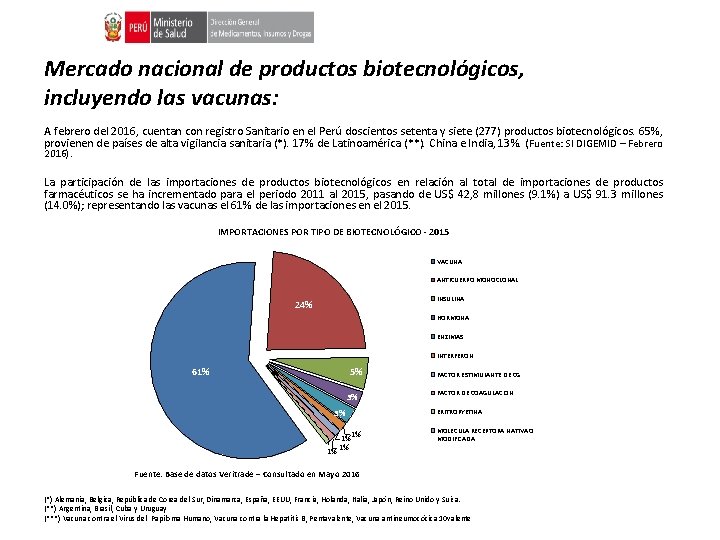
Mercado nacional de productos biotecnológicos, incluyendo las vacunas: A febrero del 2016, cuentan con registro Sanitario en el Perú doscientos setenta y siete (277) productos biotecnológicos. 65%, provienen de países de alta vigilancia sanitaria (*). 17% de Latinoamérica (**). China e India, 13%. (Fuente: SI DIGEMID – Febrero 2016). La participación de las importaciones de productos biotecnológicos en relación al total de importaciones de productos farmacéuticos se ha incrementado para el periodo 2011 al 2015, pasando de US$ 42, 8 millones (9. 1%) a US$ 91. 3 millones (14. 0%); representando las vacunas el 61% de las importaciones en el 2015. IMPORTACIONES POR TIPO DE BIOTECNOLÓGICO - 2015 VACUNA ANTICUERPO MONOCLONAL INSULINA 24% HORMONA ENZIMAS INTERFERON 61% 5% 3% 3% 1% 1% FACTOR ESTIMULANTE DE CG FACTOR DE COAGULACION ERITROPYETINA MOLECULA RECEPTORA NATIVA O MODIFICADA Fuente: Base de datos Veritrade – Consultado en Mayo 2016 (*) Alemania, Belgica, República de Corea del Sur, Dinamarca, España, EEUU, Francia, Holanda, Italia, Japón, Reino Unido y Suiza. (**) Argentina, Brasil, Cuba y Uruguay (***) Vacuna contra el Virus del Papiloma Humano, Vacuna contra la Hepatitis B, Pentavalente, Vacuna antineumocócica 10 valente

Sección 4: Estudios de Impacto Potencial de la Protección de Datos de Prueba en el Perú

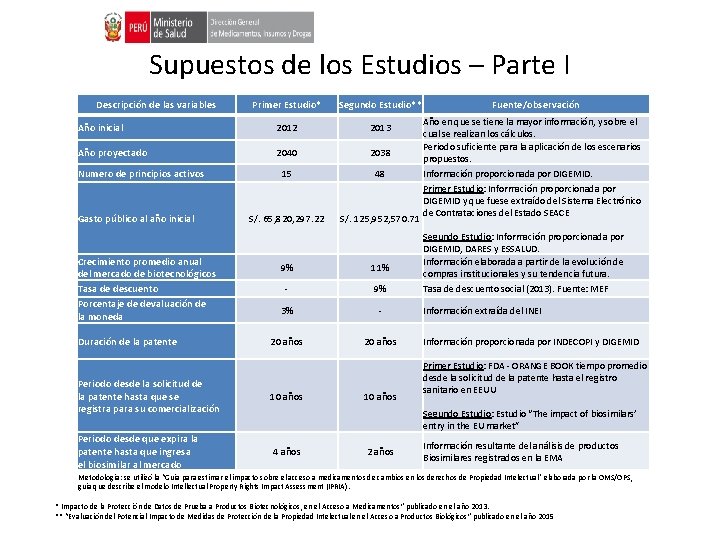
Supuestos de los Estudios – Parte I Descripción de las variables Primer Estudio* Segundo Estudio** Año inicial 2012 2013 Año proyectado 2040 2038 15 48 Numero de principios activos Gasto público al año inicial Crecimiento promedio anual del mercado de biotecnológicos Tasa de descuento Porcentaje de devaluación de la moneda Duración de la patente S/. 65, 820, 297. 22 S/. 125, 952, 570. 71 9% 11% - 9% 3% - 20 años Periodo desde la solicitud de la patente hasta que se registra para su comercialización 10 años Periodo desde que expira la patente hasta que ingresa el biosimilar al mercado 4 años 10 años Fuente/observación Año en que se tiene la mayor información, y sobre el cual se realizan los cálculos. Periodo suficiente para la aplicación de los escenarios propuestos. Información proporcionada por DIGEMID. Primer Estudio: Información proporcionada por DIGEMID y que fuese extraído del Sistema Electrónico de Contrataciones del Estado SEACE Segundo Estudio: Información proporcionada por DIGEMID, DARES y ESSALUD. Información elaborada a partir de la evolución de compras institucionales y su tendencia futura. Tasa de descuento social (2013). Fuente: MEF Información extraída del INEI Información proporcionada por INDECOPI y DIGEMID Primer Estudio: FDA - ORANGE BOOK tiempo promedio desde la solicitud de la patente hasta el registro sanitario en EEUU Segundo Estudio: Estudio “The impact of biosimilars’ entry in the EU market” 2 años Información resultante del análisis de productos Biosimilares registrados en la EMA Metodología: se utilizó la “Guía para estimar el impacto sobre el acceso a medicamentos de cambios en los derechos de Propiedad Intelectual” elaborada por la OMS/OPS, guía que describe el modelo Intellectual Property Rights Impact Assessment (IPRIA). * Impacto de la Protección de Datos de Prueba a Productos Biotecnológicos, en el Acceso a Medicamentos” publicado en el año 2013. ** “Evaluación del Potencial Impacto de Medidas de Protección de la Propiedad Intelectual en el Acceso a Productos Biológicos” publicado en el año 2015

Supuestos de los Estudios – Parte II Descripción de las variables Primer Estudio* Segundo Estudio** Precio relativo medio ponderado de los productos en situación de exclusividad frente al precio del producto en situación de competencia - 1. 15 Promedio de reducción del precio del biosimilar respecto del de referencia 29% - Fuente/observación Estudio “The impact of biosimilars’ entry in the EU market” 2010 Primer Estudio: Periodo 2005 - 2012 Número de Principios Activos que ingresan con patente cada año 8 3 Número promedio de Principios Activos que ingresan al mercado anualmente - 5 En base a información de registro sanitario (período 2004 -2013). Número de principios activos con protección por datos de prueba que entran en el mercado cada año - 5 Escenario de protección moderada Número promedio de PF que salen del mercado anualmente 4 0 Segundo Estudio: Periodo 2004 - 2013 Primer Estudio: Periodo 2005 - 2012 Segundo Estudio: Periodo 2004 - 2013 Metodología: se utilizó la “Guía para estimar el impacto sobre el acceso a medicamentos de cambios en los derechos de Propiedad Intelectual” elaborada por la OMS/OPS, guía que describe el modelo Intellectual Property Rights Impact Assessment (IPRIA). * Impacto de la Protección de Datos de Prueba a Productos Biotecnológicos, en el Acceso a Medicamentos” publicado en el año 2013. ** “Evaluación del Potencial Impacto de Medidas de Protección de la Propiedad Intelectual en el Acceso a Productos Biológicos” publicado en el año 2015

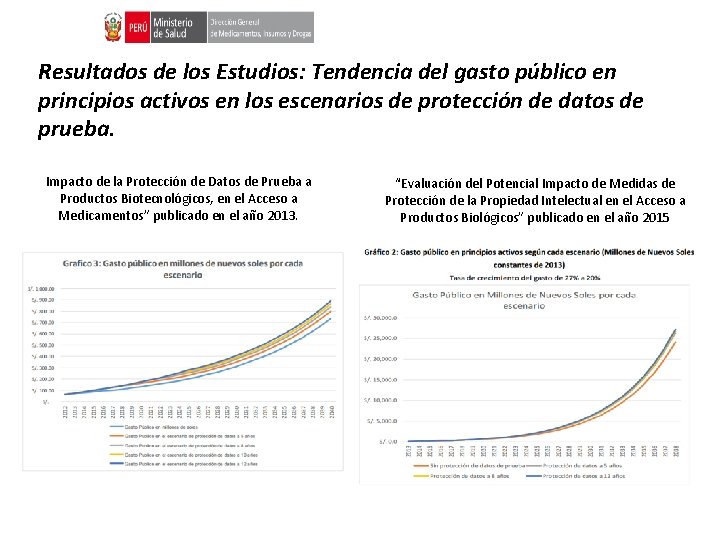
Resultados de los Estudios: Tendencia del gasto público en principios activos en los escenarios de protección de datos de prueba. Impacto de la Protección de Datos de Prueba a Productos Biotecnológicos, en el Acceso a Medicamentos” publicado en el año 2013. “Evaluación del Potencial Impacto de Medidas de Protección de la Propiedad Intelectual en el Acceso a Productos Biológicos” publicado en el año 2015

Sección 5: Análisis de los artículos del capítulo de Propiedad Intelectual (Capítulo 18) desde una perspectiva sanitaria

Artículos del capítulo de Propiedad Intelectual– Parte I Disposiciones Asunto Principios GENERALES Entendimientos Relativos a Ciertas Medidas de Salud Pública Materia patentable Excepciones PATENTES TPP (2015) Artículo 18. 3 y 18. 6 del TPP: La interpretación y las flexibilidades aplicables al Artículo 8 del ADPIC se aplican en el Artículo 18. 3. También se reconoce las medidas de salud pública que se pueden aplicar, en su conjunto llamadas la “solución de salud/ADPIC” Artículo 18. 37: INDECOPI ha confirmado que el presente artículo no obliga al Perú a aceptar las patentes de segundo uso, los cuales están prohibidos por la legislación comunitaria andina. En el Perú si está permitido patentar nuevos procedimientos de uso y con esa opción se cumple con lo exigido por el presente Artículo 18. 40: El texto es similar al Artículo 30 de los ADPIC el cual permite al Perú prever en su norma interna limitaciones y excepciones a los derechos exclusivos conferidos por las patentes. Entre tales limitaciones es de primera importancia la referida al “agotamiento” del derecho de patente respecto de productos patentados en el Perú que se hubiese puesto en el comercio en el extranjero por quien es titular de la patente en el Perú, o por una persona económicamente vinculado a este titular. Artículo 18. 41: El Artículo 31 de los ADPIC son los que establecen las licencias obligatorias. El Artículo 18. 41 reconoce la vigencia del Artículo 31 del ADPIC en toda su extensión. Esto ratifica Otros usos sin autorización del Titular del Derecho que la posibilidad de dictar licencias obligatorias en casos de abuso de una patente o por razones de interés o necesidad pública está plenamente legitimada por la normativa internacional referida. Artículo 18. 46 (aprobación de la patente) y Artículo 18. 48 (autorización de la comercialziación): Ajuste de la Duración de la Patente por Retrasos Causaría una contradicción con la norma andina, que prevé que las patentes durarán Irrazonables como máximo 20 años. Queda sujeta a la dispensa que le otorgue la Comunidad Andina al Perú. El Perú queda obligado a realizar sus “mejores esfuerzos” para obtener esa dispensa. Artículo 18. 49: Excepción basada en el examen reglamentario Trata de una limitación especial para permitir usar la invención patentada para fines de obtener un registro sanitario, por lo cual abarca la llamada “excepción Bolar”.

Artículos del capítulo de Propiedad Intelectual– Parte II Disposiciones Asunto TPP (2015) Artículo 18. 50: 1) Se establecen las condiciones de protección a la información no divulgada de seguridad y eficacia, lo cual es compatible con el TLC Perú – EEUU. Sin embargo, se elimina el requisito de que esa información sea el resultado de un “esfuerzo considerable”. 2) Se introduce la obligación de denegar un registro sanitario en el Perú, para un producto o un producto similar al que cuyos datos seguridad y eficacia están protegidos, que se solicite con base en una referencia a un registro sanitario conferido en el extranjero, salvo que se acredite el consentimiento de la persona que obtuvo el registro Protección de datos de prueba sanitario en el extranjero. u otros datos no divulgados Protección de Datos de Prueba (PDP) 3) Para los países, como el Perú, que dan PDP por plazo menor de 8 años, se establece dos opciones adicionales de protección, en las mismas condiciones que lo establecido en el numeral anterior, en la práctica es una extensión de la exclusividad de comercialización. La primera opción requiere dar exclusividad de comercialización por al menos tres años a un producto ya previamente autorizado cuando se presente una nueva información clínica. La segunda opción es la concesión de una exclusividad de comercialización para productos que combinan entidades nuevas y antiguas. Las combinaciones que tienen una o más entidades químicas antiguas y al menos una nueva, deben considerarse como un producto farmacéutico nuevo y dársele la exclusividad. Artículo 18. 51: 1) La exclusividad de comercialización se hará en las mismas condiciones que establece el numeral (1) del Artículo 18. 50. Se señalan dos opciones de período de protección, una de 8 años y la segunda de al menos 5 años pero con textos adicionales en (i) y (ii) que hacen prever que el plazo podría extenderse al menos 3 años más. 2) Se ha introducido el término “protección comercial efectiva”, “otras medidas”, “reconociendo que las condiciones comerciales también contribuyen a la efectiva protección comercial”, “condiciones de mercado”, “incentivos Biológicos efectivos”, cuyos alcances son desconocidos. 3) Define el alcance de la protección: “proteína que es, o, alternativamente contiene…. utilizando procesos biotecnológicos…… para la prevención, tratamiento, o cura de una enfermedad o condición” 4) Establece una comisión revisora del periodo de exclusividad, del ámbito de aplicación, aprobación de categorías adicionales Artículo 18. 52: Definición de Nuevo Producto Con la definición, se puede mantener el sistema implementado por DIGEMID basado en la definición de “nueva Farmacéutico entidad química”. Sin embargo, en el texto en el protocolo de enmienda en el APC Perú – EEUU, el término nueva entidad química proporciona la base legal para que la DIGEMID no extienda la PDP a productos biológicos. Medidas Relativas a la Artículo 18. 53: Comercialización de Ciertos Se podrá mantener el sistema de transparencia implementado por la DIGEMID para implementar el APC con EE. UU. Productos Farmacéuticos

Artículos del capítulo de Propiedad Intelectual– Parte III Disposiciones Anexo 18 – D Perú Asunto TPP (2015) La parte 1 si bien logra neutralizar la prolongación del periodo de la patente por retrasos irrazonables, obliga al Perú a hacer sus “mejores esfuerzos” ante la CAN para obtener una excepción, en el caso hipotético que Perú lograra esta excepción (como fue para la PDP en el TLC Perú – EEUU) sí aplicaría prolongar el período de la patente. La parte 2, preserva lo dispuesto por el TLC Perú – EEUU y en la práctica el período de PDP o de exclusividad de comercialización podría ser menor dependiendo el plazo que se tome el titular de la PDP para registrar su producto en el mercado peruano.

Sección 6: Conclusiones

Conclusiones: 1. - Las familias peruanas están en un situación de vulnerabilidad en caso se vean obligadas a asumir un tratamiento con productos biotecnológicos debido a que los hogares son la principal fuente de financiamiento de la atención de salud. 2. -La exclusividad de productos biotecnológicos por protección de datos de prueba (PDP) retrasaría la reducción de precios, el incremento del consumo y la mejora del acceso. 3. - Cuatro (4) de un grupo de quince (15) que conforman el esquema de inmunizaciones que dirige el Ministerio de Salud son vacunas de origen biotecnológicos, representando una parte importante del gasto del MINSA. En valores, han sido los productos biotecnológicos que más se han importado el 2015; esto podría comprometer la sostenibilidad de las acciones de prevención en salud pública. 4. - Se podría poner en riesgo la sostenibilidad financiera de las prestaciones/ programas de las instituciones públicas de salud como Es. SALUD, el SIS y FISSAL. 5. - Las proyecciones de las enfermedades no transmisibles y del cáncer (problemas de salud pública en la actualidad) muestran que el problema se seguirá extendiendo, con el consecuente impacto negativo en la salud de más peruanos y en la situación financiera de las familias y de las instituciones de salud. 6. - La diferencia entre el gasto estimado para el tratamiento con biotecnológicos solo para los nuevos casos de tres tipos de canceres (mama, colorrectal y pulmón) para el 2012 y el gasto efectuado por el SIS, FISSAL y Es. SALUD en productos biotecnológicos para el periodo 2012 - 2014, sugiere que existirían grupos importantes de pacientes que no pudieron acceder a tratamientos que les hubiera permitido aliviar su discapacidad o prolongar su vida con una calidad aceptable. 7. - Los estudios realizados por el MINSA muestran que la PDP para productos biotecnológicos tendría un impacto negativo sobre el precio y costo de tratamiento, en el gasto público y presupuesto institucional y en el acceso y consumo de los productos biotecnológicos.

GRACIAS
 Mundo pacfico
Mundo pacfico Pacfico
Pacfico Score de wells tpp
Score de wells tpp Besaran tpp pemkab sleman
Besaran tpp pemkab sleman Dehidrogenovanje
Dehidrogenovanje Relationship between tpp mpp and app
Relationship between tpp mpp and app Lignite kosovo
Lignite kosovo Contoh soal mpp = app tpp
Contoh soal mpp = app tpp Odbern
Odbern Tipos de estudio de impacto ambiental
Tipos de estudio de impacto ambiental Preguntas de impacto
Preguntas de impacto Impacto de las iaas
Impacto de las iaas Impacto
Impacto Matriz de probabilidad e impacto pmbok
Matriz de probabilidad e impacto pmbok Matriz de control operacional ambiental
Matriz de control operacional ambiental Ruido continuo intermitente y de impacto
Ruido continuo intermitente y de impacto Impacto ambiental ejemplos
Impacto ambiental ejemplos Impacto ambiental definición
Impacto ambiental definición Efectos del impacto ambiental
Efectos del impacto ambiental Representantes del boom latinoamericano
Representantes del boom latinoamericano Modelo de burke litwin
Modelo de burke litwin Actividad aspecto e impacto ambiental ejemplos
Actividad aspecto e impacto ambiental ejemplos Conclusion de impacto ambiental
Conclusion de impacto ambiental Crecimiento urbano y su impacto en la salud
Crecimiento urbano y su impacto en la salud Impacto de la gran depresion en chile
Impacto de la gran depresion en chile Voce tomou varias fechadas seguidas de um veiculo
Voce tomou varias fechadas seguidas de um veiculo O que é slogan exemplos
O que é slogan exemplos Impacto
Impacto Impacto mundial
Impacto mundial Impacto oblicuo
Impacto oblicuo