22 Keimyung University Principles of instrumental analysis This




















































- Slides: 56

제 22 장 전기 분석화학의 서론 Keimyung University Principles of instrumental analysis


This Chapter : 전기화학전지에 관한 기본이론 전지가 실제로 어떻게 작동하는가? ? Keimyung University Principles of instrumental analysis 2


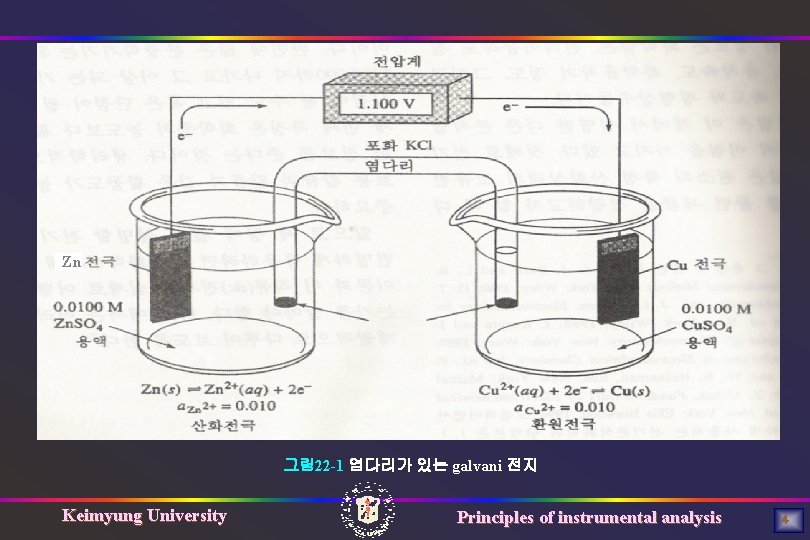
Zn 그림 22 -1 염다리가 있는 galvani 전지 Keimyung University Principles of instrumental analysis 4





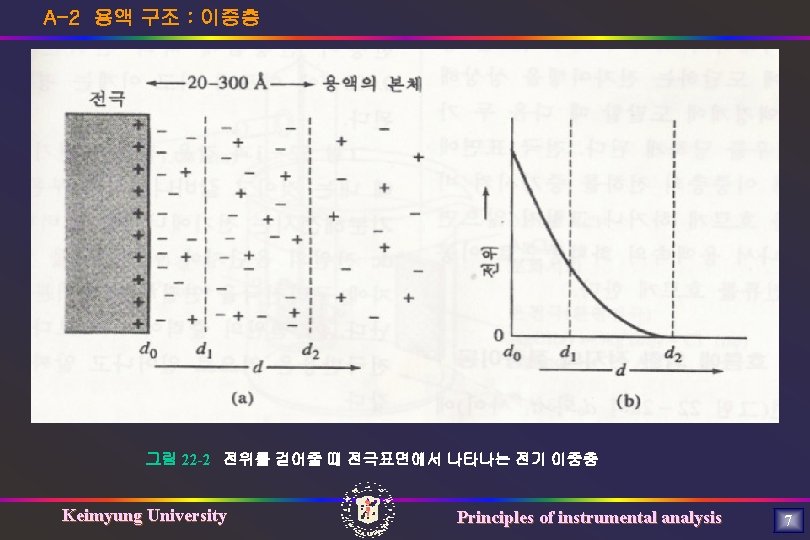
A-2 용액 구조 : 이중층 그림 22 -2 전위를 걸어줄 때 전극표면에서 나타나는 전기 이중층 Keimyung University Principles of instrumental analysis 7





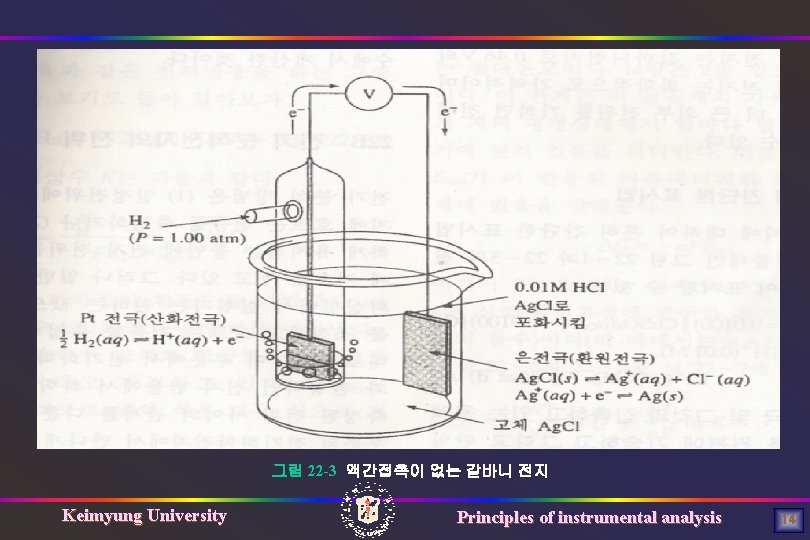
그림 22 -3 액간접촉이 없는 갈바니 전지 Keimyung University Principles of instrumental analysis 14

(은의 환원전극 반응) Ag. Cl + e- ↔ Ag(s) + Cl- (aq) (백금 산화전극 반응) H 2(g) ↔ 2 H+(aq) +2 e- (전체 전지반응 ) 2 Ag. Cl Keimyung University (s) + H 2(g) ↔ 2 Ag(s) + 2 H+(aq) + 2 Cl-(aq) Principles of instrumental analysis 15


A-7 전지의 간단한 표시법 그림 22 -3 전지 : 두 상 경계만이 존재하고 전해질은 두 전극에 공통임 전지 표시법 Pt / H 2(sat´d) , HCl(0. 01 M), Ag+(1. 8× 10 -8 M)/ Ag Keimyung University Principles of instrumental analysis 17





v 전기전위(Ecell)와 반응의 자유에너지와의 관게 (22 -8) F : faraday상수 (96485 coulomb/eq) n : 산화환원과정에 관여한 전기 당량수 식 (22 -6)&(22. 8) → (22 -7) (22 -9) Keimyung University Principles of instrumental analysis 22

Where (22 -10) → (22 -9) (22 -11) Nernst 식 표준전위는 반응물과 생성물이 단위활동도와 단위압력에 있을 때의 전지전위와 같다 Keimyung University Principles of instrumental analysis 23







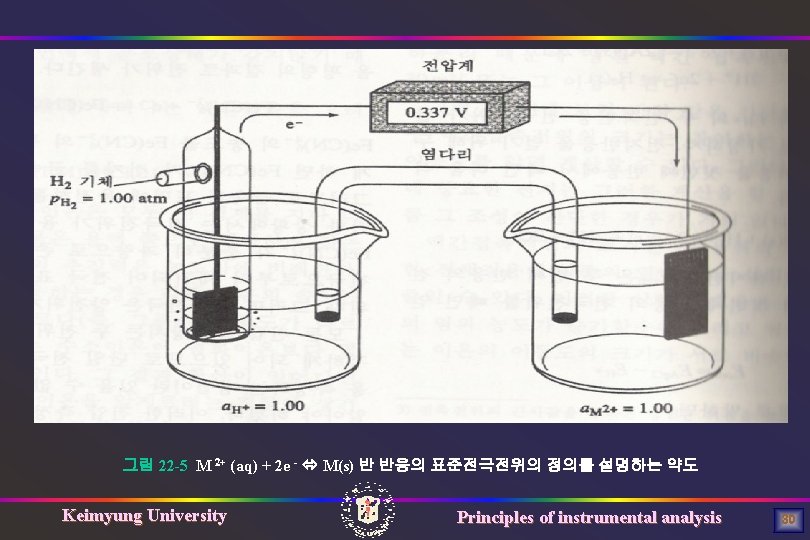
그림 22 -5 M 2+ (aq) + 2 e - M(s) 반 반응의 표준전극전위의 정의를 설명하는 약도 Keimyung University Principles of instrumental analysis 30





(예) 4가지 반쪽전지의 표준전극전위 순서 Cu 2+ + 2 e- Cu(s) E 0 = +0. 337 V 2 H+ + 2 e- H 2(g) E 0 = +0. 000 V Cd 2+ + 2 e- Cd(s) E 0 = -0. 403 V Zn 2+ + 2 e- Zn(s) E 0 = -0. 763 V 환원되는 경향 산화제로서 세기의 감도 순서 Cu 2+ > H+ > Cd 2+ > Zn 2+ Keimyung University Principles of instrumental analysis 35




Where, 자연계수 -> 상용계수 (22 -13) Nernst 식 Keimyung University Principles of instrumental analysis 39


Ag+ + e- Ag(s) E 0 = +0. 799 V 100 Ag+ +100 e- 100 Ag(s) E 0 = +0. 799 V ( 가) ( 나) (가) 반응 (나) 반응 Keimyung University Principles of instrumental analysis 41

C-8 전극전위의 측정 그림 22 -1 그림 22 -3과 비슷한 전지로 0. 52053 V의 전위를 얻었다 Pt , H 2(1. 00 atm)/HCl(3. 215× 10 -5), Ag. Cl(sat‘d)/Ag 다음 반 반응의 표준전극전위를 계산하라 Ag. Cl(s) + e- Ag(s) + Cl- Where, 환원 전극의 전극전위 Keimyung University Principles of instrumental analysis 42

두 번째 반 반응 H+ + e- 1/2 H 2(g) Keimyung University Principles of instrumental analysis 43

측정된 전위 = 이 두 전위 사이의 차이 = Ecathode – Eanode Keimyung University Principles of instrumental analysis 44

C- 9 E 0값에서 반쪽자리 전위의 계산 식 22 -2 0. 0150 M Cd 2+용액에 담근 Cd전극으로 된 반쪽전지의 전위를 계산 표 22 -1 a Cd 2+ + 2 e- Cd(s) E 0 = -0. 403 V = [Cd 2+]가정 Cd 2+ = > Keimyung University Principles of instrumental analysis 45


C- 9 E 0값에서 반쪽자리 전위의 계산 ( Br - ) = a. Br- , Nernst 식 : ( 순수한 액체 Br 2 의 활동도 = 1. 00 ) Keimyung University Principles of instrumental analysis 47


Nernet 식에 대입 a I- = 1. 00, Ksp값 Keimyung University Principles of instrumental analysis 49



D. 전극전위로부터 전지전위의 계산 v 전지의 기전력은 반쪽전지전위로부터 구함 Ecell = Ecathode – Eanode (예) Zn/Zn. SO 4(a. Zn =1. 00)//Cu. SO 4 (a. Cu =1. 00)/Cu 2+ 2+ (환원전극) Cu 2+ + 2 e- Cu(s) E 0=+0. 337 V (산화전극) Zn 2+ + 2 e- Zn(s) E 0=-0. 763 V Ecell = +0. 337 – (-0. 763) = +1. 100 V (전지반응) Zn(s) + Cu 2+ Zn 2+ + Cu(s) 갈바니 전지임 Keimyung University Principles of instrumental analysis 52

If 전지를 다음과 같이 구성 Cu/Cu 2+(a. Cu =1. 00)//Zn 2+(a. Zn =1. 00)/Zn 2+ Ecell = -0. 763 -(+0. 337)=-1. 100 V 따라서 (전지 반응) 2+ Cu(s) + Zn 2+ Cu 2+ + Zn(s) 전기분해전지(비자발적) 1. 100 V보다 큰 전위를 외부에서 걸어주어야 반응이 일어남 Keimyung University Principles of instrumental analysis 53


(Eg 22 -7) 다음 전지의 저항을 4. 00Ω이라고 가정하면, 0. 100Å전류를 다음 갈바니 전지에서 끌어낼때 전위를 계산하라 Cd/Cd 2+(0. 0100 M)//Cu 2+(0. 0100 M)/Cu By Nernst식, ECu = 0. 278 V ECd = -0. 462 V E = ECu – ECd = 0. 278– (-0. 462) = 0. 740 V 전지전위 Ecell = 0. 740 – IR = 0. 740 -(0. 100× 4. 00) = 0. 340 V Keimyung University Principles of instrumental analysis 55
 Keimyung university dormitory
Keimyung university dormitory Principles of instrumental analysis chapter 1 problem 8qp
Principles of instrumental analysis chapter 1 problem 8qp Electronic energy level
Electronic energy level 沈榮麟
沈榮麟 Manejo de instrumental contaminado
Manejo de instrumental contaminado Pokus na sanhi halimbawa
Pokus na sanhi halimbawa Sadaf sajjad
Sadaf sajjad Operant vs classical conditioning
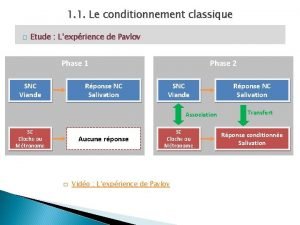
Operant vs classical conditioning Operant conditioning definition
Operant conditioning definition Social contract orientation example
Social contract orientation example Spiritual self mastery of japanese musician
Spiritual self mastery of japanese musician India is known for its unique vocals
India is known for its unique vocals Variable reinforcement schedule
Variable reinforcement schedule Types of reinforcement schedules
Types of reinforcement schedules Racionalidad instrumental que es
Racionalidad instrumental que es Conventional development stage
Conventional development stage Instrumental de operatoria dental
Instrumental de operatoria dental Instrumental variables
Instrumental variables Definition of instrumental delivery
Definition of instrumental delivery Instrumental s
Instrumental s Instrumental nastavci
Instrumental nastavci Funciones del lenguaje instrumental
Funciones del lenguaje instrumental Instrumental values
Instrumental values Condicionament instrumental
Condicionament instrumental Amplificatoare operationale
Amplificatoare operationale Instrumental theory criminology
Instrumental theory criminology Instrumental learning vs classical conditioning
Instrumental learning vs classical conditioning Classical vs operant conditioning
Classical vs operant conditioning Copyright
Copyright Instinct theory in sport
Instinct theory in sport Instumental values
Instumental values An individual's enduring tendency to feel
An individual's enduring tendency to feel Bruners theory
Bruners theory Baroque vocal music
Baroque vocal music Agresividad instrumental
Agresividad instrumental Example of direct aggression
Example of direct aggression Aggression in rugby
Aggression in rugby Instrumental values examples
Instrumental values examples Condicionamento instrumental
Condicionamento instrumental Tequila meme song
Tequila meme song Generic function of management
Generic function of management Pengkondisian instrumental
Pengkondisian instrumental Instrumental value
Instrumental value Influential power
Influential power Materiales para esterilizar
Materiales para esterilizar Mnemonic forceps delivery
Mnemonic forceps delivery Conditionnement instrumental marketing
Conditionnement instrumental marketing The instrumental argument says stakeholder management is
The instrumental argument says stakeholder management is Nancy al baltaji
Nancy al baltaji The songs listed below belong to the different
The songs listed below belong to the different Nivel instrumental
Nivel instrumental Caja de curas material
Caja de curas material Eletricidade instrumental
Eletricidade instrumental Ecuacion de incertidumbre
Ecuacion de incertidumbre Motivación instrumental
Motivación instrumental Instrumental music in new testament worship
Instrumental music in new testament worship Elaborate/succinct communication style
Elaborate/succinct communication style