Wizania wodorowe v wizanie wodorowe jako szczeglny przypadek






![Energia wiązań wodorowych Energia wiązania wodorowego [ k. J/mol] Wiązanie H – O ∙∙∙∙∙ Energia wiązań wodorowych Energia wiązania wodorowego [ k. J/mol] Wiązanie H – O ∙∙∙∙∙](https://slidetodoc.com/presentation_image_h/b4e4ae53081b1d78c4f4d8708e9f263a/image-13.jpg)


- Slides: 17

Wiązania wodorowe v wiązanie wodorowe jako szczególny przypadek wiązania koordynacyjnego (donorowo-akceptorowego / semipolarnego), v zdolność do tworzenia wiązań wodorowych, v przykłady asocjatów / aglomeratów – wiązań wodorowych między cząsteczkami tego samego związku, v przykłady asocjatów / aglomeratów – wiązań wodorowych między cząsteczkami dwóch różnych związków, v energia wiązań wodorowych, v wpływ wiązań wodorowych na właściwości fizyczne substancji, v struktura DNA i 2 o białek

Wiązanie wodorowe – wiązaniem donorowo-akceptorowym v Wiązanie wodorowe – mostki wodorowe występują miedzy atomami wodoru (akceptorami pary elektronowej i wystraczająco dużym cząstkowym ładunku dodatnim) połączonymi wiązaniem kowalencyjnym spolaryzowanym z atomami pierwiastków o dużej elektroujemności posiadającymi wolne pary elektronowe (donorami par / par elektronowych): Ø donorami protonów wodorowych mogą być grupy: - OH, - NH 2, - SH w związkach chemicznych lub cząsteczki NH 3, HF, HCN, Ø akceptorami protonów wodorowych (donorami par elektronowych) są wszystkie atomy silnie elektroujemnych pierwiastków: N, O, S, F, Cl oraz ruchliwa para wiążąca π.

Wiązanie wodorowe – wiązaniem donorowo-akceptorowym / cd Ø proton wodorowy jest przyciągany jednocześnie ale z różnymi energiami przez dwie pary elektronowe: ü silnie przyciągany przez parę elektronową wiązania kowalencyjnego spolaryzowanego, ü słabo przyciągany (elektrostatycznie) wolną / niewiążącą parę elektronową atomu pierwiastka silnie elektroujemnego innej cząsteczki tego samego związku lub innego związku, Ø wiązanie wodorowe jest ok. 10 -ciokrotnie słabsze od wiązania kowalencyjnego.

Wiązanie wodorowe – wiązaniem donorowo-akceptorowym / cd v Wiązanie wodorowe jest słabym oddziaływaniem typu elektrostatycznego między protonem wodorowym, związanym wiązaniem kowalencyjnym z atomem o dużej elektroujemności i wolną parą elektronową atomu silnie elektroujemnego: F, O, N, Cl, S należącego do innej cząsteczki lub w obrębie cząsteczki. v Długość wiązania wodorowego jest z reguły większa od długości wiązania kowalencyjnego. v Wiązanie wodorowe ma charakter kierunkowy, jądra układu leżą najczęściej wzdłuż linii prostej. v Liczba wiązań wodorowych jest ograniczona, atom pierwiastka o silnej elektroujemności może utworzyć tyle wiązań wodorowych, ile posiada wolnych par elektronowych: (np. tlen – 2 wiązania, azot – 1 wiązanie).

Zdolność utworzenia wiązania wodorowego v Zdolność do wytworzenia wiązań wodorowych – uszeregowanie wg malejącej zdolności: Ø F > O > N > Cl > S ≥ C v Zdolność do przyjęcia protonu wodorowego (akceptacji wodoru) – uszeregowanie wg malejącej zdolności: Ø - F > C = O > C – OH > C–O–C > grupa: ketonowa; hydroksylowa; eterowa R – NH 2 > R – NH > R – N – R | | R R amina 1 o; amina 2 o; amina 3 o

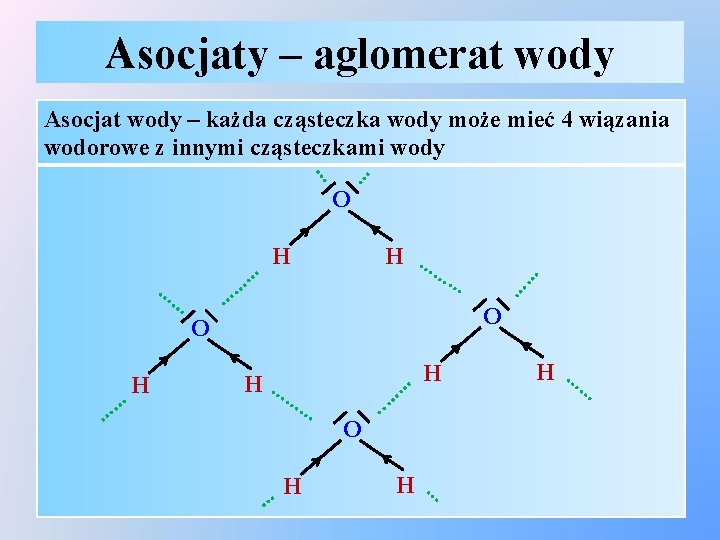
Asocjaty – aglomerat wody … … Asocjat wody – każda cząsteczka wody może mieć 4 wiązania wodorowe z innymi cząsteczkami wody H …… … H O … …. . H H … …… H …… O … …… H H …… O O H ……


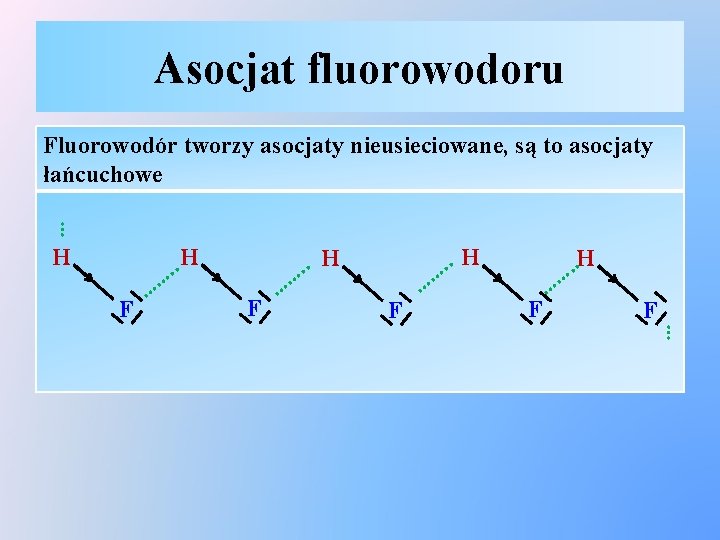
Asocjat fluorowodoru … Fluorowodór tworzy asocjaty nieusieciowane, są to asocjaty łańcuchowe . H. … H F … . H. … F … F H. . …… F …

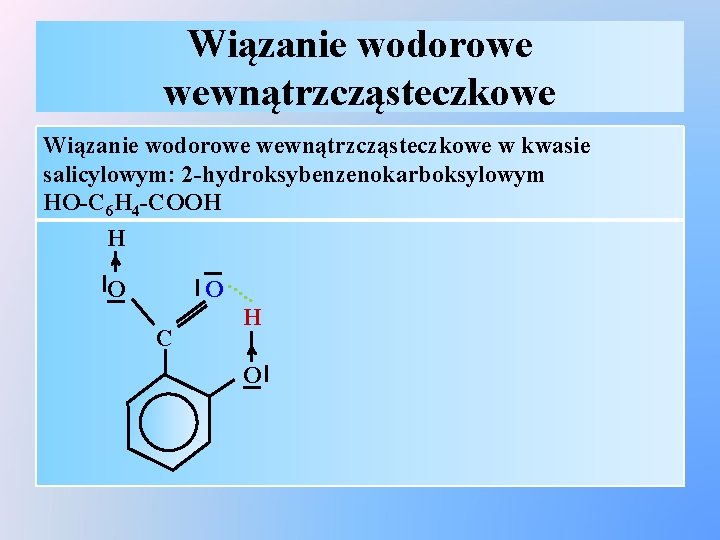
Wiązanie wodorowe wewnątrzcząsteczkowe w kwasie salicylowym: 2 -hydroksybenzenokarboksylowym HO-C 6 H 4 -COOH H O C O. . . H O

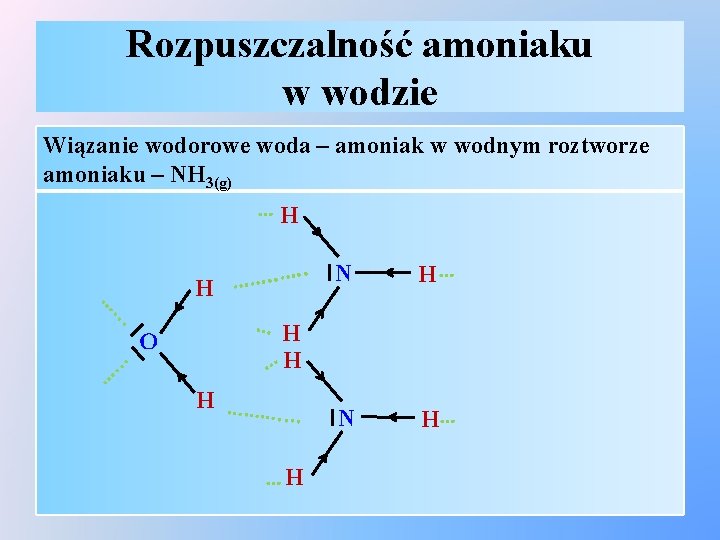
Rozpuszczalność amoniaku w wodzie Wiązanie wodorowe woda – amoniak w wodnym roztworze amoniaku – NH 3(g) … H ………. . H … N … H … . . . … … H H . . . … O N H . . . …. … … H

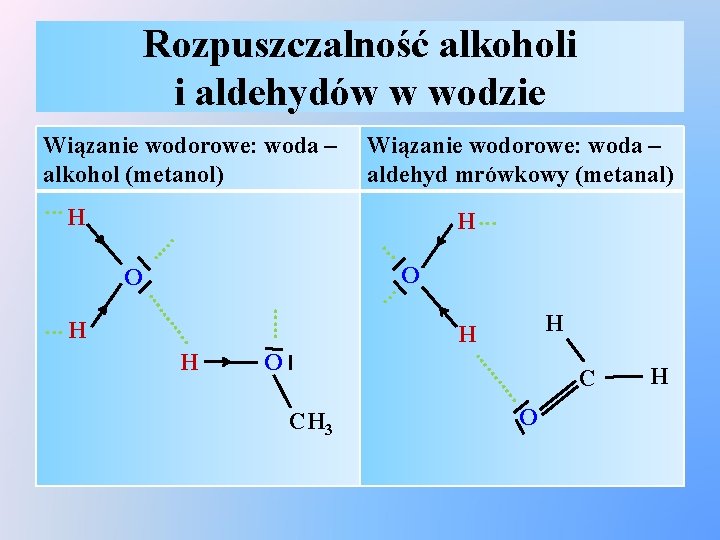
Rozpuszczalność alkoholi i aldehydów w wodzie … O . …. O CH 3 C H H O …… H H . …. . . …… . . . O. . . H . . . . Wiązanie wodorowe: woda – aldehyd mrówkowy (metanal) H Wiązanie wodorowe: woda – alkohol (metanol). . . H

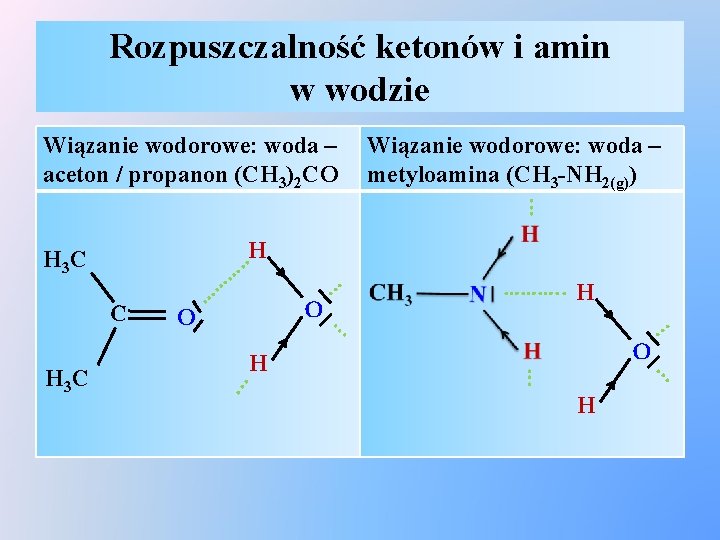
Rozpuszczalność ketonów i amin w wodzie Wiązanie wodorowe: woda – metyloamina (CH 3 -NH 2(g)). . . Wiązanie wodorowe: woda – aceton / propanon (CH 3)2 CO O . . . H . . . O . . . H 3 C O ………. . H . . . C …… . H. … . . . H 3 C H
![Energia wiązań wodorowych Energia wiązania wodorowego k Jmol Wiązanie H O Energia wiązań wodorowych Energia wiązania wodorowego [ k. J/mol] Wiązanie H – O ∙∙∙∙∙](https://slidetodoc.com/presentation_image_h/b4e4ae53081b1d78c4f4d8708e9f263a/image-13.jpg)
Energia wiązań wodorowych Energia wiązania wodorowego [ k. J/mol] Wiązanie H – O ∙∙∙∙∙ H – Energia 23, 0 – O – H ∙∙∙∙∙ N – 23, 0 – N – H ∙∙∙∙∙ O – 14, 7 – N – H ∙∙∙∙∙ N – 13, 2 F – H ∙∙∙∙∙ F – 27, 2

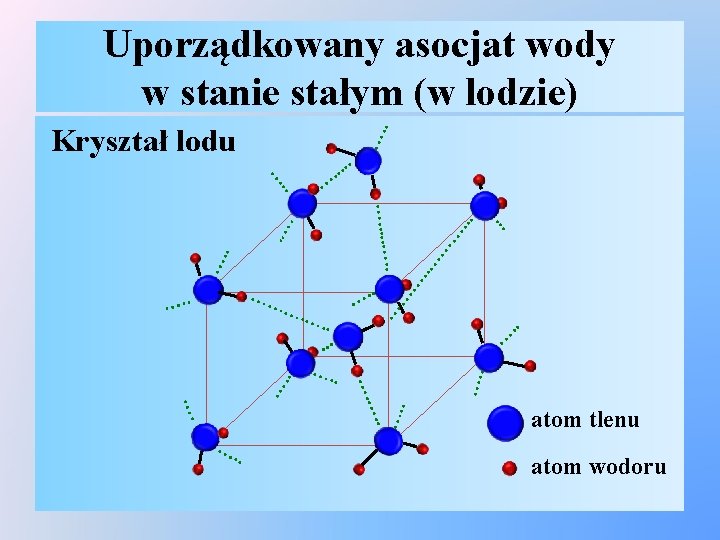
Uporządkowany asocjat wody w stanie stałym (w lodzie) …. . Kryształ lodu . . … … …. …. . . … …. … . . . …. . …. … . …. . … … …… …. . … atom tlenu atom wodoru

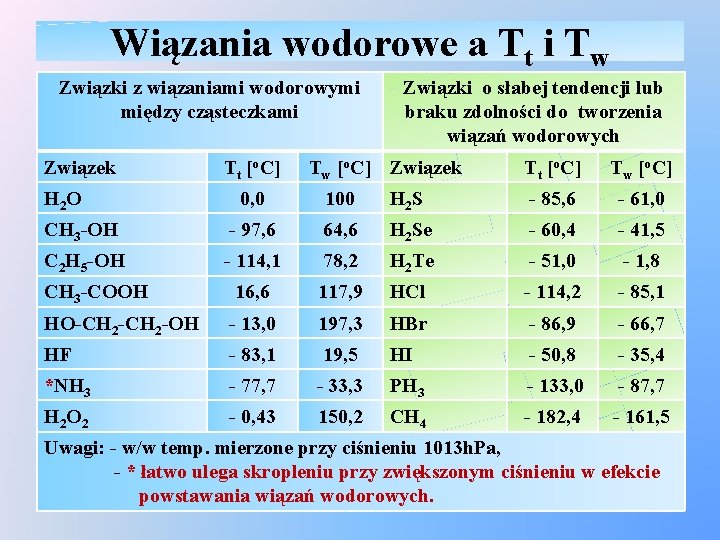
Wiązania wodorowe a Tt i Tw Związki z wiązaniami wodorowymi między cząsteczkami Związek H 2 O Tt [o. C] Związki o słabej tendencji lub braku zdolności do tworzenia wiązań wodorowych Tw [o. C] Związek Tt [o. C] Tw [o. C] 0, 0 100 H 2 S - 85, 6 - 61, 0 CH 3 -OH - 97, 6 64, 6 H 2 Se - 60, 4 - 41, 5 C 2 H 5 -OH - 114, 1 78, 2 H 2 Te - 51, 0 - 1, 8 CH 3 -COOH 16, 6 117, 9 HCl - 114, 2 - 85, 1 HO-CH 2 -OH - 13, 0 197, 3 HBr - 86, 9 - 66, 7 HF - 83, 1 19, 5 HI - 50, 8 - 35, 4 *NH 3 - 77, 7 - 33, 3 PH 3 - 133, 0 - 87, 7 H 2 O 2 - 0, 43 150, 2 CH 4 - 182, 4 - 161, 5 Uwagi: - w/w temp. mierzone przy ciśnieniu 1013 h. Pa, - * łatwo ulega skropleniu przy zwiększonym ciśnieniu w efekcie powstawania wiązań wodorowych.

Wpływ wiązań wodorowych na właściwości fizyczne substancji v Cząsteczki zasocjowane zajmują określone pozycje względem siebie, co prowadzi do większego uporządkowania układu i jednocześnie skutkuje to zwiększeniem nakładu energetycznego do zniesienia uporządkowania. v Wiązania wodorowe wpływają na: Ø stan skupienia substancji, Ø gęstość w stanie ciekłym lub stałym, Ø temperatury topnienia i wrzenia (patrz tabela na poprzedzającym slajdzie), ciśnienia skraplania gazów, Ø rozpuszczalność gazów w cieczach lub cieczy w cieczach.

Struktura DNA i 2 o białek v Powstawanie wiązań wodorowych warunkuje: Ø występowanie struktur drugorzędowych białek: ü wiązania wodorowe powstające między atomem H z grupy N-H i atomem O z grupy C=O w wiązaniach peptydowych powoduje skręcenie struktury 1 o polipeptydu (α – helisa) lub jej sfałdowanie (β – harmonijka), Ø istnienie podwójnej helisy DNA i zachowanie jej struktury: ü atom H grupy N-H tworzy wiązanie z wolną parą elektronową azotu w pierścieniu zasad azotowych: 3 wiązania w parze C – G i 2 wiązania A – T, Ø Wiązanie wodorowe między pojedynczymi włóknami celulozy decydują i o jej właściwościach mechanicznych.
 Wizanie
Wizanie Asocjaty
Asocjaty Wizania
Wizania Kryształy molekularne
Kryształy molekularne Wizania
Wizania Polarita rozpouštědel
Polarita rozpouštědel Kaire kaasik
Kaire kaasik Maud adams jako johanka z arku
Maud adams jako johanka z arku Oddziaływanie w przyrodzie
Oddziaływanie w przyrodzie Rodzina jako grupa społeczna
Rodzina jako grupa społeczna Jako kaasik
Jako kaasik Rozčepýřený vrabec
Rozčepýřený vrabec Student pedagogiki jako obserwator lekcji inaczej
Student pedagogiki jako obserwator lekcji inaczej Pojemność kondensatora kulistego
Pojemność kondensatora kulistego żądania konrada
żądania konrada Thiocodin jako narkotyk
Thiocodin jako narkotyk Siła jako przyczyna zmian ruchu wzory
Siła jako przyczyna zmian ruchu wzory Drvene klompe nizozemska
Drvene klompe nizozemska