Wizanie kowalencyjne atomowe Wizanie kowalencyjne pojedyncze Wizanie kowalencyjne





- Slides: 7

Wiązanie kowalencyjne (atomowe) -Wiązanie kowalencyjne pojedyncze, -Wiązanie kowalencyjne podwójne, -Wiązanie kowalencyjne potrójne

Wiązanie kowalencyjne (atomowe) pojedyncze w cząsteczce F 2 (∆E = 4, 0 – 4, 0 = 0) • Wiązanie kowalencyjne utworzone za pomocą uwspólnionej jednej pary elektronowej nazywamy wiązaniem pojedynczym • Powłoka walencyjna dla każdego at. F – 2 s 22 p 5, najbliższym helowcem dla F jest Ne, którego powłoka walencyjna posiada oktet elektronowy: 2 s 2 p 6, • Atom fluoru aby osiągnąć oktet elektronowy na powłoce walencyjnej potrzebuje 1 elektronu, po uwspólnieniu jednej pary elektronowej każdy z atomów F w cząsteczce F 2 osiąga konfigurację Ne i oktet elektronowy na powłoce walencyjnej.

Wiązanie kowalencyjne (atomowe) pojedyncze w cząsteczce F 2 (∆E = 4, 0 – 4, 0 = 0) cd • • • Zapis w systemie klatkowo-strzałkowym 2 s 2 2 p 5 σ 2 p 5 2 s 2 Zapis elektronowy – kropkowy i kreskowy F + F F F Orbital molekularny p – p, który jest ukierunkowany wzdłuż osi łączącej oba jądra cząsteczki nazywamy wiązaniem σ

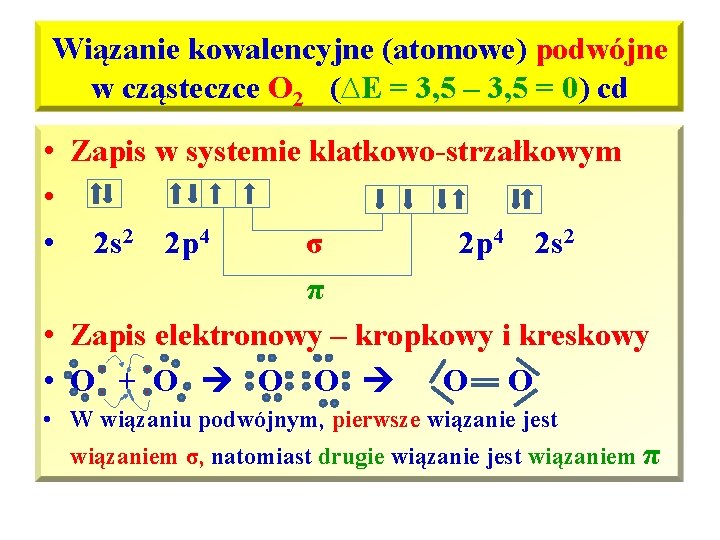
Wiązanie kowalencyjne (atomowe) podwójne w cząsteczce O 2 (∆E = 3, 5 – 3, 5 = 0) • Wiązanie kowalencyjne utworzone za pomocą uwspólnionych dwóch par elektronowych nazywamy wiązaniem podwójnym • Powłoka walencyjna dla każdego at. O – 2 s 22 p 4, najbliższym helowcem dla O jest Ne, którego powłoka walencyjna posiada oktet elektronowy: 2 s 2 p 6, • Atom tlenu aby osiągnąć oktet elektronowy na powłoce walencyjnej potrzebuje 2 elektronów, po uwspólnieniu dwóch par elektronowych każdy z atomów O w cząsteczce O 2 osiąga konfigurację Ne i oktet elektronowy na powłoce walencyjnej.

Wiązanie kowalencyjne (atomowe) podwójne w cząsteczce O 2 (∆E = 3, 5 – 3, 5 = 0) cd • Zapis w systemie klatkowo-strzałkowym • • 2 s 2 2 p 4 σ 2 p 4 2 s 2 π • Zapis elektronowy – kropkowy i kreskowy • O + O O O • W wiązaniu podwójnym, pierwsze wiązanie jest wiązaniem σ, natomiast drugie wiązanie jest wiązaniem π

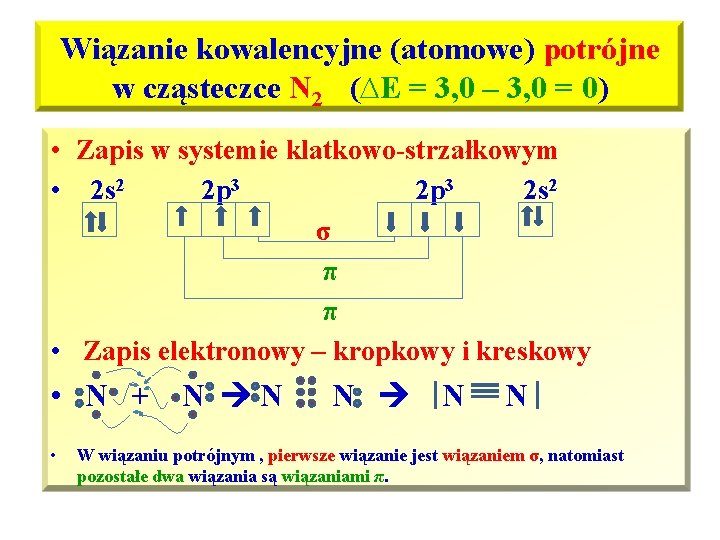
Wiązanie kowalencyjne (atomowe) potrójne w cząsteczce N 2 (∆E = 3, 0 – 3, 0 = 0) • Wiązanie kowalencyjne utworzone za pomocą uwspólnionych trzech par elektronowych nazywamy wiązaniem potrójnym • Powłoka walencyjna dla każdego at. N – 2 s 22 p 3, najbliższym helowcem dla N jest Ne, którego powłoka walencyjna posiada oktet elektronowy: 2 s 2 p 6, • Atom azotu aby osiągnąć oktet elektronowy na powłoce walencyjnej potrzebuje 3 elektronów, po uwspólnieniu trzech par elektronowych każdy z atomów N w cząsteczce N 2 osiąga konfigurację Ne i oktet elektronowy na powłoce walencyjnej.

Wiązanie kowalencyjne (atomowe) potrójne w cząsteczce N 2 (∆E = 3, 0 – 3, 0 = 0) • Zapis w systemie klatkowo-strzałkowym • 2 s 2 2 p 3 2 s 2 σ π π • Zapis elektronowy – kropkowy i kreskowy • N + N N • N N N W wiązaniu potrójnym , pierwsze wiązanie jest wiązaniem σ, natomiast pozostałe dwa wiązania są wiązaniami π.












