Wizanie kowalencyjne spolaryzowane Wizanie w czsteczce heteroatomowej zoonej






- Slides: 8

Wiązanie kowalencyjne spolaryzowane -Wiązanie w cząsteczce heteroatomowej złożonej z dwóch atomów, -Wiązanie w cząsteczce heteroatomowej złożonej z kilku atomów

Wiązanie kowalencyjne spolaryzowane w cząsteczce HCl • Wiązanie utworzone przez wspólną parę elektronową przesuniętą w kierunku jądra atomu pierwiastka bardziej elektroujemnego jest wiązaniem kowalencyjnym (atomowym) spolaryzowanym. • Różnica elektroujemności między atomami H i Cl w cząsteczce HCl ∆E = 3, 0 – 2, 1 = 0, 9. • Izolowany atom wodoru posiada jeden niesparowany elektron 1 s 1 i do dubletu elektronowego a tym samym do konfiguracji elektronowej helu brakuje 1 elektronu. • Izolowany atom chloru posiada 7 elektronów walencyjnych 3 s 23 p 5, w tym 3 pary i jeden elektron niesparowany, do oktetu elektronowego a tym samym do konfiguracji elektronowej argonu brakuje 1 elektronu.

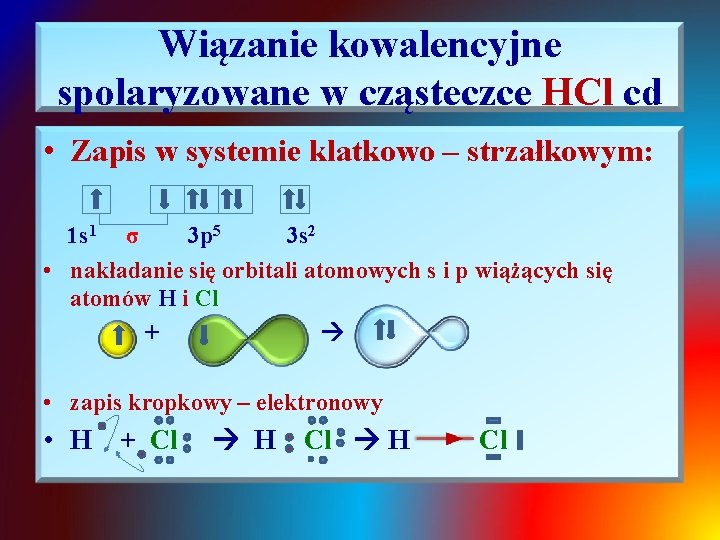
Wiązanie kowalencyjne spolaryzowane w cząsteczce HCl cd • Zapis w systemie klatkowo – strzałkowym: 1 s 1 σ 3 p 5 3 s 2 • nakładanie się orbitali atomowych s i p wiążących się atomów H i Cl + • zapis kropkowy – elektronowy • H + Cl H Cl

Wiązanie kowalencyjne spolaryzowane w cząsteczce HCl cd • orbital molekularny w cząsteczce HCl – para wiążąca jest przesunięta w kierunku jądra atomu chloru jako pierwiastka bardziej elektroujemnego (chmura elektronowa, wspólna dla jąder wiążących się atomów H i Cl jest bardziej zagęszczona wokół atomu chloru), • rozkład ładunku elektrycznego jest niesymetryczny, prawdopodobieństwo przebywania pary elektronowej bliżej jądra Cl jest większe niż, jądra atomu H, • atom Cl zyskuje ujemny ładunek cząstkowy –δ i wokół atomu Cl wytwarza się ujemny biegun cząsteczki HCl, • wokół atomu H, który zyskuje dodatni ładunek cząstkowy +δ, wytwarza się biegun dodatni cząsteczki HCl,

Wiązanie kowalencyjne spolaryzowane w cząsteczce HCl cd • Polarność (dipolowość) cząsteczki – cząsteczka HCl posiada dwa różnoimienne bieguny (- i +): • δ+H δ-Cl • Polarność (dipolowość) cząsteczek wpływa na właściwości fizyczne i chemiczne tych związków, budowę polarną posiadają również cząsteczki heteroatomowe zbudowane z wielu atomów.

Wiązanie kowalencyjne spolaryzowane w cząsteczce H 2 O • W cząsteczce H 2 O (również H 2 S, NH 3) w przeciwieństwie do cząsteczki HCl (również HI, HBr, HI, CO) polarność wskazuje na budowę nieliniową, cząsteczka ma budowę kątową (H 2 O, H 2 S) lub czworościenną (NH 3): • na atomie tlenu w powłoce walencyjnej występują dwie wolne pary elektronowe niewiążące, które odpychają się najsilniej, pary wiążące σ odpychają się najsłabiej, natomiast wolna para niewiążąca się z parą wiążącą σ odpycha z energią pośrednią, • efektem odpychania się par elektronowych jest zagięcie wiązań, kąt zagięcia na wiązaniach zelży od liczby wolnych par elektronowych i polarności wiązań.

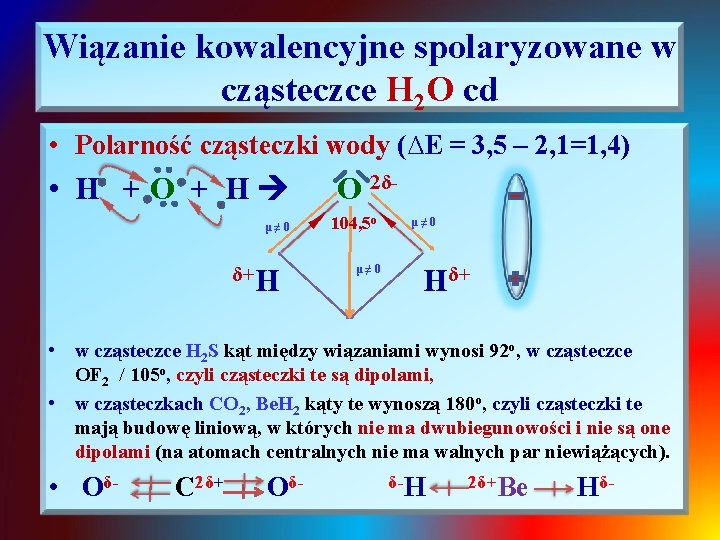
Wiązanie kowalencyjne spolaryzowane w cząsteczce H 2 O cd • Polarność cząsteczki wody (∆E = 3, 5 – 2, 1=1, 4) • H +O + H μ≠ 0 δ+H O 2δ 104, 5 o μ≠ 0 Hδ+ • w cząsteczce H 2 S kąt między wiązaniami wynosi 92 o, w cząsteczce OF 2 / 105 o, czyli cząsteczki te są dipolami, • w cząsteczkach CO 2, Be. H 2 kąty te wynoszą 180 o, czyli cząsteczki te mają budowę liniową, w których nie ma dwubiegunowości i nie są one dipolami (na atomach centralnych nie ma walnych par niewiążących). • Oδ- C 2δ+ Oδ- δ-H 2δ+Be Hδ-

Wiązanie kowalencyjne spolaryzowane w cząsteczce NH 3, CH 4 Wiązanie w cząsteczce NH 3 – cząsteczka jest dipolem, na atomie centralnym (N) znajduje się wolna para elektronowa, kąty między wiązaniami wynoszą 107 o Nδ- μw ≠ 0 δ+H μw ≠ 0 Wiązanie w cząsteczce CH 4 cząsteczka nie jest dipolem, na atomie centralnym (C) nie ma wolnej pary elektronowej , wszystkie kąty między wiązaniami wynoszą 109 o 28` δ+H μw ≠ 0 δ+H μcz ≠ 0 μw ≠ 0 δC μw ≠ 0 δ+H μcz = 0








