Wizania jonowe i jonizacja definicja istota wizania jonowego










- Slides: 14

Wiązania jonowe i jonizacja Ø Ø Ø Ø definicja – istota wiązania jonowego, jonizacja - modele powstawania jonów na przykładzie Na. Cl kryształy jonowe przykłady wiązań jonowych, energia jonizacji i powinowactwo elektronowe, ∆E a % udział wiązań jonowych, charakter wiązań w wybranych tlenkach i wodorkach

Istota wiązania jonowego v Wiązania w cząsteczkach powstających z atomów pierwiastków różniących się znacznie elektroujemnością (∆E > 1, 7) czyli wiązania między atomami metali i niemetali są wiązaniami jonowymi v Wiązanie jonowe polega na elektrostatycznym przyciąganiu się różnoimiennie naładowanych jonów, siły przyciągania jonów różnoimiennych są większe niż siły odpychania się jonów jednoimiennych, v Związki jonowe w stałym stanie skupienia tworzą sieć krystaliczną – kryształy jonowe.

Analiza wiązania w cząsteczce Na. Cl: jonizacja – powstawanie jonu Na+ v Jonizacja – przekształcenie się atomu Na w kation sodu: atom sodu aby osiągnąć niższy stan energetyczny (konfigurację elektronową najbliższego sobie helowca - neonu 1 s 22 p 6 – i oktet elektronowy) musi oddać jeden elektron z orbitalu 3 s 1 v v Na +11 + energia Na+ + 1 e- K 2 L 8 M 1 atom sodu +11 + 2 8 KL + 1 e- kation sodu v Atom tracący elektron (elektrony) przekształca się w jon dodatni – kation, który ma przewagę liczby protonów na liczbą elektronów, ładunek dodatni kationu jest równy liczbie oddanych elektronów.

Analiza wiązania w cząsteczce Na. Cl: jonizacja – powstawanie jonu Clv Jonizacja – przekształcenie się atomu Cl w anion chlorkowy: atom chloru aby osiągnąć niższy stan energetyczny (konfigurację elektronową najbliższego sobie helowca - argonu 1 s 22 p 63 s 23 p 6 – i oktet elektronowy) musi pobrać jeden elektron v K 2 L 8 M 7 + 1 e- K 2 L 8 M 8 ± energia +17 v +17 Cl + 1 e- [ Cl ]atom chloru anion chlorkowy v Atom pobierając elektron (elektrony) przekształca się w jon ujemny – anion, który ma przewagę liczby elektronów na liczbą protonów, ładunek ujemny anionu jest równy liczbie pobranych elektronów.

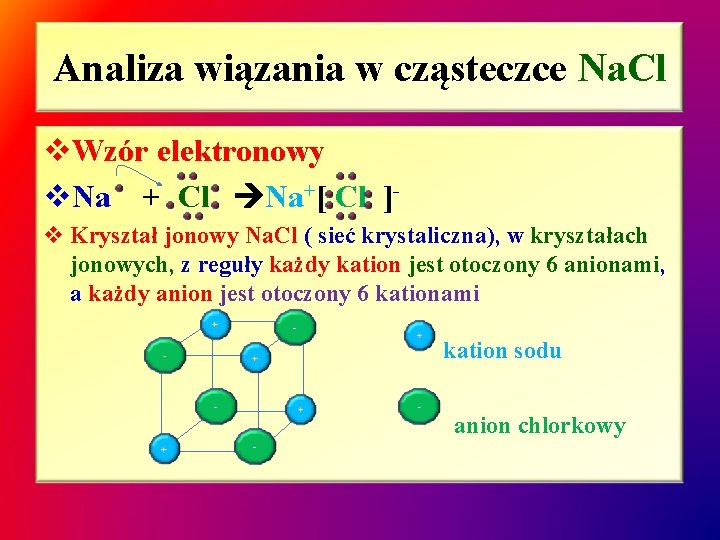
Analiza wiązania w cząsteczce Na. Cl v. Wzór elektronowy v. Na + Cl Na+[ Cl ]v Kryształ jonowy Na. Cl ( sieć krystaliczna), w kryształach jonowych, z reguły każdy kation jest otoczony 6 anionami, a każdy anion jest otoczony 6 kationami + - + + - - kation sodu anion chlorkowy

Wiązania jonowe – przykłady v. K 2 O : ∆E = 3, 5 – 0, 9 = 2, 6 v. K + O + K K+ [ O ]2 -K+ v. Ca. Br 2: ∆E = 2, 8– 1, 0 = 1, 8 v Br + Ca + Br [ Br ]-Ca 2+[ Br ]v. Cs 2 S: ∆E = 2, 5 – 0, 7 = 1, 8 v. Cs + S + Cs Cs+[ S ]2 -Cs+

Wiązania jonowe – przykłady cd v. Ba. O: ∆E = 3, 5 – 0, 9 = 2, 6 v. Ba + O Ba 2+ [ O ]2 v. Al. F 3: ∆E = 4, 0 – 1, 5 = 2, 5 v F + Al + F + Al 3+ [ F ]3 F

Wiązania jonowe – przykłady cd v. KH: ∆E = 2, 1 – 0, 9 = 1, 2 v K + H K + [ H ]v. Ca. H 2: ∆E = 2, 1 – 1, 0 = 1, 1 v H + Ca + H Ca 2+ + [ H ]2 v Uwaga: Ø Wodorki litowców i wapniowców należy traktować jako związki jonowe mimo niespełnienia warunku ∆E ≥ 1, 7. Ø HF nie jest związkiem jonowym mimo spełnienia warunku ∆E ≥ 1, 7, ponieważ nie tworzy kryształów jonowych.

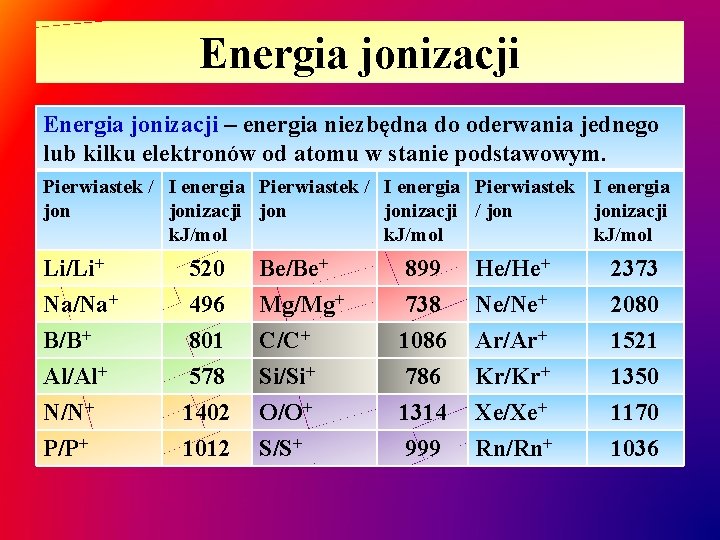
Energia jonizacji – energia niezbędna do oderwania jednego lub kilku elektronów od atomu w stanie podstawowym. Pierwiastek / I energia Pierwiastek I energia jon jonizacji / jonizacji k. J/mol Li/Li+ Na/Na+ B/B+ Al/Al+ N/N+ P/P+ 520 496 801 578 1402 1012 Be/Be+ Mg/Mg+ C/C+ Si/Si+ O/O+ S/S+ 899 738 1086 786 1314 999 He/He+ Ne/Ne+ Ar/Ar+ Kr/Kr+ Xe/Xe+ Rn/Rn+ 2373 2080 1521 1350 1170 1036

Energia powinowactwa elektronowego – efekt energetyczny (energię pobraną przez atom lub przekazaną do otoczenia przez atom), który towarzyszy przyłączenia elektronu do atomu. Pierwiastek / I energia jonizacji jon k. J/mol Li/Li- 60 S/S- 200 Na/Na- 53 Cl/Cl- 349 Al/Al- 42 F/F- 328 Si/Si- 134 Br/Br- 325 P/P- 72 I/I- 295

Obliczenie % udziału wiązań jonowych w cząsteczce v W przypadku wiązań pojedynczych procentowy udział wiązań jonowych w cząsteczce A – B można obliczyć w przybliżeniu z wyrażenia: % = 16 ∙ | x. A – x. B | + 3, 5 ∙ | x. A – x. B |2 Ø gdzie: ü x. A i x. B – elektroujemność pierwiastka w skali Paulinga ü | x. A – x. B | - wartość bezwzględna różnicy elektroujemności Ø Przykłady KF / ∆E = 3, 2 % = 16 ∙ |0, 8 – 4, 0| + 3, 5 ∙ |0, 8 – 4, 0|2 = 87, 04 Cs. H / ∆E = 1, 4 % = 16 ∙ |0, 7 – 2, 1| + 3, 5 ∙ |0, 7 – 2, 1|2 = 29, 26 v Rzeczywisty charakter wiązania jonowego wynika nie tylko z ∆E, ale również z promieni atomowych / jonowych: np. w przypadku HF % udział wiązań jonowych powinien wynosić 59% a w rzeczywistości wiązania jonowe stanowią 45%.

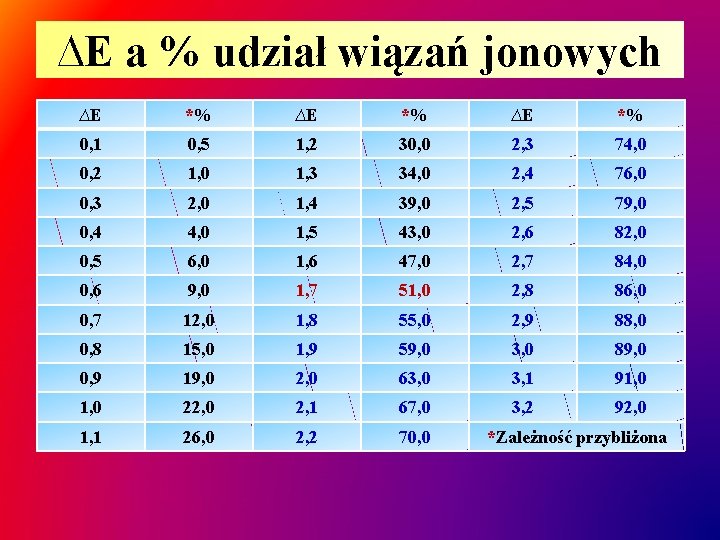
∆E a % udział wiązań jonowych ∆E *% 0, 1 0, 5 1, 2 30, 0 2, 3 74, 0 0, 2 1, 0 1, 3 34, 0 2, 4 76, 0 0, 3 2, 0 1, 4 39, 0 2, 5 79, 0 0, 4 4, 0 1, 5 43, 0 2, 6 82, 0 0, 5 6, 0 1, 6 47, 0 2, 7 84, 0 0, 6 9, 0 1, 7 51, 0 2, 8 86, 0 0, 7 12, 0 1, 8 55, 0 2, 9 88, 0 0, 8 15, 0 1, 9 59, 0 3, 0 89, 0 0, 9 19, 0 2, 0 63, 0 3, 1 91, 0 22, 0 2, 1 67, 0 3, 2 92, 0 1, 1 26, 0 2, 2 70, 0 *Zależność przybliżona

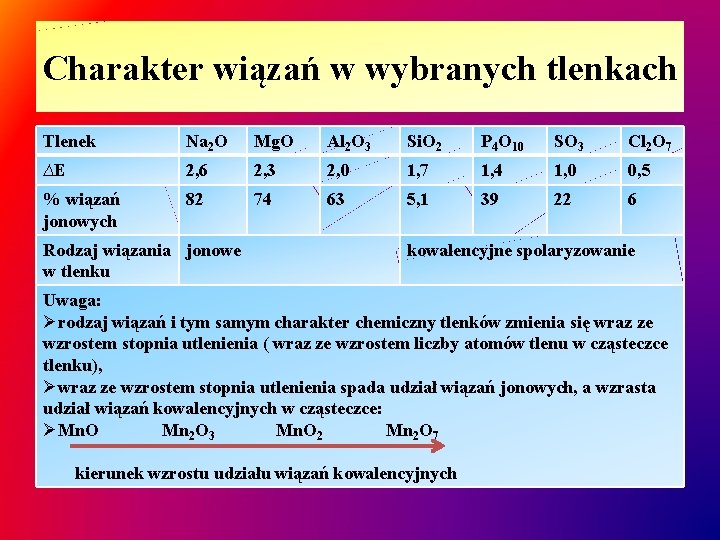
Charakter wiązań w wybranych tlenkach Tlenek Na 2 O Mg. O Al 2 O 3 Si. O 2 P 4 O 10 SO 3 Cl 2 O 7 ∆E 2, 6 2, 3 2, 0 1, 7 1, 4 1, 0 0, 5 % wiązań jonowych 82 74 63 5, 1 39 22 6 Rodzaj wiązania jonowe w tlenku kowalencyjne spolaryzowanie Uwaga: Ørodzaj wiązań i tym samym charakter chemiczny tlenków zmienia się wraz ze wzrostem stopnia utlenienia ( wraz ze wzrostem liczby atomów tlenu w cząsteczce tlenku), Øwraz ze wzrostem stopnia utlenienia spada udział wiązań jonowych, a wzrasta udział wiązań kowalencyjnych w cząsteczce: ØMn. O Mn 2 O 3 Mn. O 2 Mn 2 O 7 kierunek wzrostu udziału wiązań kowalencyjnych

Charakter wiązań w wybranych związków z wodorem Wodorek *Na. H Mg. H 2 Al. H 3 Si. H 4 **PH 3 H 2 S HCl ∆E 1, 2 0, 9 0, 6 0, 3 0, 0 0, 4 0, 9 % wiązań jonowych 30 19 9 2 0 4 19 Rodzaj wiązania kowalencyjne spolaryzowanie w tlenku Uwaga: Ø* wodorek sodu oraz wodorki litowców i wapniowców w rzeczywistości są związkami jonowymi (tworzą kryształy jonowe a anionem H-, Ø**fosfina (fosforiak) jest związkiem o wiązaniach kowalencyjnych spolaryzowanych ze względu na znaczną różnicę w promieniu atomowym atomu fosforu i atomów wodoru, wykazuje bardzo słabe właściwości zasadowe (analogicznie do kationu NH 4+) : ØPH 3(g) + H 2 O(c) ↔ PH 4+(c) + OH-(c)
 Wiązanie jonowe polega na elektrostatycznym
Wiązanie jonowe polega na elektrostatycznym Wizania
Wizania Wizania
Wizania Wizania
Wizania Istota inflacji
Istota inflacji Istota motywacji
Istota motywacji Nadludzka istota obdarzona siłą tworzenia
Nadludzka istota obdarzona siłą tworzenia Rdzeń kręgowy budowa i funkcje
Rdzeń kręgowy budowa i funkcje Istota i cel badań marketingowych
Istota i cel badań marketingowych Kiedy rozpoczyna się rok liturgiczny
Kiedy rozpoczyna się rok liturgiczny Istota biała w mózgu
Istota biała w mózgu Człowiek istota płciowa scenariusz lekcji klasa 4
Człowiek istota płciowa scenariusz lekcji klasa 4 Merchandising istota
Merchandising istota Istota marketingu
Istota marketingu Istota logistyki
Istota logistyki