Wizania midzyatomowe Typ wizania Energia k Jmol Jonowe



![Wiązania międzyatomowe zestawienie Typ wiązania Substancja Jonowe Energia [k. J/mol] Energia [e. V/jon Temp. Wiązania międzyatomowe zestawienie Typ wiązania Substancja Jonowe Energia [k. J/mol] Energia [e. V/jon Temp.](https://slidetodoc.com/presentation_image_h/a92b1e30a9fe5ac1c317a77296c2de8c/image-11.jpg)
- Slides: 11

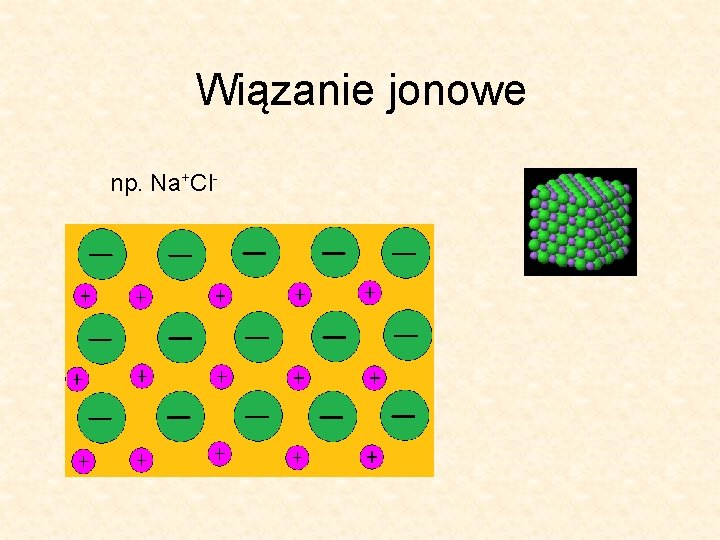
Wiązania międzyatomowe Typ wiązania Energia (k. J/mol) Jonowe 600 -1550 (np. . Na+Cl- , kierunkowe, kruche) Kowalencyjne 500 -1250 (np. w diamencie) Metaliczne 100 -850 (plastyczne, duża przewodność) van der Waalsa (np. między łańcuchami w polimerach) http: //z. about. com/d/chemistry/1/0/q/p/Sodium-chloride-3 D-ionic. jpg <40

Wiązanie jonowe np. Na+Cl-

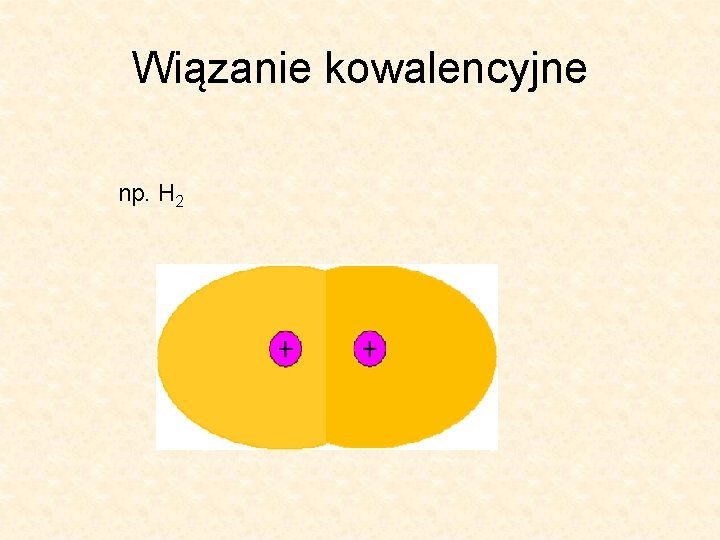
Wiązanie kowalencyjne np. H 2

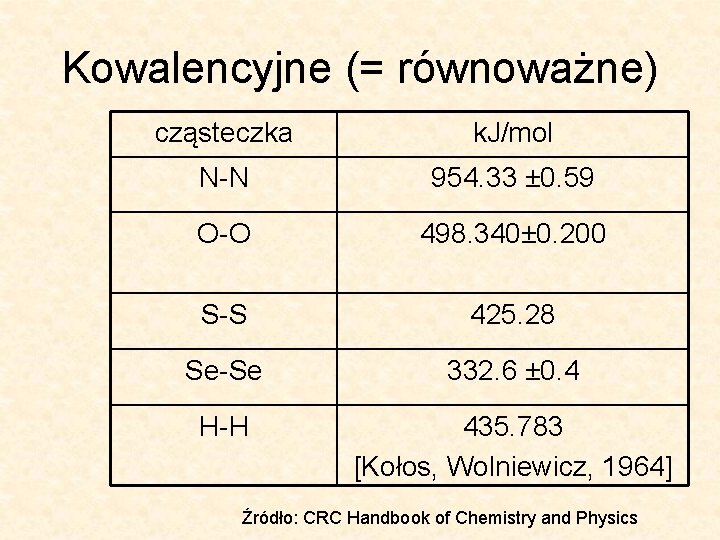
Kowalencyjne (= równoważne) cząsteczka k. J/mol N-N 954. 33 ± 0. 59 O-O 498. 340± 0. 200 S-S 425. 28 Se-Se 332. 6 ± 0. 4 H-H 435. 783 [Kołos, Wolniewicz, 1964] Źródło: CRC Handbook of Chemistry and Physics

Kowalencyjne (lub prawie) cząsteczka k. J/mol H-CH 3 439. 7 H-OH 498 H-NH 2 460 O-N 2 167 O-NO 305 Źródło: CRC Handbook of Chemistry and Physics

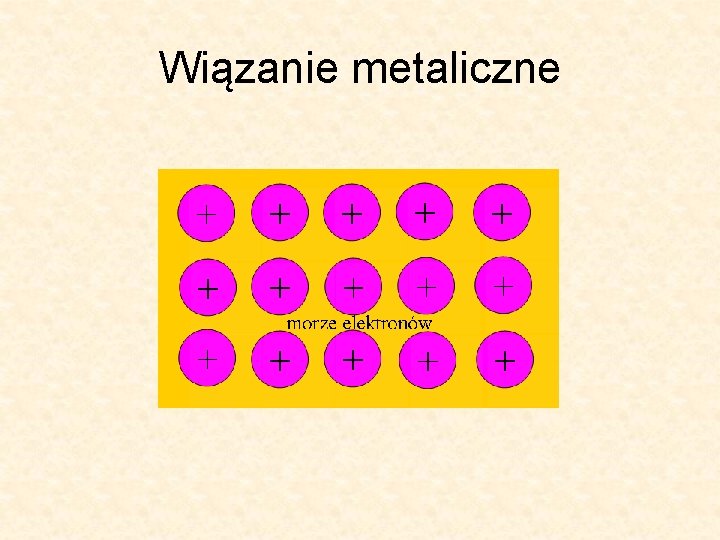
Wiązanie metaliczne

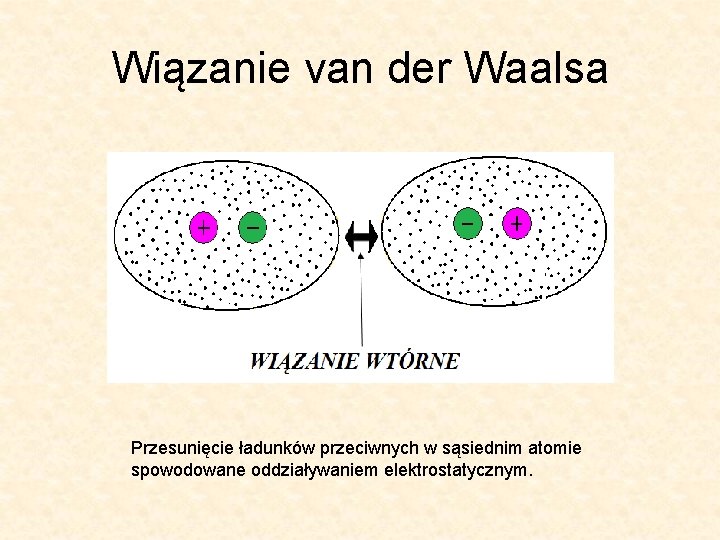
Wiązanie van der Waalsa Przesunięcie ładunków przeciwnych w sąsiednim atomie spowodowane oddziaływaniem elektrostatycznym.

Dimery kwasu mrówkowego Total Energy = -236967. 26 kcal/mol ZPVE = 45. 93 kcal/mol Electron affinity EA = -21 kcal/mol EA with ZPVE corr. = -18, 68 kcal/mol (HCOOH)2 H Wiązanie poprzez uwspólnienie atomu wodoru, tzw. wiązanie „wodorowe” Gęstość elektronów wokół atomu wodoru jest mała, oznacza to, że jest to praktycznie „goły” proton. C O O gęstość elektronowa Karwasz i in. 2007 H

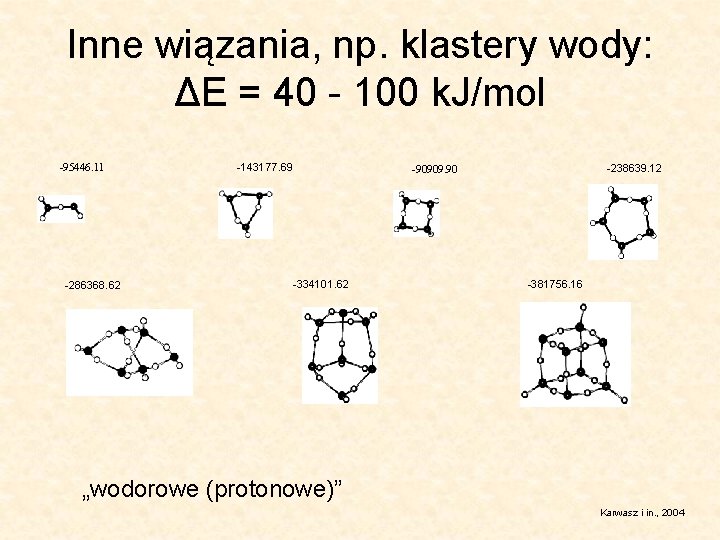
Inne wiązania, np. klastery wody: ΔE = 40 - 100 k. J/mol -95446. 11 -286368. 62 -143177. 69 -238639. 12 -90909. 90 -334101. 62 -381756. 16 „wodorowe (protonowe)” Karwasz i in. , 2004

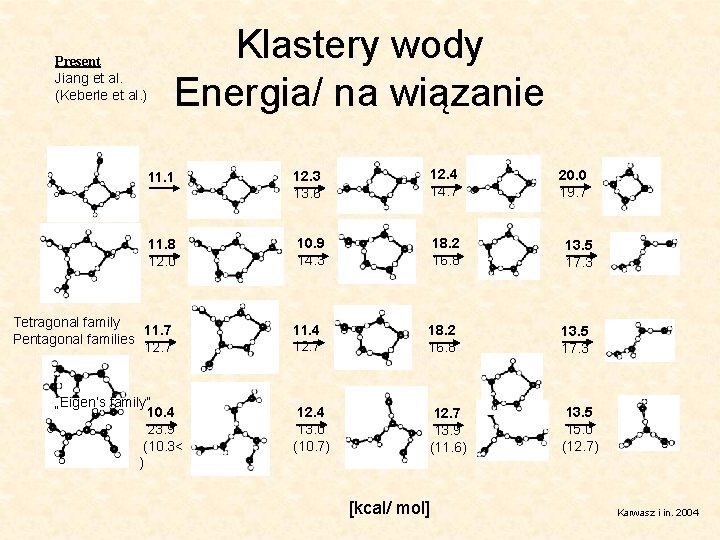
Klastery wody Energia/ na wiązanie Present Jiang et al. (Keberle et al. ) 11. 1 12. 3 13. 6 12. 4 14. 7 11. 8 12. 0 10. 9 14. 3 18. 2 16. 8 Tetragonal family 11. 7 Pentagonal families 12. 7 „Eigen’s family” 10. 4 23. 9 (10. 3< ) 20. 0 19. 7 13. 5 17. 3 11. 4 12. 7 18. 2 16. 8 13. 5 17. 3 12. 4 13. 0 (10. 7) 12. 7 13. 9 (11. 6) 13. 5 15. 0 (12. 7) [kcal/ mol] Karwasz i in. 2004
![Wiązania międzyatomowe zestawienie Typ wiązania Substancja Jonowe Energia k Jmol Energia e Vjon Temp Wiązania międzyatomowe zestawienie Typ wiązania Substancja Jonowe Energia [k. J/mol] Energia [e. V/jon Temp.](https://slidetodoc.com/presentation_image_h/a92b1e30a9fe5ac1c317a77296c2de8c/image-11.jpg)
Wiązania międzyatomowe zestawienie Typ wiązania Substancja Jonowe Energia [k. J/mol] Energia [e. V/jon Temp. atom, drobinę] topnienia [ºC] Na. Cl Mg. O 640 1000 3. 3 5. 2 801 2800 Kowalentne Si C (diament) 450 713 4. 7 7. 4 1410 >3550 Metaliczne Al W 324 849 3. 4 8. 8 660 3410 van der Waalsa Ar Cl 2 7. 7 31 0. 08 0. 32 -189 -101 Wodorowe NH 3 H 2 O 35 51 0. 36 0. 52 -78 0 Materials Science and Engineering




















