Voda VODA KAO RASTVARA POLARNOST VODE RASTVORI KONCENTRACIJE








































- Slides: 41

Voda • VODA KAO RASTVARAČ • POLARNOST VODE • RASTVORI • KONCENTRACIJE • ZADACI ZA VEŽBU

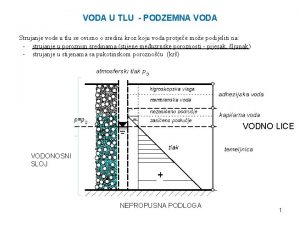
VODA KAO RASTVARAČ • Voda je najvažniji rastvarač, medijum za odigravanje hemijskih reakcija. • Veliki je deo hemijskih reakcija koje se u prirodi odigravaju u vodi kao rastvaraču. • Voda ima nekoliko značajnih svojstava koja je čine dobrim rastvaračem. Jedno od važnijih je polarnost vode. POLARNOST VODE Molekul vode je polaran. Jedan kraj molekula je delimično pozitivno naelektrisan (deo koji čine atomi vodonika), a drugi kraj je delimično negativno naelektrisan (deo koji čini atom kiseonika). Kiseonik je elektronegativniji od vodonika. Elektronegativnost daje specifičan izgled molekulu vode (oblik molekula vode prikazan je na slici levo). Polarna priroda molekula vode čini vodu značajnim rastvaračem.

VODA KAO RASTVARAČ Voda utiče na rastvorljivost jonskih jedinjenja. Šta se dešava rastvaranjem kovalentnih jedinjenja u vodi? Razlikuju se dva slučaja: 1) kovalentno jednjenje je čvrsta supstanca (na primer: šećer (saharoza), vitamin C (askorbinska kiselina), vosak, itd. 2) kovalentno jedinjenje je tečnost (na primer: metanol, benzen, ugljen-tetrahlorid, itd. )

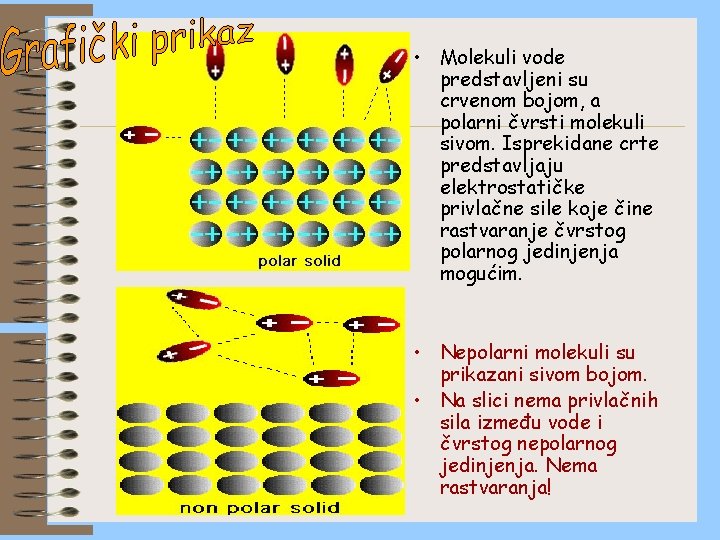
RASTVORLJIVOST ČVRSTOG KOVALENTNOG JEDINJENJA U VODI Ako su molekuli čvrstog jedinjenja polarni voda će rastvoriti ispitivano jedinjenje. Ukoliko su molekuli nepolarni voda neće moći da rastvori ispitivano jedinjenje. Ovu pretpostavku i objašnjenje lako je razumeti jer između polarnih molekula čvrste supstance i molekula vode može doći do elektrostatičke privlačne sile. Privlačna sila doprinosi rastvaranju čvrste supstance (slično kao kod rastvaranja jonskih jedinjenja). Kod nepolarnih čvrstih jedinjenja molekuli vode se međusobno privlače i “ignorišu” prisustvo čvrstog jedinjenja koje se ne rastvara u vodi.

• Molekuli vode predstavljeni su crvenom bojom, a polarni čvrsti molekuli sivom. Isprekidane crte predstavljaju elektrostatičke privlačne sile koje čine rastvaranje čvrstog polarnog jedinjenja mogućim. • Nepolarni molekuli su prikazani sivom bojom. • Na slici nema privlačnih sila između vode i čvrstog nepolarnog jedinjenja. Nema rastvaranja!

RASTVORLJIVOST TEČNOG KOVALENTNOG JEDINJENJA U VODI Ako je kovalentno jedinjenje tečnost moguće su dve varijante u kontaktu sa vodom: može doći do mešanja ili razdvajanja slojeva. Kada se dve tečnosti mešaju nazivaju se rastvorljivim, a kada se ne mešaju nazivaju se nerastvorljivim. Kada su dve tečnosti rastvorljive, odnosno nerastvorljive jedna u drugoj? Odgovor je sličan kao kod rastvaranja čvrstih jedinjenja. Polarni molekuli (metanol) biće dobro rastvorljivi u vodi. Nepolarni molekuli (ulje) neće biti rastvorljivi u vodi.

• Kod molekula polarnih tečnosti dolazi do privlačnih silarastvaraju se jedna u drugoj. • Kod molekula nepolarne tečnosti i vode nema međusobnih privlačnih sila. Molekuli vode se sami privlače, ne dolazi do rastvaranja.

“SLIČNO SE U SLIČNOM RASTVARA” Kod tečnosti se može zaključiti da se polarna tečnost u polarnoj rastvara, a nepolarna u polarnoj se ne rastvara. Sledi: nepolarne i nepolarne tečnosti dobro se rastvaraju jedna u drugoj.

Rastvorljivost jonskih jedinjenja u vodenim rastvorima Kada se so sipa u vodu dolazi do privlačenja između polarnih molekula vode i jona koji nastaju disocijacijom soli. Privlačne sile koje nastaju su elektrostatičke sile između jonova soli i vode. Ako “pobede” sile između vode i jonova so će se rastvoriti! Ako “pobede” sile između samih jonova soli neće doći do rastvaranja u vodi! Primer: kuhinjska so (Na. Cl), koja je veoma rastvorna, rastvara se u vodi potpuno:

Na atomskom nivou joni soli su solvatisani, rastvoreni molekulima vode. Molekuli vode se orijentišu pozitivnim krajem ka negativnim jonima i obratno. Kavez koji molekuli vode formiraju oko rastvorenih jona naziva se “hidratisani” kavez.

Vodeni rastvori: koncentracija Većina hemijskih reakcija odigrava se u rastvorima (rastvor = rastvorena supstanca + rastvarač). Rastvorene supstance predstavljaju reaktanti. Kako bi se stehiometrijski prikazala neka hemijska reakcija potrebno je izračunati količine reaktanata u rastvoru. Da bi se izrazila količina neke supstance u rastvoru hemičari koriste koncentracije. Koncentracijama se izražava sadržaj rastvorene supstance u određenoj količini rastvora ili rastvarača. Postoji više načina za izražavanje koncentracije: ppm (parts per million) zapremina/zapremina procenat ppb (parts per billion) molaritet masa / zapremina procenat

Koncentracija: ppm i ppb Parts per million (ppm) i parts per billion (ppb) su primeri za izražavanje koncentracije preko mase. Ove jedinice su pogodne kod tragova supstanci. Na primer, kod rastvora sa koncentracijom od 1 ppm znači da 1 g rastvora ima milioniti deo u gramu rastvorene supstance. Odnosno, 1 kg rastvora imaće 1 mg rastvorene supstance. Prema definiciji:

ZADACI 1. Uzorak jezerske vode mase 155, 3 g sadrži 1, 7 · 10 -4 g fosfata. Izračunati koncentraciju fosfata u ppm-ima. Rešenje: ppm = = 1, 1 ppm Za izračunavanje koncentracije u ppb-ima, u prethodnom primeru rezultat bi bio hiljadu puta veći, odnosno koncentracija bi bila 1100 ppb. 2. Uzorak jezerske vode mase 400 g ima koncentraciju rastvorenih nitrata 3, 5 ppm. Odrediti masu rastvorenih nitrata u uzorku jezerske vode. Rešenje: = 1, 4 mg nitrata

Koncentracija: maseni procenti % Procenti su slične jedinice ppm-ima i ppb-ima, jer se odnose na masene odnose. Prikladni su za relativno velike koncentracije rastvora. Prema definiciji: • Primer: Odrediti procentualnu koncentraciju šećera u vodi ako je 5 g šećera rastvoreno u 20 g vode. • Odrediti masu Na. Cl u 450 g 35 % rastvora.

Koncentracija: zapremina/zapremina % Kad su rastvori tečni veoma je pogodno izraziti koncentraciju premo zapreminskih procenata (v/v %). Prema definiciji v/v %: Vino sadrži 12 m. L alkohola (etanola) u 100 m. L rastvora. Odrediti zapreminske procente (v/v %) alkohola u vinu.

Koncentracija: molaritet Molaritet predstavlja najčešće korišćen način za izražavanje koncentracije u rastvoru zbog veze između molova rastvorene supstance i zapremine rastvora. Molaritet se definiše kao: Primer: Odrediti molaritet rastvora amonijum hlorida ako se 23 gamonijum hlorida (NH 4 Cl) rastvori u 145 m. L rastvora.

PRIMER Pretpostaviti da je čaši od 175 m. L 0, 55 M rastvor HCl. Koliko molova HCl je u čaši? PRIMER Pretpostaviti da iz rastvora od 0, 135 M Na. Cl treba izdvojiti 1, 2 mol Na. Cl. Odrediti zapreminu Na. Cl za 1, 2 mol Na. Cl.

Razblaživanje rastvora Veoma često u laboratoriji potrebno je koncentrovan rastvor razblažiti. Razblaživanje rastvora izvodi se na kontrolisan način kako bi koncentracija rastvora bila poznata i posle razblaživanja. Rastvorena supstanca je u koncentrovanijem rastvoru (u čaši na levoj strani). Dodatkom vode rastvor posatje razblaženiji, kao što je prikazano na slici sa desne strane. Potrebno je uočiti da se koncentracija sa razblaživanjem smanjila, ali broj molekula rastvorene supstance nije! Drugim rečima, broj molova rastvorene supstance isti je i pre i posle razblaživanja. Kako je: Mol = Molaritet x Zapremina (mol= M x V) dobija se sledeća jednačina koja povezuje molaritet i zapreminu pre i posle razblaživanja: Mi x V i = M f x V f

PRIMER Pretpostaviti da treba napraviti 150 m. L rastvora 0, 25 M Na. Cl. Na polici u laboratoriji je boca 2 M Na. Cl. Šta je potrebno uraditi. Molaritet koncentrovanog rastvora je Mi i zapremina koja je potrebna je Vi. Potrebno je odrediti Vi prema sledećoj jednačini: Treba od 2 M rastvora Na. Cl uzeti 18, 8 m. L i prebaciti u čašu i dopuniti do 150 m. L vode, što će činiti 0, 25 M rastvor Na. Cl. PRIMER Ako se od 0, 45 M rastvora Ag. NO 3 izdvoji 25 m. L i razblaži do 300 m. L koja je molarnost novog rastvora?

STEHIOMETRIJA Molaritet omogućava izračunavanje molskih odnosa između učesnika u reakciji kad se hemijska reakcija odigrava. Kao primer može se uzeti sledeća hemijska reakcija: Potrebno je odrediti masu Ca. CO 3 koja reaguje sa 25 m. L 0, 75 M HCl. Zadatak se rešava preko stehiometrijskih odnosa.

Titracije Titracija osnovna operacija u volumetriji u kojoj se rastvor (poznate koncentracije) jedne supstance (titranta), dodaje iz birete rastvoru (tačno odmerene zapremine, ali nepoznate koncentracije) druge supstance (titranda), do završetka reakcije, u cilju određivanja nepoznate koncentracije titranda. Indikator jedinjenje koje se u volumetrijskoj analizi koriste za vizuelno Određivanje završne tačke titracije na osnovu činjenice da u blizini ekvivalentne tačke dolazi do nagle i uočljive promene nekog fizičko hemijskog svojstva indikatora (najčešće boje)

Kao primer titracije može se uzeti kiselo-bazna reakcija: Na. OH(aq) + HCl(aq) ----> Na. Cl(aq) + H 2 O(l) Ako se u erlenmajeru nalazi HCl nepoznate koncentracije moguće je titracijom odrediti koncentraciju HCl. U laboratoriji se nalazi rastvor 0, 035 M Na. OH. Biretu napunimo rastvorom Na. OH i dodamo 1 kap fenolftaleina (indikatora) u rastvor HCl. Polako dodajemo iz birete Na. OH u HCl do promene boje rastvora u blago ružičastu. Dodata je količina 27, 5 m. L Na. OH. Iz podatka o utrošenoj količini Na. OH može se odrediti broj molova HCl. Napomena: fenolftalein je organsko jedinjenje koje je bezbojno u kiseloj sredini, a ružičasto u baznoj sredini.

ZADACI ZA VEŽBU 1. Napraviti 100 g 10 % rastvora natrijum-hlorida.

2. Napravljen je rastvor koji sadrži 6, 9 g šećera i 100 g vode. Izračunati procentnu koncentraciju šećera u ovom rastvoru.

3. Rastvor sadrži 50 g vode i 5, 5 g alkohola. Izračunati procentnu koncentraciju alkohola.

4. Koliko grama 5 % rastvora natrijumhidroksida treba odmeriti da ova količina rastvora sadrži 3, 2 g natrijum-hlorida ?

5. Koliko grama 30 % rastvora neke soli treba odmeriti za pravljenje 100 g 6 % rastvora ?

6. Koliko grama sulfatne kiseline treba odmeriti za pravljenje 1 dm 3 rastvora koncentracije 1 mol/dm 3?

7. Izračunati molaritet vodenog rastvora KBr ako je zapremina rastvora 5, 00 litara a broj molova KBr je 10, 0 molova?

8. Izračunati zapreminu dvomolarnog (2, 00 M) rastvora napravljenog od 6, 00 molova Li. F?

9. Izračunati zapreminu 3, 00 M rastvora Na. Cl, napravljenog rastvaranjem 526 g natrijumhlorida.

10. Koliko molova Ca. Cl 2 treba rastvoriti u 0, 500 litara petomolarnog rastvora (5 M)?

11. Koliko grama Ca. Cl 2 treba upotrebiti za pravljenje 5, 00 x 102 cm 3 petomolarnog rastvora?

12. Izračunati količinsku koncentraciju rastvora HCl, ako su na originalnom pakovanju navedeni podaci: 37, 0 mas. %, =1, 188 g/cm 3, M(HCl)=36, 45 g/mol.

13. Izračunati zapreminu 15, 0 % rastvora Fe(NO 3)3 u kojoj se nalazi 30, 0 g Fe(NO 3)3. Gustina rastvora na 25 C iznosi 1, 16 g/cm 3.

14. Komercijalna 96, 4 % sumporna kiselina ima gustinu 1, 84 g/cm 3. Izračunati koncentraciju kiseline. Podatak: M(H 2 SO 4)=98, 10 g/mol

15. Na analitičkoj vagi odmerena je masa od 5, 5450 g uzorka Ca. Cl 2 i rastvorena u destilovanoj vodi u mernom sudu od 250, 0 cm 3. Izračunati koncentraciju Ca. Cl 2 i Cl--jona u rastvoru. Podatak: M(Ca. Cl 2)=110, 0 g/mol

16. Izračunati količinsku koncentraciju rastvora koji sadrži 0, 320 g metanola, CH 3 OH u 750 cm 3 vode. Podaci: M(CH 3 OH)=32, 00 g/mol

17. Rastvor HCl se mora pripremiti. Izračunati koncentraciju rastvora HCl ako se za titraciju 0, 2168 g hemijski čistog natrijum-karbonata utroši 20, 45 cm 3 ovog rastvora. Podatak: M(Na 2 CO 3)=106, 0 g/mol

18. Prilikom pripreme rastvora HCl utvrđeno je da koncentracija iznosi 1, 183 mol/dm 3. Kolika zapremina (u cm 3) ovog rastvora treba da se uzme za pripremanje 500, 0 cm 3 rastvora HCl koncentracije 0, 100 mol/dm 3?

19. Morska voda sadrži Na+ -jone, prosečne koncentracije 1, 08 103 ppm i SO 42 - -jone prosečne koncentracije 270 ppm. Izračunati: a) koncentraciju ovih jona ako je poznata prosečna gustina morske vode, =1, 02 g/cm 3; b) p. Na i p. SO 4 za morsku vodu. Podaci: M(Na)=23, 00 g/mol; M(SO 42 -)=96, 00 g/mol
 Voda polarnost
Voda polarnost Kvapka vody kreslená
Kvapka vody kreslená Voda kao rastvarac
Voda kao rastvarac Slicno se u slicnom rastvara
Slicno se u slicnom rastvara Radni materijali za vježbanje koncentracije i pažnje
Radni materijali za vježbanje koncentracije i pažnje Uticaj koncentracije na brzinu hemijske reakcije
Uticaj koncentracije na brzinu hemijske reakcije Razlika izmedju aktivnog i pasivnog transporta
Razlika izmedju aktivnog i pasivnog transporta Hitinski omotac
Hitinski omotac Voda kao sredstvo za gašenje požara
Voda kao sredstvo za gašenje požara Hidrofobni koloidi
Hidrofobni koloidi Rastvorljivost zadaci
Rastvorljivost zadaci Kristaloidni rastvori
Kristaloidni rastvori Elektrofilni reagensi
Elektrofilni reagensi Ledište morske vode
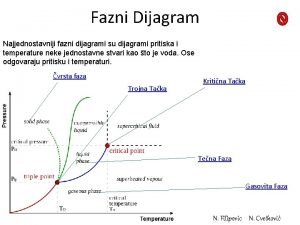
Ledište morske vode Fazni dijagram
Fazni dijagram Hustota parafinu
Hustota parafinu Izvore vode žive tekst
Izvore vode žive tekst Hipotermalne vode
Hipotermalne vode Fizicke osobine vode
Fizicke osobine vode Visoke i niske vode
Visoke i niske vode Ptica selica zivi u vodi i pored vode
Ptica selica zivi u vodi i pored vode Vode na kopnu prezentacija
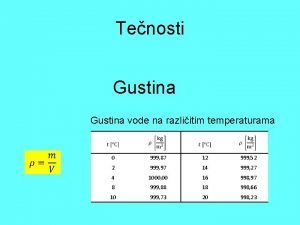
Vode na kopnu prezentacija Gustina vode
Gustina vode Dipolarnost vode
Dipolarnost vode Obalno more znacenje
Obalno more znacenje Mie vode moll
Mie vode moll Svjetski dan voda pano
Svjetski dan voda pano živočíchy vodného spoločenstva žijúce vo vode
živočíchy vodného spoločenstva žijúce vo vode Formula za brzinu
Formula za brzinu Opiši kruženje vode u prirodi
Opiši kruženje vode u prirodi Celinske vode
Celinske vode Vplyv hmotnosti na správanie telies vo vode
Vplyv hmotnosti na správanie telies vo vode Energija vode prezentacija
Energija vode prezentacija Katarobne vode
Katarobne vode Koje su vode tekućice
Koje su vode tekućice Rozpustnosť látok vo vode
Rozpustnosť látok vo vode Hajducke vode skijanje
Hajducke vode skijanje Fizicke osobine vode
Fizicke osobine vode Dinamika mora
Dinamika mora Najmenšia žaba na slovensku
Najmenšia žaba na slovensku Benzil acetilena
Benzil acetilena Koja je gustina vode
Koja je gustina vode