IONIZACIJA VODE I IONSKI PRODUKT VODE NATAA VUKOVI























- Slides: 26

IONIZACIJA VODE I IONSKI PRODUKT VODE NATAŠA VUKOVIĆ. MAG. MED. BIOCH. , PROF SAVJETNICA RAZRED; 2 RAZRED PREDMET; FIZIKALNA KEMIJA SMJER; ZDRAVSTVENO-LABORATORIJSKI TEHNIČAR/KA

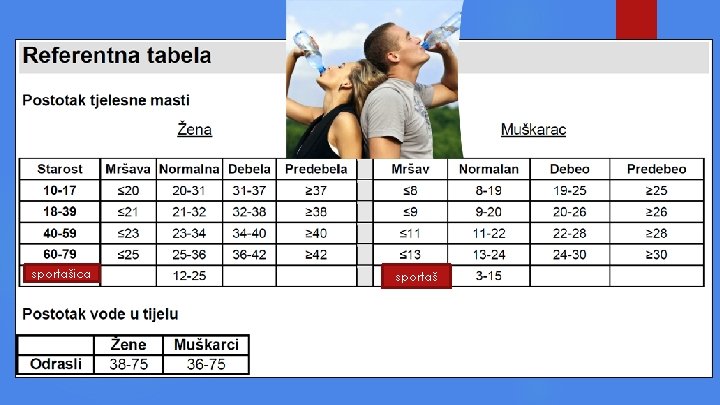
Znate li? Ljudsko tijelo sastoji se od oko 70% vode, ( 90% krvi i 85% mozga je voda, kosti sadrže 30% vode), ovisno o mjestu življenja, indeksu tjelesne težine, starosti i spolu. Tijelo gubi VODU mokraćom, fekalijama, disanjem i znojenjem, što u normalnim uvjetima iznosi do 2, 5 litre dnevno.

sportašica sportaš

Sjetimo se pojma ionizacije? ? IONIZACIJA VODE Kako nastaju ioni u kemijski čistoj vodi? voda ionizira na oksonijev ion, H 3 O+ i hidroksidni ion OHzbog polarnosti molekule vode ioniziraju: 2 H 2 O → H 3 O+ + OHili H 2 O → H+ + OH- Kada su istovrsne molekule u reakciji i proton-donori i proton -akceptori takve reakcije nazivamo autoprotoliza

Sjetimo se. . . o Koliko iznosi p. H – vrijednost za neutralne otopine, kisele odnosno lužnate otopine? o Što je p. H? o Što je p. OH? o Gdje smo spominjali i koristili indikatore? Sjeti se Uvoda u laboratorijski rad

Naučit ćemo. . . o Objasniti ravnotežnu konstantu ionizacije vode Kw, Ka, Kb o Kako se izračunava ravnotežna konstanta ionizacije vode o Izračunavati p. OH i p. H vrijednost vodene otopine o Što su indikatori i koja je važnost indikatora o Odabrati indikatore za kiseline i lužine o Objasniti važnost p. H-vrijednosti vodenih otopina u svakodnevnom životu

KONSTANTA RAVNOTEŽE IONIZACIJE VODE koncentracija vode zbog slabe ionizacije ostaje nepromijenjena i računa se prema formuli koncentracija vode iznosi 55, 4 mol/dm -3

IONSKI PRODUKT VODE Iz jednadžbe za konstantu ravnoteže dobije se: dok je pri nižim temperaturama manja, a pri višim temperaturama veća Vrijednost ravnotežne konstante ionizacije vode je eksperimentalno određena i pri 25 °C iznosi: Kw=1, 00× 10− 14 mol 2 dm− 6 Koncentracije oksonijevih i hidroksidnih iona u čistoj vodi su jednake i pri 25 °C iznose 1, 00× 10− 7 moldm− 3.

Iz ionskog produkta vode slijedi izraz za množinsku koncentraciju vodikovih iona, a također i za koncentraciju hidroksid-iona U neutralnoj otopini: U kiseloj otopini: U lužnatoj otopini:

p. H-vrijednost se definira kao negativni logaritam brojčane vrijednosti množinske koncentracije oksonijevih iona. p. OH-vrijednost se definira kao negativni logaritam brojčane vrijednosti množinske koncentracije hidroksidnih iona. koncentracija iona H+ služi u kemiji kao mjera za kiselost odnosno bazičnost otopina Danski kemičar P. L. Sorensen uveo je pojam p. H-vrijednost kiselost i lužnatost otopina možemo izraziti pomoću bezdimenzionalnih veličina: p. H-vrijednost ili p. OH-vrijednost

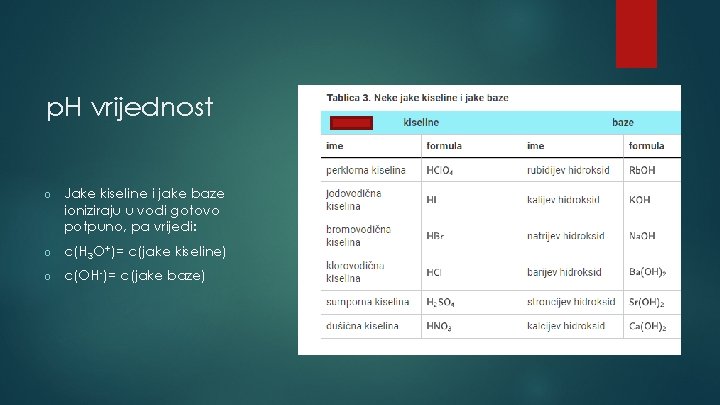
p. H vrijednost o Jake kiseline i jake baze ioniziraju u vodi gotovo potpuno, pa vrijedi: o c(H 3 O+)= c(jake kiseline) o c(OH-)= c(jake baze)


p. H i p. OH vrijednosti Za vodene otopine pri 25°C vrijedi: p. H + p. OH = 14 Odnos množinskih koncentracija: c(H 3 O+) i c(OH−) kisele otopine neutralne otopine bazične otopine c(H 3 O+)>c(OH−) c(H 3 O+)=c(OH−) c(H 3 O+)<c(OH−)

p. H i p. OH vrijednosti o Za precizno mjerenje p. H-vrijednosti otopina koristi se p. H-metar o Sastoji se od specijalne sonde za mjerenje spojene na elektronski metar koji mjeri I prikazuje izmjerenu p. H vrijednost Video link o indikatorima https: //www. youtube. com/watch? v=x. YQlv. Tblg. CY

INDIKATORI Je li otopina kisela, neutralna ili bazična, može se odrediti osim p. H-metrom i pomoću indikatora. p. H indikatori su kemijski spojevi koji dodani u malim količinama služe za vizualno određivanje p. H vrijednosti. Slika: a)kiseline; b)lužine

Indikatori u metodama neutralizacije o Metilnarančasto je natrijeva sol heliantina. Ima azo-skupinu I kinoidnu skupinu. U prijelaznom obliku narančaste je boje (p. H 3, 1 do 4, 4) o Metilno crvenilo ima kiseli oblik crvene boje I bazični oblik žute boje. Prijelazni oblik je narančaste boje (p. H 4, 2 do 6, 3) o Fenolftalein je slaba organska baza kiselina. Kiseli oblik je bezbojan I javlja se u kiseloj sredini, a bazični oblik je crvenoljubičast I javlja se u bazičnoj sredini. U području između p. H 8, 2 do 10 boja se postupno mijenja od slabo ružičaste do crvenoljubičaste.

Zanemarivanje pogrešaka kod indikatora o Indikatori mogu uzrokovati pogreške o Pogreške se mogu zanemariti tako da se: A) rabi što manja količina indikatora ( jedna kap do dvije) B) pri titraciji analita troši približno jednak volumen titracijske otopine (titrant) C) rabi isti indikator za standardizaciju otopine naknadnim određivanjima D) titrira uvijek do prve promjene boje indikatora

Određivanje p. H urina o Sjetimo se prvog razreda o Centrifugirali smo i zatim određivali p. H urina o Sjeti se kako smo to radili ? Za one kojim žele znati više… 1. Istraži koja je vrijednost p. H urina zdrave osobe? 2. Kada kod pacijenta imamo alkalan p. H ? (fiziološki , patološki) 3. Kada kod pacijenta imamo kiseli p. H urina? (fiziološki , patološki)

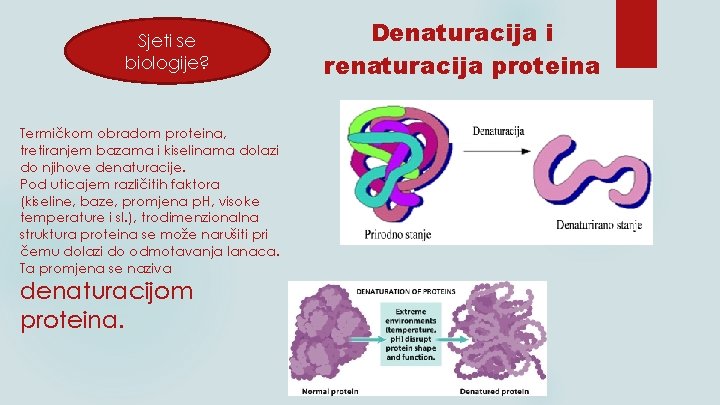
Sjeti se biologije? Termičkom obradom proteina, tretiranjem bazama i kiselinama dolazi do njihove denaturacije. Pod uticajem različitih faktora (kiseline, baze, promjena p. H, visoke temperature i sl. ), trodimenzionalna struktura proteina se može narušiti pri čemu dolazi do odmotavanja lanaca. Ta promjena se naziva denaturacijom proteina. Denaturacija i renaturacija proteina

Izračunaj i ponovi Zadatak 1. Izračunaj p. H-vrijednost otopine u kojoj je koncentracija vodikovih iona 10 -2. Zadatak 2. Kolika je c. OH- u otopini kojoj je p. H=3? Je li otopina kisela ili lužnata? Zadatak 3. Kolika je koncentracija vodikovih iona, ako p. H iznosi 4, 70?

za razliku od jakih elektrolita skoro potpuno disociraju, slabi elektroliti u vodenim otopinama ioniziraju nepotpuno pa je zato važno poznavati konstantu ionizacije elektrolita do izraza za konstantu ionizacije slabih kiselina i baza dolazimo temeljem zakona ravnoteže: ZA LUŽINE ZA KISELINE

budući da su Kk i Kb koncentracijske konstante vrijedi da je: Kk • Kb=Kw umjesto konstanom ionizacije, može se ionizacija elektrolita izraziti i stupnjem ionizacije koji se označava sa α odnos broja ioniziranih molekula i ukupnog broja molekula elektrolita prisutnih u otopini α → stupanj ionizacije kiseline odnosno baze OSTWALDOW ZAKON c → početna koncentracija kiseline odnosno -vrijedi za razrijeđene lužine otopine slabih elektrolita KC=C • α 2

Zadatak 4. Ako je koncentracija vodene otopine Na. OH 0, 0001 mol dm -3, izračunaj p. H vrijednost otopine. Zadatak 5. Amonijev hidroksid u otopini koncentracije c=0, 01 moldm -3 disocijscijom stvara toliko svojih iona, da im je koncentracija 4 • 10 -4 moldm-3. Izračunaj koncentraciju nedisociranog NH 4 OH.

7. Izračunaj p. H-vrijednost otopine dušične kiseline množinske koncentracije 1, 50 x 10 -5 mol dm-3. 8. Po čemu se razlikuju dvije otopine koje imaju p. H=8 I p. H=10? 9. Izračunaj koncentraciju hidroksidnih I oksonijevih iona u vodenoj otopini Na. OH, ako je poznato c= 0, 2000 mol dm-3 Domaća zadaća

Ponovimo! o Indikatori su tvari koje mijenjaju boju ovisno o p. H otopine o p. H je negativni logaritam brojčane vrijednosti oksonijevih iona. o p. OH je negativni logaritam brojčane vrijednosti hidroksidnih iona. o Konstanta ravnoteže ionizacije vode iznosi Kw=10 -14 mol 2 dm-6 o p. OH + p. H = 14

Literatura Ksenija Duhović, Mirjana Lončar; FIZIKALNA KEMIJA I INSTRUMENTALNE METODE, za 2. i 3 razred Zdravstvenolaboratorijskih tehničara/ka Mara Banović; Analitička kemija za zdravstvene škole http: //hr. n 1 info. com/a 118376/Lifestyle/Jeste-li-znali-kolikoje-voda-vazna-za-ljudski-organizam. html http: //www. hpd-plocno. com/index. php/zdravlje-i-bolesti/45 -voda -u-tijelu-dehidracija http: //www. enciklopedija. hr/natuknica. aspx? ID=27314 http: //eskola. chem. pmf. hr/udzbenik/web_Sikirica/index. htm https: //www. tehnologijahrane. com/enciklopedija/peptidi-proteini
 Stupanj ionizacije formula
Stupanj ionizacije formula Marija vukovi
Marija vukovi Ioni 8 razred
Ioni 8 razred Produktlebenszyklus 5 phasen
Produktlebenszyklus 5 phasen Przyłączanie wody do alkenów
Przyłączanie wody do alkenów Handelsmærke
Handelsmærke Rechenausdruck produkt
Rechenausdruck produkt Produkt
Produkt Produkt och marknadsmatris
Produkt och marknadsmatris Produkt kalkyle
Produkt kalkyle Produkt cestovního ruchu
Produkt cestovního ruchu Produkt turystyczny prosty
Produkt turystyczny prosty Arbetssystem
Arbetssystem Kaj je enočlenik
Kaj je enočlenik Produkt
Produkt Dobra zaopatrzeniowe
Dobra zaopatrzeniowe Koncepce totálního výrobku
Koncepce totálního výrobku Marketing mix definicja
Marketing mix definicja Krańcowy produkt pracy wzór
Krańcowy produkt pracy wzór Marketing mix promocja
Marketing mix promocja Raluca pana
Raluca pana Punktbiseriale korrelation interpretation
Punktbiseriale korrelation interpretation Marknadspositionering
Marknadspositionering Skalarni produkt vektorjev
Skalarni produkt vektorjev Průměrný produkt práce
Průměrný produkt práce Produkt wulkanizacji kauczuku
Produkt wulkanizacji kauczuku Relacijska algebra
Relacijska algebra