Unidad Estructura Atmica Profesora Ms C Teresa Corvaln

































![Configuraciones electrónicas. 11 Na 17 Cl [Ne] __ Na+ [Ne] __ __ Cl- [Ne] Configuraciones electrónicas. 11 Na 17 Cl [Ne] __ Na+ [Ne] __ __ Cl- [Ne]](https://slidetodoc.com/presentation_image_h/c44c150e04890e758473f8a7a9d3325a/image-39.jpg)





- Slides: 46

Unidad. Estructura Atómica. Profesora: Ms. C. Teresa Corvalán G.

Algunas motivaciones inquietaron a los filósofos griegos Leucipo y Demócrito, quienes iniciaron investigaciones acerca de la constitución de la materia. En el siglo V a. C. . . . El átomo es la unidad más elemental de la materia. . . . Según Demócrito, el átomo era la última unidad, después de la división física. Después de este gran descubrimiento, ocurrió un aparente estancamiento de las investigaciones acerca de la estructura de la materia, hasta que en el siglo XIX, se iniciaron las primeras teorías Atómicas. . . .

Algunas teorías atómicas. Teoría atómica de Dalton: (1809). Razonamiento: Por lo tanto 1. La materia está formada por átomos 2. La materia tiene masa Los átomos tienen masa. Conclusión: Lo que diferencia a un átomo de otro no es la forma sino la masa. Postulados. • Un elemento está compuesto de partículas pequeñas e indivisibles llamadas átomos. • Todos los átomos de un elemento dado, tienen propiedades idénticas, las cuales difieren de las de átomos de otros elementos.

• Los átomos de un elemento no pueden crearse, destruirse o transformarse en átomos de otros elementos. • Los compuestos se forman cuando átomos de elementos diferentes se combinan entre sí en una proporción fija. • Los números relativos y tipos de átomos son constantes en un compuesto dado. Por otro lado. . . . Faraday y Stoney, a comienzos de la década del 1800 investigaron las fuerzas eléctricas en algunas sustancias y concluyeron que su comportamiento frente a la corriente eléctrica, hacia pensar en una relación cuantitativa entre la cantidad de electricidad empleada y la cantidad de reacción química que se produce. O sea, las unidades de carga eléctrica están asociadas con los átomos (1891): Faraday las llamó electrones.

ya se conocía a inicios de 1900 que: 1. Los átomos contienen electrones y son eléctricamente neutros. …para que un átomo sea neutro debe contener el mismo numero de cargas positivas y negativas. Modelo de Thomson: Propuso que un átomo podía visualizarse como una esfera uniforme cargada positivamente, dentro de la cual se encuentran los electrones como si fuera un “pastel de pasas”. - - - La carga positiva esta distribuida de manera uniforme, dentro de la esfera se encuentran los electrones. - Determinó la relación entre la carga (e-) y la masa (m) de los electrones. e/m = 1. 7588 x 108 couloms por gramo. Los electrones son partículas presentes en todos los átomos, y todos los átomos contienen un número integral de electrones.

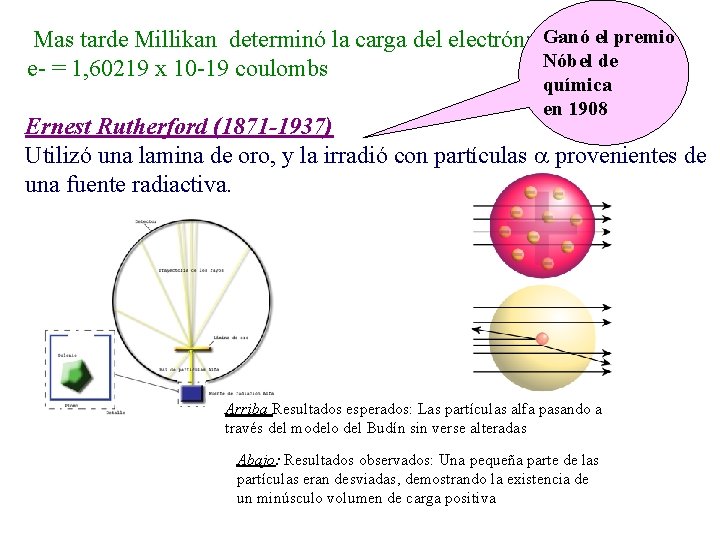
Mas tarde Millikan determinó la carga del electrón: Ganó el premio Nóbel de e- = 1, 60219 x 10 -19 coulombs química en 1908 Ernest Rutherford (1871 -1937) Utilizó una lamina de oro, y la irradió con partículas provenientes de una fuente radiactiva. Arriba Resultados esperados: Las partículas alfa pasando a través del modelo del Budín sin verse alteradas Abajo: Resultados observados: Una pequeña parte de las partículas eran desviadas, demostrando la existencia de un minúsculo volumen de carga positiva

Rutherford explica los resultados del experimento con un nuevo modelo atómico: La mayor parte de los átomos debe estar vacía, por eso la mayoría de las partículas no sufrieron desviación al pasar por la lamina de oro, no obstante las cargas positivas están concentradas en el centro al que llamó núcleo atómico. Las partículas del núcleo tienen carga positiva y reciben el nombre de protones.

El neutrón: El modelo de Rutherford deja un importante problema sin resolver: Se sabia que el Hidrogeno, contenía 1 protón y que el átomo de He contenía 2, por lo tanto la relación en masa, para ellos debería ser 2: 1, (hay que recordar que los electrones son más ligeros y su contribución a la masa es despreciable) Sin embargo la relación es 4: 1 El físico Ingles James Chadwick, probó la existencia de un tercer tipo de partículas, con una masa superior a los protones llamadas neutrones. Partícula Electrón Protón Neutrón Masa 9. 10939 x 10 -28 1. 67262 x 10 -24 1. 67493 x 10 -24 Coulombs Carga unitaria -1. 6022 x 10 -19 -1 +1. 6022 x 10 -19 +1 0 0

En la actualidad Las investigaciones anteriores, nos hacen concluir que el átomo posee una estructura interna, formada por varias partículas, las cuales se ubican en dos regiones claramente definidas. El núcleo y la corteza. Es la zona central donde se núcleo encuentra reunida la mayor Átomo de deuterio parte de la masa del átomo. 2 H e 1 n p corteza Es la zona que rodea al núcleo y representa la mayor parte del volumen del átomo.

Núcleo atómico Cada núcleo contiene un número integral de protones que es exactamente igual al número de electrones, en un átomo neutro del elemento. Ej: Cada átomo de He contiene 2 protones H “ 1 protón. El número de protones en el núcleo atómico, determina su identidad, Este número recibe el nombre de Número atómico, de dicho elemento. Protón: Se encuentran en el núcleo atómico y poseen carga eléctrica positiva. Neutrón: descubierto en 1932, Es una partícula presente en el núcleo, sin carga y con masa ligeramente superior a la del protón. El número de neutrones que posee un núcleo es igual o superior al número de protones.

Número de masa: Es la suma del número de protones y de neutrones en el núcleo. N. de masa = Número de protones + Número de neutrones = Número atómico + Número de neutrones Los números de masas siempre son enteros. Ej: para átomos de H es 1. Electrones: Se encuentran en la corteza atómica, poseen carga eléctrica negativa y su masa es aproximadamente dos mil veces la de los protones. Los electrones giran entorno al núcleo, según diferentes órbitas definidas a grandes velocidades, por lo que es difícil determinar simultáneamente su trayectoria y posición.

La materia es eléctricamente neutra, debido a que los átomos que la conforman, tienen el mismo número de partículas positivas (protones) que de partículas negativas (electrones). Con todos los antecedentes anteriores llegamos a la conclusión de que. . . Todas las cosas que nos rodean están compuestas básicamente por protones, electrones y neutrones dispuestos dentro de los átomos.

Pesos atómicos: Miles de experimentos sobre la composición de los compuestos han dado como resultado una escala de pesos atómicos relativos que se basa en la Unidad de masas atómicas UMA, la cual se define Como 1/12 de la masa de un átomo de carbono 12. Ej de pesos atómicos. (H) 1, 00794 uma; (Na) 22, 989768 uma. Peso Molecular: Es la suma de los pesos atómicos de los elementos que conforman la molécula. Multiplicados cada uno por el número de veces en que está presente el elemento. Ej: Calculemos el P. M. de Na. OH 1 x Na = 1 x 23. 00 uma = 23. 00 uma de Na 1 x H = 1 x 1. 01 uma = 1. 01 uma de H 1 x O = 1 x 16. 00 uma = 16. 00 uma de O = 40. 01 uma

Número de Avogadro. (27 de agosto ) La cantidad más pequeña que se puede medir de manera confiable contiene un número considerable de átomos. Por lo tanto en cualquie situación real, hay que manejar cantidades muy grandes de átomos, por lo que se hace necesario ocupar una unidad para describir esta cantidad. El mol, es la unidad correspondiente al S. I. y empleada universalmente. Y se define como: La cantidad de sustancia que contiene tantas entidades (átomos, moléculas o partículas) como el número de átomos en 0, 012 kg de carbono-12 puro. Este valor es 6, 022045 x 1023 partículas Este número se llama número de Avogadro, en honor de Amadeo Avogadro, (1776 -1856).

Ej: ¿Cuántos moles de átomos contienen 245, 2 g de Niquel metálico? Solución. El peso atómico del Ni es 58, 69 uma, por lo que 1 mol de átomos de Ni pesa 58, 69 g. X mol de átomos de Ni = 245, 2 g Ni x 1 mol de átomos Ni 58, 69 g de Ni = 4, 178 mol de átomos Ni ¿Cuántos átomos hay en 4, 178 moles de átomos de Ni? Solución. Un mol de átomos de Ni contiene 6, 02 x 1023 átomos. X átomos de Ni = 4, 178 mol Ni x 6, 02 x 1023 átomos Ni = 2, 516 x 1024 átomos Ni 1 mol de átomos de Ni.

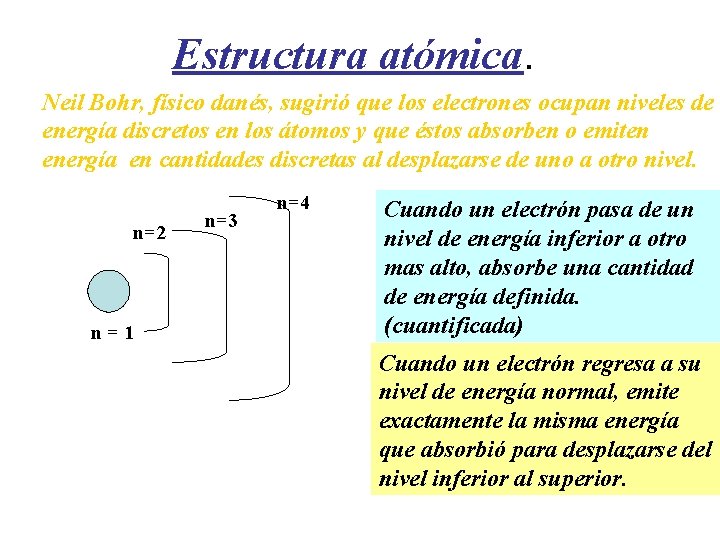
Estructura atómica. Neil Bohr, físico danés, sugirió que los electrones ocupan niveles de energía discretos en los átomos y que éstos absorben o emiten energía en cantidades discretas al desplazarse de uno a otro nivel. n=2 n=1 n=3 n=4 Cuando un electrón pasa de un nivel de energía inferior a otro mas alto, absorbe una cantidad de energía definida. (cuantificada) Cuando un electrón regresa a su nivel de energía normal, emite exactamente la misma energía que absorbió para desplazarse del nivel inferior al superior.

Bohr, también supuso que los electrones giran en torno al núcleo de un átomo en órbitas circulares, como los planetas en torno al sol. Este modelo fue modificado por Sommerfield, quien propuso la existencia de orbitas elípticas, no circulares. ¿Cómo están ordenados los electrones en el átomo? ¿Cómo se comportan los electrones? Para tener respuesta de estas interrogantes, debemos acudir a la teoría atómica moderna.

La mecánica Cuántica. Los objetos de gran tamaño como pelotas de golf y automóviles en movimiento obedecen las leyes de la mecánica clásica. (leyes de Newton). La mecánica Cuántica describe el comportamiento de partículas muy pequeñas como electrones, átomos y moléculas, con mayor precisión basándose en las propiedades ondulatorias de la materia. Uno de los principios fundamentales de la mecánica cuántica es la imposibilidad de determinar con exactitud la trayectoria que siguen los electrones al desplazarse en torno a un núcleo atómico. Heinsenberg, 1927. Enunció el principio de incertidumbre. Es imposible determinar con exactitud el momento y la posición de un electrón de manera simultanea.

Momento: mv m: masa v: velocidad O sea: es imposible determinar de manera simultanea la posición y la velocidad de un electrón, por lo que se habla de la probabilidad de encontrar un electrón en determinadas regiones del espacio. Este concepto permite enunciar los postulados fundamentales de la mecánica cuántica. 1 - Los átomos y las moléculas solo pueden existir en determinados estados de energía. En cada estado de energía, el átomo o la molécula tienen energías definidas. Cuando el átomo o la molécula cambia de estado de energía, debe emitir o absorber suficiente energía para llegar al nuevo estado de energía.

2 - Los átomos o moléculas emiten o absorben radiación (luz) cuando sus energías cambian. La frecuencia de luz que emiten o absorben se encuentra relacionada con el cambio de energía mediante la ecuación. E = hv ó E = hc/ La energía que un átomo pierde (o gana) al pasar de un estado de energía superior a otro inferior (o de uno inferior a otro superior), es igual a la energía del fotón que se emite (o absorbe) durante la transición. 3 - Los estados de energía permitidos para los átomos y moléculas pueden describirse mediante conjuntos de números conocidos como números cuánticos.

La ecuación de Schrödinger. En 1926 Erwin Schrödinger modificó una ecuación ya existente que describía a una onda tridimensional sin movimiento. Esta ecuación le permitió calcular los niveles de energía del átomo de Hidrógeno. 2 / x 2 + 2 / y 2 + 2 / z 2 + 8 2 m/h 2 (E-V) = 0 Cada solución de la ecuación está dada por 4 números cuánticos. 1. Número cuántico principal, n: describe el nivel de energía principal que ocupa el electrón. Puede ser cualquier numero entero positivo. n = 1, 2, 3, . . . .

2. El número cuántico subsidiario o azimutal, l: Indica la forma de la región del espacio que ocupa el electrón, dentro de cada nivel de Energía (definido por n). l = 0, 1, 2, . . . . , (n - 1) O sea, l indica el subnivel o tipo de orbital atómico que el electrón puede ocupar. orbital atómico: Es la región espacial en la que hay mayor probabilidad de encontrar un electrón. Según la siguiente notación, cada letra corresponde a un tipo distinto de orbital atómico. l = 0, 1, 2, 3, . . . . (n - 1) s p d f tipo de subnivel

Para el primer nivel de energía. n=1 el valor máximo de l=0, lo que indica que existe un solo Subnivel s, y ninguno p. Para el segundo nivel de energía. n=2 los valores permisibles de l son 0 y 1, lo que indica que solo hay subniveles s, y p.

3. Número cuántico magnético, ml: Indica la orientación espacial del orbital atómico. En cada subnivel, ml puede tomar valores desde -l hasta +l , incluyendo el 0. ml = (-l), . . . , 0. . . , (+l) Cuando l = 1, indica que en el subnivel p hay 3 valores permisibles de ml: -1, 0, +1, por lo tanto, hay 3 regiones distintas en el espacio llamados orbitales, asociados con un nivel p. Estos son px py y pz.

4. El número cuántico de giro, ms, se refiere al giro del electrón y a la orientación del campo magnético que éste produce. ms = 1/2 Los valores de n, l y ml, describen un orbital atómico determinado Cada orbital atómico, sólo puede acomodar a dos electrones: Uno con ms = +1/2 Y otro con ms = -1/2. Principio de exclusión de Pauli: Ningún par de electrones de cualquier átomo puede tener los 4 números cuánticos iguales.

Valores permisibles de los números cuanticos hasta n = 4. n l ml ms Capacidad electrónica del subnivel Capacidad electrónica del nivel de energía 1 (K) 0 (1 s) 0 +1/2, -1/2 2 (L) 0 (2 s) 1 (2 p) 0 -1, 0, +1 +1/2, -1/2 ½ para cada valor de ml 2 6 8 +1/2, -1/2 ½ para cada valor de ml 2 6 10 18 3 (M) 0 (3 s) 1 (3 p) 2 (3 d) 0 -1, 0, +1 -2, -1, 0, +1, +2 4 (N) 0 0 (4 s) -1, 0, +1 1 (4 p) -2, -1, 0, +1, +2 2 (4 d) 3 (4 f) -3, -2, -1, 0, +1, +2, +3 +1/2, -1/2 ½ para cada valor de ml 2 6 10 14 32

Descripción del átomo según la mecánica cuántica. Orbitales atómicos: Como hemos visto anteriormente, el número cuántico principal n toma valores de n = 1, 2, 3 , 4, . . . El valor de n = 1, describe al nivel de energía inferior o primer nivel. Estos niveles también son considerados como capas electrónicas y se designan como: capas K, L, M, N. . . . n = 1, 2, 3 , 4, . . . Capa = K, L, M, N, . . Los niveles de energía sucesivos se encuentran a distancias cada vez mayores del núcleo, La capacidad electrónica de cada nivel de energía es 2 n 2.

Orbitales s. Cada nivel de energía, tiene un subnivel s definido como l = 0, que consta de un orbital atómico s, definido por ml = 0. Los orbitales s tienen simetría esférica, con respecto al núcleo. 1 s 2 s 3 s De la ecuación de Schröedinger sale la densidad de probabilidad de encontrar el electrón en algún sitio del volumen del orbital.

Orbitales p. Después del segundo nivel de Energía, cada nivel contiene un subnivel p definido por l =1. Cada uno de estos subniveles consta de un conjunto de 3 orbitales atómicos p, que corresponden a los 3 valores permitidos de ml = (-1, 0 y +1). Hablamos de 2 px, o 3 py o 4 pz El número adelante significa el nivel de energía al cual pertenecen. Y el subíndice x, y, o z, indica la coordenada carteciana en donde está orientado el eje de dicho orbital.

Orbitales d: Después del 3 nivel de energía, cada nivel contiene un tercer subnivel ( l = 2), compuesto por un conjunto de orbitales atómicos d. Para ( l = 2) corresponden 5 valores permitidos (ml = -2, -1, 0, +1, +2) Se habla de 3 dz 2, ó, 4 dxy El número 3 y 4, indica El nivel de energía en donde está dicho orbital Y los subíndices, la disposición del orbital, en los ejes cartesianos.

Como ms tiene dos valores posibles, +1/2 y – 1/2, cada orbital atómico tiene capacidad para 2 electrones. Los electrones tiene carga negativa y se comportan como si girasen en torno a ejes que los atraviesan por el centro, de manera que actúan como pequeños imanes. El movimiento de los electrones produce campos magnéticos y éstos interactúan entre sí. Dos electrones en el mismo orbital, tienen valores opuestos de ms, se consideran como giro-apareados o apareados.

Configuración Electrónica. Es el ordenamiento de los electrones para cada átomo, teniendo en cuenta que éste átomo está aislado y en su estado basal (estado inferior de energía o no-excitado). Se considerarán los elementos por orden de aumento de número atómico, usando como guía la tabla periódica. Los orbitales atómicos se indicarán como __, los electrones desapareados como ___ y los electrones apareados como ___ Para construir las configuraciones electrónicas se recurre al Principio de Aufbau. El electrón que distingue a un elemento del elemento que lo antecede (que tiene número atómico inferior) entra al orbital atómico de menor energía disponible.

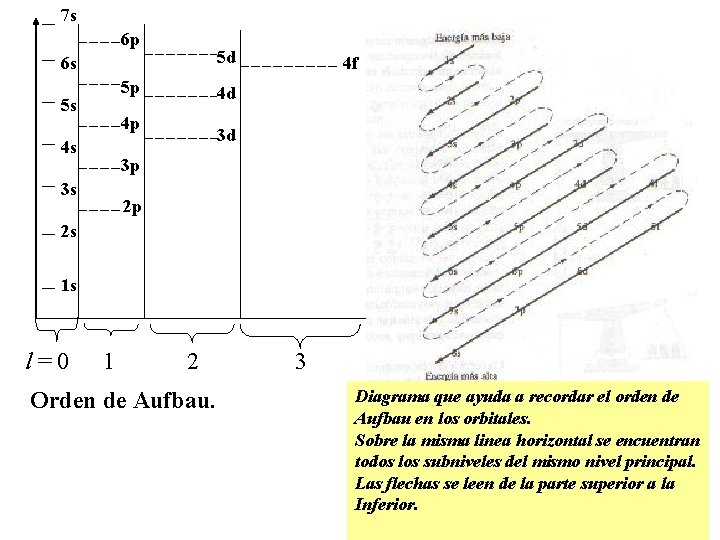
7 s 6 p 5 d 6 s 5 p 5 s 4 d 4 p 4 s 4 f 3 d 3 p 3 s 2 p 2 s 1 s l=0 1 2 Orden de Aufbau. 3 Diagrama que ayuda a recordar el orden de Aufbau en los orbitales. Sobre la misma linea horizontal se encuentran todos los subniveles del mismo nivel principal. Las flechas se leen de la parte superior a la Inferior.

Los orbitales aumentan su energía al elevarse el valor del número cuántico n. Para el mismo valor de n la energía aumenta al elevarse el valor de l, o sea, el subnivel s tiene menor energía que el p le sigue el d y después el f y así sucesivamente. Ej: Configuración electrónica para el H y el He. Hidrógeno : tiene un electrón. 1 H __ 1 s 1 Helio : tiene 2 electrones. 1 s 2 (este átomo es tan estable, que se sabe que no 2 He __ participa en ninguna reacción química, forma parte de los llamados gases nobles. HASTA AQUÏ

Enlaces.

Estructuras de Lewis. El enlace químico suele efectuarse únicamente con los electrones más externos de los átomos, (electrones de valencia). Las estructuras de Lewis son una manera de representar estos electrones de valencia, cuando estos están en orbitales s y p, mediante esta representación, también se indican los electrones apareados o desapareados.

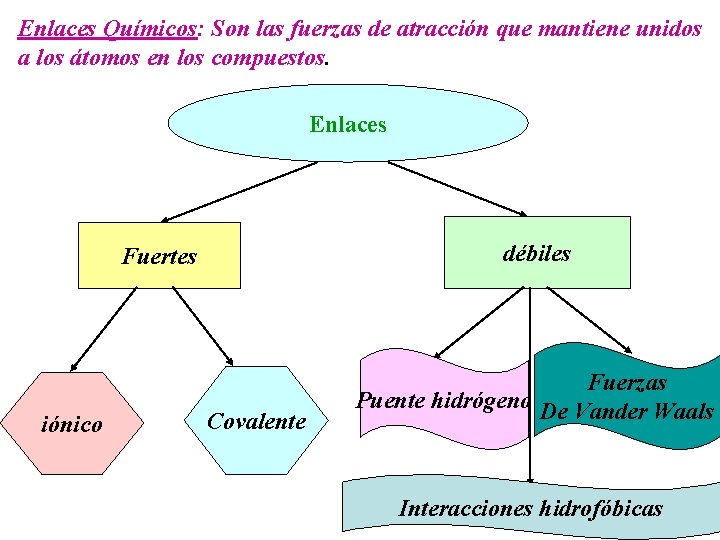
Enlaces Químicos: Son las fuerzas de atracción que mantiene unidos a los átomos en los compuestos. Enlaces débiles Fuertes iónico Covalente Fuerzas Puente hidrógeno De Vander Waals Interacciones hidrofóbicas

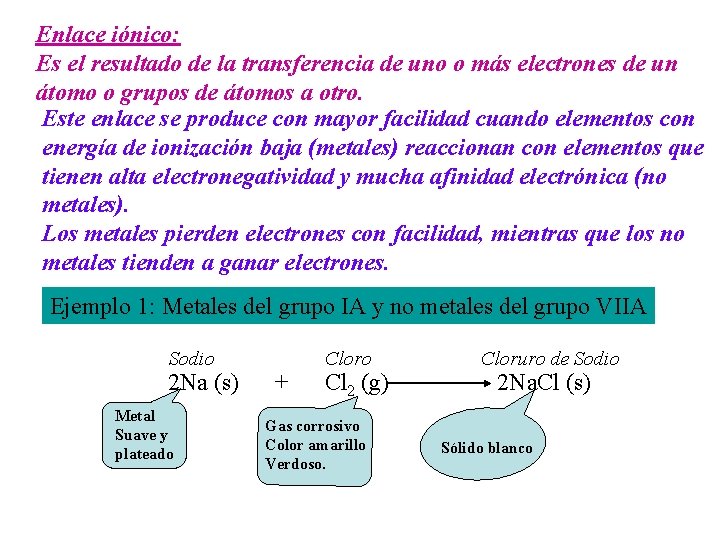
Enlace iónico: Es el resultado de la transferencia de uno o más electrones de un átomo o grupos de átomos a otro. Este enlace se produce con mayor facilidad cuando elementos con energía de ionización baja (metales) reaccionan con elementos que tienen alta electronegatividad y mucha afinidad electrónica (no metales). Los metales pierden electrones con facilidad, mientras que los no metales tienden a ganar electrones. Ejemplo 1: Metales del grupo IA y no metales del grupo VIIA Sodio 2 Na (s) Metal Suave y plateado + Cloro Cl 2 (g) Gas corrosivo Color amarillo Verdoso. Cloruro de Sodio 2 Na. Cl (s) Sólido blanco
![Configuraciones electrónicas 11 Na 17 Cl Ne Na Ne Cl Ne Configuraciones electrónicas. 11 Na 17 Cl [Ne] __ Na+ [Ne] __ __ Cl- [Ne]](https://slidetodoc.com/presentation_image_h/c44c150e04890e758473f8a7a9d3325a/image-39.jpg)
Configuraciones electrónicas. 11 Na 17 Cl [Ne] __ Na+ [Ne] __ __ Cl- [Ne] __ __ 1 e- ganado 3 s 3 p 1 e- perdido Según estructuras de Lewis. ¨. ¨ : ]Na. + : Cl Na+[: Cl ¨ ¨ Los átomos de Na, pierden un electrón para formar iones Na+, los Átomos de Cl ganan un electrón cada uno para formar iones Cloruro Cl-. Por lo general, mientras mas distantes se encuentren dos elementos en la tabla periódica, mayor probabilidad existe de que formen un compuesto iónico.

La mayor diferencia de electronegatividad se produce entre la parte Inferior izquierda y la parte superior derecha, en la tabla periódica. Por tanto, Cs. F es más iónico que Li. I. Ejemplo 2. Metales del grupo IA y no metales del grupo VIA Para: 4 Li (s) + O 2 (g) 2 Li 2 O (s) Configuraciones electrónicas. 3 Li [He] __ 8 O [He] __ __ 2 s 2 p Li+ __ O 2 - __ __ ganados 2 s Según estructuras de Lewis. ¨. Li. + : O. 1 e- perdido 2 e- ¨ : ] 22 Li+[: O ¨ 2 p

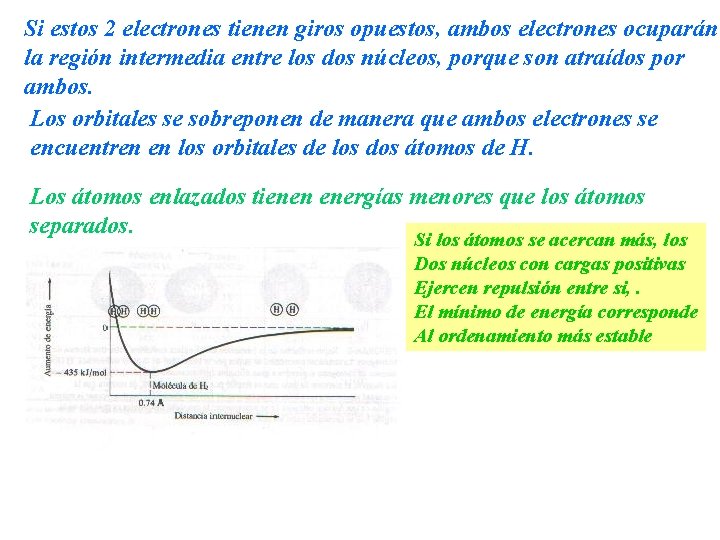
Enlace covalente: Se produce cuando dos átomos comparten uno o más pares de electrones. Cuando las electronegatividades no son lo suficientemente grandes para que se efectúe una transferencia de electrones. Ejemplo 1. Formación de la molécula diatómica H 2 El átomo de H, tiene configuración 1 s 1, la densidad de probabilidad para este electrón está distribuida en forma esférica. Al aproximarse 2 átomos de H, el electrón de cada uno de ellos es atraído por el núcleo del otro, como también por su propio núcleo

Si estos 2 electrones tienen giros opuestos, ambos electrones ocuparán la región intermedia entre los dos núcleos, porque son atraídos por ambos. Los orbitales se sobreponen de manera que ambos electrones se encuentren en los orbitales de los dos átomos de H. Los átomos enlazados tienen energías menores que los átomos separados. Si los átomos se acercan más, los Dos núcleos con cargas positivas Ejercen repulsión entre si, . El mínimo de energía corresponde Al ordenamiento más estable

Los enlaces covalentes pueden ser polares y no-polares. No-polares: Los pares de electrones en los enlaces se comparten por igual entre los dos núcleos Ej: molécula de H 2) Ambos átomos tienen la misma electronegatividad, por tanto la densidad electrónica es simétrica. Los enlaces covalentes en todas las moléculas diatómicas son No polar. Polar: Entre átomos con diferentes electronegatividades, por ende, los pares de electrones del enlace son compartidos de manera desigual. Ej: todas las moléculas diatómicas heteronucleares, HF, HCl.

Enlaces débiles: Los enlaces fuertes, se refieren a fuerzas de atracción intramoleculares es decir, enlaces iónicos y covalentes en el interior de los compuestos. Existen las fuerzas intermoleculares, (entre moléculas), y se refieren a enlaces débiles entre partículas individuales. Ej: Se requieren 920 k. J de energía para descomponer 1 mol de H 2 O (g) en H y O, pero sólo se necesitan 40, 7 k. J, para convertir 1 mol de H 2 O (l) En vapor de agua. Esto refleja las fuerzas entre las moléculas de agua, del tipo Intermoleculares (débiles). Puentes de Hidrógeno.

Interacciones ión-ión: Son las interacciones entre los iones en los compuestos iónicos, como consecuencia de las fuerzas de atracción de iones con cargas opuestas. Debido a estas fuerzas, los compuestos iónicos, son sólidos con elevado punto de fusión, y una vez que resultan fundidos, tienen un elevadísimo Punto de ebullición. Interacciones dipolo-dipolo. Entre las moléculas covalentes existen este tipo de interacciones Debido a la atracción de las partes de las moléculas con densidad + ( +) y las otras partes de las moléculas con densidad – ( -). Estas solo son eficaces a distancias cortas y son más débiles que las fuerzas ion-ion. Dióxido de azufre SO 2 -A- fuerzas atracción -R- Fuerzas de repulsión

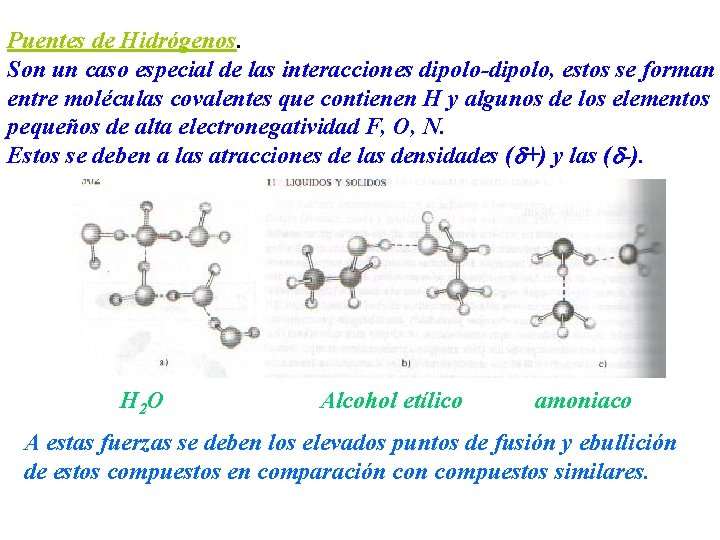
Puentes de Hidrógenos. Son un caso especial de las interacciones dipolo-dipolo, estos se forman entre moléculas covalentes que contienen H y algunos de los elementos pequeños de alta electronegatividad F, O, N. Estos se deben a las atracciones de las densidades ( +) y las ( -). H 2 O Alcohol etílico amoniaco A estas fuerzas se deben los elevados puntos de fusión y ebullición de estos compuestos en comparación compuestos similares.
 Relacion molar
Relacion molar Atmica
Atmica Atmica
Atmica Joseph thomson
Joseph thomson Las partículas fundamentales del átomo son
Las partículas fundamentales del átomo son Atmica
Atmica Atomizadores continuos
Atomizadores continuos Masa atmica
Masa atmica Atmica
Atmica Comisin
Comisin Centenas
Centenas Profesora marlene
Profesora marlene De la profesora
De la profesora Profesora ma
Profesora ma Listo profesora
Listo profesora Cuantitativos numerales cardinales
Cuantitativos numerales cardinales Profesor baltazar sreća u dvoje
Profesor baltazar sreća u dvoje Completar nombre
Completar nombre Textos informativos 5 basico
Textos informativos 5 basico La profesora patricia inicia las actividades
La profesora patricia inicia las actividades Verbo de 9 letras
Verbo de 9 letras Profesora xn
Profesora xn La profesora marta en el proceso de desarrollo
La profesora marta en el proceso de desarrollo Profesora ma
Profesora ma Profesora de lenguaje animada
Profesora de lenguaje animada Grado superlativo absoluto
Grado superlativo absoluto Profesora marlene
Profesora marlene Que es una onda
Que es una onda Presente profesora
Presente profesora Presenté profesora
Presenté profesora Presente profesora
Presente profesora Profesora
Profesora Sigla edu
Sigla edu Tita de la garza
Tita de la garza Que es plurisignificativo
Que es plurisignificativo La profesora no lleva traje. lleva una falda y ____.
La profesora no lleva traje. lleva una falda y ____. Oraciones con soy
Oraciones con soy Profesora de lenguaje animada
Profesora de lenguaje animada La profesora miss anderson
La profesora miss anderson Nombre
Nombre Nombre profesora
Nombre profesora Mariposa es sílaba tónica
Mariposa es sílaba tónica Profesora ariana
Profesora ariana Sigla de profesora
Sigla de profesora Profesora caricatura
Profesora caricatura Profesora m
Profesora m La profesora sonia presenta diapositivas
La profesora sonia presenta diapositivas