TITRASI ARGENTOMETRI Indri Kusuma Dewi S Farm M























- Slides: 28

TITRASI ARGENTOMETRI Indri Kusuma Dewi, S. Farm. , M. Sc. , Apt. 1

VOLUMETRI / TITRIMETRI ANALISIS KUANTITATIF : MENENTUKAN VOLUME LARUTAN YANG SUDAH DIKETAHUI KONSENTRASINYA, YANG BEREAKSI SECARA KUANTITATIF DAN STOKHIOMETRI DENGAN LARUTAN SAMPEL

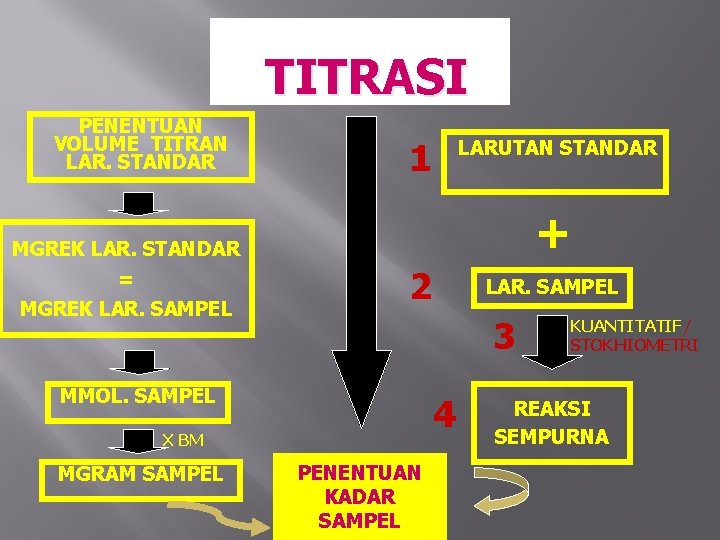
TITRASI PENENTUAN VOLUME TITRAN LAR. STANDAR 1 LARUTAN STANDAR + MGREK LAR. STANDAR = MGREK LAR. SAMPEL 2 3 MMOL. SAMPEL 4 X BM MGRAM SAMPEL LAR. SAMPEL PENENTUAN KADAR SAMPEL KUANTITATIF/ STOKHIOMETRI REAKSI SEMPURNA

KLASIFIKASI METODE BERDASARKAN KOMBINASI ION: • ASAM-BASA • PENGENDAPAN DAN PEMBENTUKAN KOMPLEK ARGENTOMETRI • KOMPLEKSOMETRI BERDASARKAN PERTUKARAN ELEKTRON: REAKSI OKSIDASI-REDUKSI

Pendahuluan Kelarutan : Adalah sejumlah (massa) zat terlarut dalam 100 m. L larutan Tanpa dinyatakan lain pelarut adalah air

Pendahuluan Larutan jenuh : Adalah larutan yang tepat berada dalam kesetimbangan antara larutan dan pengendapan dapat dicapai dengan penambahan zat ke dalam pelarut secara terus menerus hingga zat tidak melarut lagi, atau dengan cara menaikkan konsentrasi ion-ion tertentu hingga terbentuk endapan.

Faktor 2 yg mempengaruhi kelarutan 1. 2. 3. 4. 5. 6. 7. 8. SUHU SIFAT PELARUT ION SEJENIS AKTIVITAS ION p. H HIDROLISIS HIDROKSIDA LOGAM PEMBENTUKAN SENYAWA KOMPLEKS

Argentometri Pendahuluan Dasar Argentometri reaksi pengendapan, melibatkan garam perak Karena yang terjadi adalah reaksi pengendapan, argentometri disebut juga titrasi pengendapan Argentometri biasanya digunakan untuk menetapkan kadar halogen 8

SYARAT TITRASI PENGENDAPAN Ø Reaksi zat yang dititrasi dengan pentiter : cepat Ø Ø Reaksi sempurna secara kuantitatif Tidak ada reaksi tambahan yang mempengaruhi stokhiometri antara zat yang dititrasi dengan larutan baku primer Ø Titik akhir titrasi jatuh berdekatan dengan titik ekivalen

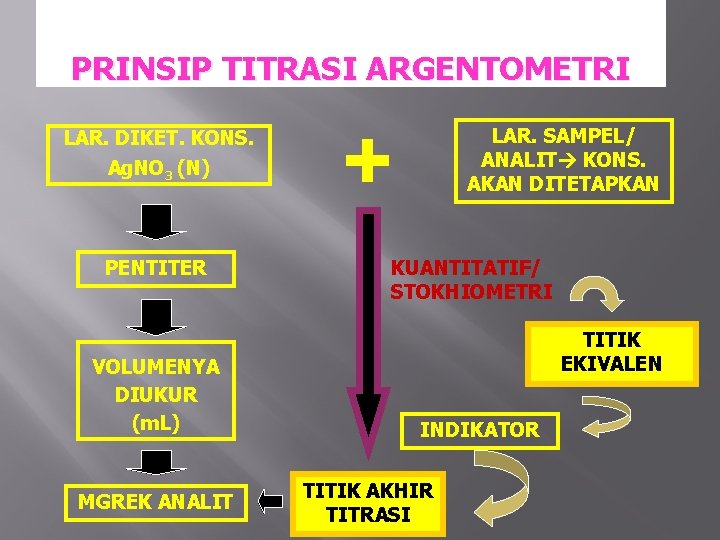
PRINSIP TITRASI ARGENTOMETRI LAR. DIKET. KONS. Ag. NO 3 (N) PENTITER VOLUMENYA DIUKUR (m. L) MGREK ANALIT + LAR. SAMPEL/ ANALIT KONS. AKAN DITETAPKAN KUANTITATIF/ STOKHIOMETRI TITIK EKIVALEN INDIKATOR TITIK AKHIR TITRASI

Metode-metode Argentometri 1. Metode Mohr - Terutama untuk menetapkan kadar klorida * Kadar Iodida tidak dapat ditetapkan dengan metode ini perubahan warna terjadi tidak menentu Indikator 1 -2 ml larutan K 2 Cr. O 4 5% per 100 ml larutan uji, atau larutan K 2 Cr. O 4 10% * Jika terlalu besar titik akhir terjadi sebelum titik ekivalen Jika terlalu kecil titik akhir lambat tercapai 11

Reaksi - saat titrasi berlangsung Ag+ + Cl- Ag. Cl (Ag. NO 3) - saat titik akhir tercapai 2 Ag+ + Cr. O 42 - Ag 2 Cr. O 4 p. H titrasi Disarankan pada p. H netral atau mendekati netral ( sekitar 8 ) 12

p. H titrasi * Jika keasaman meningkat, kelarutan endapan Ag 2 Cr. O 4 meningkat sehingga ion indikator kromat dikonversi menjadi bikromat sehingga dibutuhkan indikator yang lebih banyak untuk membentuk endapan Ag 2 Cr. O 4. Akibatnya, titik akhir titrasi menjadi lambat tercapai. 2 Cr. O 42 - + 2 H+ 2 HCr. O 4 Cr 2 O 72 - + H 2 O 13

p. H titrasi * Sebaliknya, Pembentukan endapan perak hidroksida atau perak karbonat pada p. H sangat basa dihindari Ag+ + OH- Ag. OH Ag 2 O + H 2 O Jika larutan uji, - terlalu basa dinetralkan dengan HNO 3 encer (1: 20) - terlalu asam dinetralkan dengan boraks bebas klorida, Ca. CO 3 bebas klorida, Na- atau KHCO 3, atau Mg. O; atau menggunakan bufer asetat Dianjurkan : boraks atau bikarbonat 14

2. Metode Volhard - Paling sering PK klorida atau bromida - Untuk bromida dan iodida dapat ditentukan tanpa harus menyaring endapan perak halida yang terbentuk - Untuk klorida, perak klorida yang terbentuk disaring atau digojog kuat-kuat dengan nitrobenzen agar mengalami koagulasi dan partikel endapan perak klorida terlapisi, sehingga tidak bereaksi dengan amonium tiosianat (titran) 15

- Titrasi dilakukan secara tidak langsung Larutan standar Ag. NO 3 berlebih ditambahkan ke dalam larutan uji dalam medium asam (biasanya HNO 3). Kelebihan Ag. NO 3 dititrasi dengan amonium tiosianat Indikator Biasanya 1 -2 ml larutan jenuh besi(III)amonium sulfat (kira-kira 40%) per 100 ml titrat 16

Reaksi - saat titrasi berlangsung Ag+ + X- Ag. X + Ag+ (Ag. NO 3) Ag+ + SCN- Ag. SCN (kelebihan) (putih) - saat titik akhir tercapai Fe. NH 4(SO 4)2 (titran) Fe 3+[Fe(SCN)6]3 - + 4(NH 4)2 SO 4 Fe. NH 4(SO 4)2 (titran) Fe(SCN)3 17

3. Metode Fajans - dapat untuk PK klorida dan bromida Indikator adsorbsi * eosin untuk bromida (p. H 2 - 3), * diklorofluoresein untuk klorida (p. H 4 - 4, 5) 18

Prinsip indikator adsorbsi sebelum titik akhir Ag. Cl: Cl-: Na+ pada saat titik akhir Ag. Cl: Ag+: Indikator- (merah) 19

4. Metode Liebig-Deniges - Terutama untuk menetapkan kadar sianida - Titrasi dilakukan dalam larutan amoniakal Indikator KI Reaksi Ag+ + 2 CN- Ag(CN)2 - (keruh larut) Ag+ + Ag(CN)2 - Ag. Ag(CN)2 + NH 3 2 Ag(NH 3)2+ + 2 CNAg(NH 3)2+ + I- Ag. I + 2 NH 3 keruh intensif ← titik akhir (kuning kenari) 20

Beberapa Titran a. Larutan Ag. NO 3 0, 1 N (BM 169, 87) Pembuatan ± 17, 5 g Ag. NO 3 dilarutkan dalam 1000 ml akuades Pembakuan - Dengan Na. Cl - Menggunakan indikator eosin - Dititrasi dengan larutan Ag. NO 3 0, 1 N b. Larutan NH 4 SCN 0, 1 N (BM 76, 12) Pembuatan ± 8 g NH 4 SCN dilarutkan dalam 1000 ml akuades Pembakuan - Dengan sejumlah volume tertentu larutan standar Ag. NO 3 0, 1 N - Ditambah HNO 3 (bebas NO 2 -) - Menggunakan indikator Fe. NH 4(SO 4)2 - [suhu < 25 o. C; jika > 25 o. C Fe(SCN)3 (pucat)] - Dititrasi dengan larutan standar NH 4 SCN 21

PRINSIP REAKSI Pembakuan Ag. NO 3 (METODA MOHR) Na Cl + Ag. NO 3 2 Ag. NO 3 + K 2 Cr. O 4 Ag. Cl + Na. NO 3 Endapan putih Ag 2 Cr. O 4 + 2 KNO 3 Endapan coklat merah Penentuan kadar sampel (METODA FAJANS) Cl- + Ag. NO 3 Larut Ag. Cl Endapan putih Larut + NO 3 - Larut Ag. Cl Ag+ + NO 3 - + Fluoroscein Ag. Cl +Fluoroscein + Ag. NO 3 (Suspensi putih) (Suspensi hijau) (Suspensi merah)

PRINSIP REAKSI Penentuan kadar sampel (METODA VOLHARD) Cl - + Ag. NO 3 Ag. Cl berlebih + NO 3 Endapan putih Larut disaring Ag. NO 3 + CNS- kelebihan (filtrat) CNS- + Fe 3+ (N) Ag. CNS + NO 3 - Endapan putih Fe. CNS 2 - (larutan merah intensif) Larut

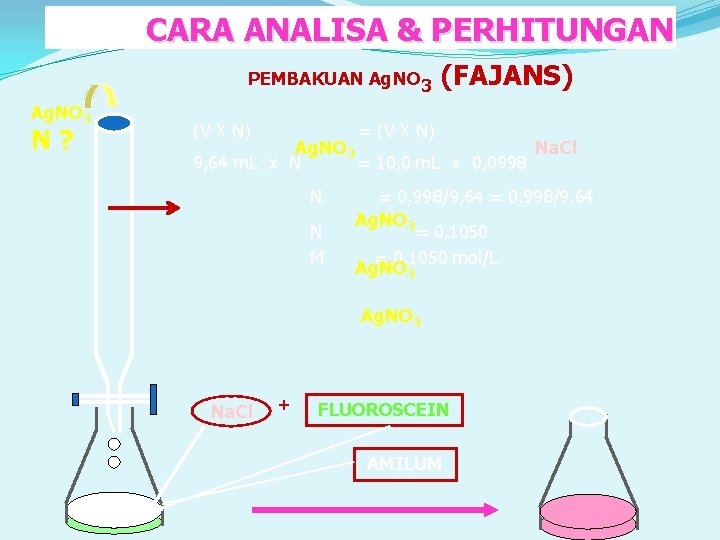
CARA ANALISA & PERHITUNGAN PEMBAKUAN Ag. NO 3 N? (V X N) (FAJANS) = (V X N) Ag. NO 3 Na. Cl 9, 64 m. L x N = 10, 0 m. L x 0, 0998 N N M = 0, 998/9, 64 Ag. NO 3 = 0, 1050 mol/L Ag. NO 3 Na. Cl + FLUOROSCEIN AMILUM 10, 0 m. L

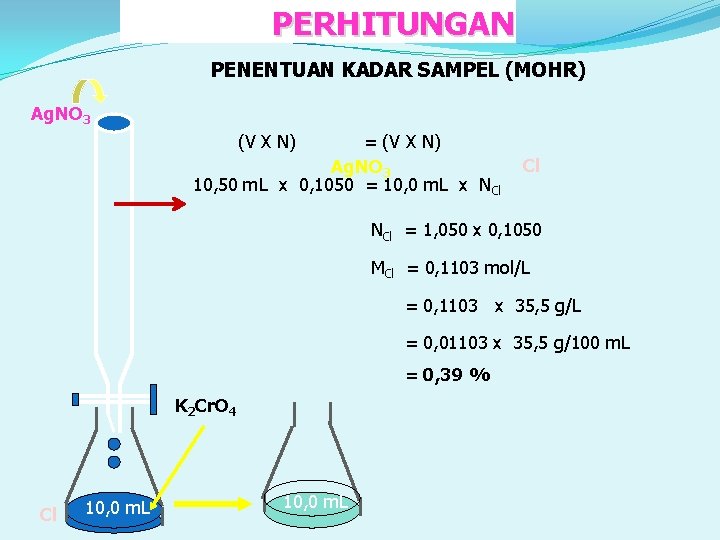
PERHITUNGAN PENENTUAN KADAR SAMPEL (MOHR) Ag. NO 3 (V X N) = (V X N) Ag. NO 3 10, 50 m. L x 0, 1050 = 10, 0 m. L x NCl Cl NCl = 1, 050 x 0, 1050 MCl = 0, 1103 mol/L = 0, 1103 x 35, 5 g/L = 0, 01103 x 35, 5 g/100 m. L = 0, 39 % K 2 Cr. O 4 Cl 10, 0 m. L

CONTOH PENENTUAN KADAR Cl DENGAN METODA VOLHARD Sampel infus Ringer Laktat ditentukan kadar kloridanya secara argentometri menggunakan metoda Volhard. Pada pembaku-an larutan Ag. NO 3 ditimbang seksama Na. Cl + 290 mg, dilarutkan air suling sampai 50, 0 m. L, dipipet 10, 0 m. L dan dititrasi dengan larutan Ag. NO 3 menggunakan indikator K 2 Cr. O 4. Volume titran yang diperlukan adalah 10, 20 m. L. Pada penentuan kadar sampel, dipipet 10, 0 m. L larutan infus, dimasukkan ke erlenmeyer 250 m. L, ditambah 20, 0 m. L larutan Ag. NO 3, dikocok hingga reaksi sempurna. Suspensi disaring dengan cara dekantasi, endapan dicuci dengan air suling sampai bebas NO 3 - , filtrat dititrasi dengan larutan NH 4 CNS 0, 1000 N menggunakan indikator larutan Fe. Cl 3 sampai warna merah intensif. Apabila titran yang diperlukan adalah 11, 50 m. L, berapa persen (b/v) kadar klorida dalam sampel infus? (BM Na. Cl 58, 55, BA Cl 35, 5)

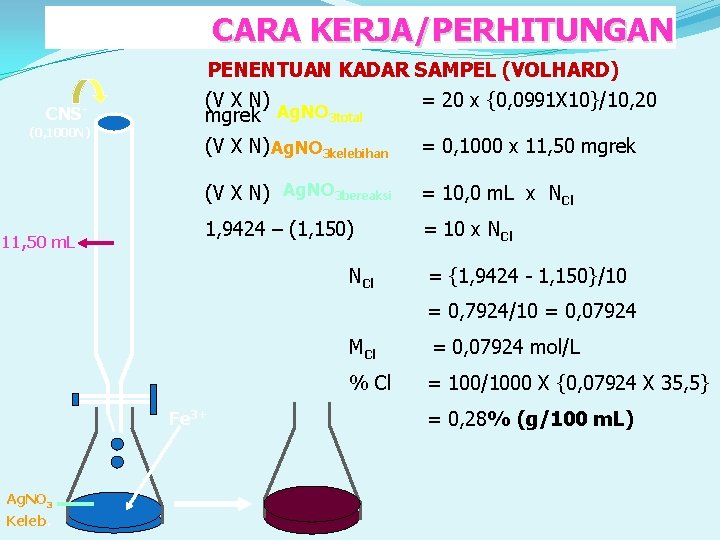
CARA KERJA/PERHITUNGAN CNS(0, 1000 N) 11, 50 m. L PENENTUAN KADAR SAMPEL (VOLHARD) (V X N) = 20 x {0, 0991 X 10}/10, 20 Ag. NO 3 total mgrek (V X N) Ag. NO 3 kelebihan = 0, 1000 x 11, 50 mgrek (V X N) Ag. NO 3 bereaksi = 10, 0 m. L x NCl 1, 9424 – (1, 150) = 10 x NCl = {1, 9424 - 1, 150}/10 = 0, 7924/10 = 0, 07924 Fe 3+ Ag. NO 3 Keleb. MCl = 0, 07924 mol/L % Cl = 100/1000 X {0, 07924 X 35, 5} = 0, 28% (g/100 m. L)

CONTOH SOAL PENENTUAN KADAR EFEDRIN HCl Efedrin HCl dalam tablet ditentukan kadarnya secara argento-metri. Papa pembakuan Ag. NO 3 ditimbang seksama Na. Cl + 580 mg, dilarutkan dalam air 100, 0 m. L. Larutan baku primer Na. Cl dipipet 10, 0 m. L dan dititrasi dengan larutan Ag. NO 3 , indikator fluoroscein. Volume titran yang diperlukan 10, 20 m. L. Pada penentuan kadar sampel, sebanyak 20 tablet sebelum diserbuk ditimbang satu per satu untuk dihitung berat rerata tablet. Ditimbang seksama + 0, 3 g serbuk, ditambah 10 m. L air, asam asetat dan indikator bromofenol biru (bromphenol blue), dimasukkan dalam erlenmeyer 250 m. L, dititrasi dengan Ag. NO 3 sampai warna ungu. Titran yang diperlukan 11, 00 m. L. Apabila berat rerata tablet efedrin HCL 250 mg, kadar efedrin dalam setiap tablet sesuai Farmakope adalah 25 mg, dengan syarat tidak kurang dari 95% dan tidak lebih dari 105%, apakah kadar efedrin dalam sampel tablet tersebut memenuhi syarat? (BM Na. Cl 58, 55; BM efedrin 165, 23; BM HCl 36, 5; 1 m. L 0, 1 N Ag. NO 3 setara dengan 0, 0027 gram efedrin HCl).
 Indri kusuma dewi
Indri kusuma dewi Maksudnya
Maksudnya Amelia sri kusuma dewi sh. m.kn
Amelia sri kusuma dewi sh. m.kn Kurva titrasi argentometri
Kurva titrasi argentometri Faktor yang mempengaruhi titrasi argentometri
Faktor yang mempengaruhi titrasi argentometri Frontozygoma
Frontozygoma Ilmu mengenal diri
Ilmu mengenal diri Cakra wijaya kusuma
Cakra wijaya kusuma Indri search engine
Indri search engine Indri mempunyai 16 jilbab dan 18 bros
Indri mempunyai 16 jilbab dan 18 bros Bhikkhuni kusuma
Bhikkhuni kusuma Tigmotropisme
Tigmotropisme Andi membagikan 42 buku 54 pensil dan 60 penggaris
Andi membagikan 42 buku 54 pensil dan 60 penggaris Dr indri aulia
Dr indri aulia Pengertian metode volhard
Pengertian metode volhard Argentometri volhard
Argentometri volhard Dewi xxx
Dewi xxx Ica puspita dewi anggraini
Ica puspita dewi anggraini Ika atsari dewi
Ika atsari dewi Dewi kurniasih
Dewi kurniasih Pendekatan ekologi
Pendekatan ekologi Dewi ayu larasati
Dewi ayu larasati Dewi kurniasih
Dewi kurniasih Dewa dewi prediktor lll
Dewa dewi prediktor lll Bank mandiri dewi sri
Bank mandiri dewi sri Dewi irawaty
Dewi irawaty Dewa dewi predictor
Dewa dewi predictor Ica puspita dewi anggraini
Ica puspita dewi anggraini Gambar dewi gayatri
Gambar dewi gayatri