THERMODINAMIKA Tatap Muka ke III KONSEP DASAR THERMODINAMIKA














- Slides: 16

THERMODINAMIKA Tatap Muka ke III

KONSEP DASAR THERMODINAMIKA Thermodinamika adalah ilmu pengetahuan yang membicarakan mengenai energi dan bentuk 2 transformasinya. Energi dapat secara luas didefinisikan sebagai kemampuan untuk menghasilkan atau kapasitas untuk menghasilkan suatu efek.

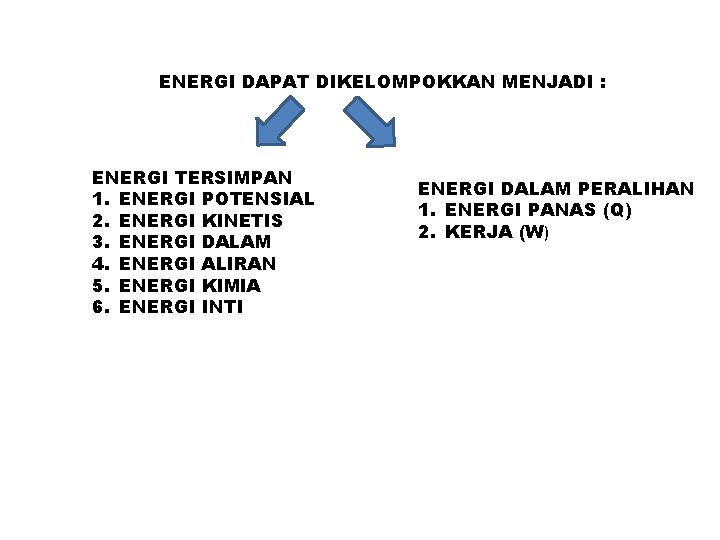
ENERGI DAPAT DIKELOMPOKKAN MENJADI : ENERGI TERSIMPAN 1. ENERGI POTENSIAL 2. ENERGI KINETIS 3. ENERGI DALAM 4. ENERGI ALIRAN 5. ENERGI KIMIA 6. ENERGI INTI ENERGI DALAM PERALIHAN 1. ENERGI PANAS (Q) 2. KERJA (W)

ENERGI TERSIMPAN 1. ENERGI POTENSIAL, YAITU ENERGI YANG DIPUNYAI OLEH BENDA KARENA LETAKNYA SECARA RELATIF TERHADAP SUATU BIDANG DATAR Ep = Berat X tinggi = W X Y 2. ENERGI KINETIS (EK) YAITU ENERGI YANG DIPUNYAI OLEH BENDA KARENA KECEPATANNYA EK = 1/2 ( masa X kecepatan ) = 1/2 mv 2 3. ENERGI DALAM YAITU ENERGI YANG DIPUNYAI OLEH BENDA KARENA AKTIFITAS DAN KONFIGURASI DARI MOLEKUL-MOLEKULNYA 4. ENERGI ALIRAN YAITU ENERGI YANG DIPUNYAI OLEH BENDA KHUSUSNYA FLUIDA YANG MENGALIR DALAM SUATU PIPA KARENA ADANYA KERJA SEHINGGA FLUIDA MENGALIR

LANJUTAN 5. ENERGI KIMIA YAITU ENERGI YANG DIPUNYAI OLEH BENDA KARENA STRUKTUR ATOMNYA ATAU ENERGI YANG DIHASILKAN DARI SUATU REAKSI KIMIA 6. ENERGI INTI YAITU ENERGI YANG TERIKAT DI DALAM ATOM DAN ENERGI INI MENJADI NYATA SEWAKTU DILEPASKAN SELAMA PERUBAHAN PARTIKEL DI DALAM INTI ATOM. E = m c 2 Dimana m = masa; c = kecepatan cahaya

ENERGI DALAM PERALIHAN 1. ENERGI PANAS (Q), YAITU ENERGI PERALIHAN DARI SATU BENDA KE BENDA LAIN ATAU DARI SATU BADAN KE BADAN YANG LAIN KARENA ADANYA PERBEDAAN SUHU. JUMLAH PANAS BIASANYA DINYATAKAN SEBAGAI HASIL DARI MASA BENDA, KAPASITAS PANAS DAN PERUBAHAN SUHU. Q = m c d. T 2. KERJA YAITU ENERGI PERALIHAN YANG DIHASILKAN DARI SUATU GAYA YANG BERGERAK PADA SUATU JARAK TERTENTU. KERJA DINYATAKAN SEBAGAI HASIL DARI GAYA DAN JARAK DIMANA GAYA BERGERAK W = F d. X

lanjutan DALAM SUATU MEDIA YANG MENGALAMI PENGEMBANGAN REVERSIBLE ATAU KONTRAKSI, KERJA DINYATAKAN SEBAGAI : W = (pd. V), R menyatakan proses reversible PERSAMAAN DIATAS DI DAPAT MENGINGAT BAHWA GAYA F = p. A dan Jarak d. X = d. V/A

HUKUM THERMODINAMIKA I ENERGI MASUK + ENERGI TERSIMPAN DALAM SISTEM PADA KEADAAN PERTAMA = ENERGI KELUAR + ENERGI TESIMPAN PADA KEADAAN KEDUA

DALAM KESEIMBANGAN ENERGI (ENERGI MASUK) = (ENERGI KELUAR) (ENERGI TERSIMPAN) + (ENERGI HILANG) +

HUKUM THERMODINAMIKA II - Clausius Tidak mungkin adanya pemindahan panas dari suhu rendah ke suhu tinggi - Planck Tidak mungkin mengabsorbsi panas dari suatu reservoir dan dapat menghasilkan kerja yang ekivalen

Lanjutan Dengan kata lain adalah suatu proses yang spontan hanya dapat terjadi jika energi berpindah dari bahan yang mempunyai energi tinggi ke bahan yang mempunyai energi yang lebih rendah. Penerapan lebih lanjut dari hukum thermodinamika kedua adalah pemahaman akan suatu ketidak teraturan dari suatu sistem yang disebut dengan entropi. Entropi, biasa disimbolkan dengan S.

lanjutan S adalah derajad ketidak teraturan dari suatu sistem. Entropi dapat bertanda positip ataupun negatip tergantung dari arah pertukaran energi. Perubahan entropi bernilai positip, jika sistem menerima energi dan sebaliknya bernilai negatip jika sistem kehilangan energi

CONTOH SOAL : 1. SEBUAH AUTOCLAVE BERISI 1000 LB KALENG SOP KACANG. AUTOCLAVE INI DIPANASKAN SAMPAI SUHU KESELURUHAN 240 o. F. APABILA KALENG DIDINGINKAN MENJADI 100 o. F SEBELUM KELUAR AUTOCLAVE, BERAPA BANYAK AIR PENDINGIN YANG DIBUTUHKAN APABILA AIR MASUK BERSUHU 65 o. F DAN KELUAR 90 o. F. KALOR JENIS SOP KACANG DAN LOGAM KALENG BERTURUT-TURUT 0, 98 Btu/lb o. F DAN 0, 12 Btu/lb o. F. BERAT SETIAP KALENG 2 oz DAN BERISI 1 lb SOP KACANG. ANGGAP KANDUNGAN KALOR DINDING AUTOCLAVE DI ATAS 100 o. F, ADALAH 15000 Btu DAN TIDAK ADA KALOR YANG HILANG MELALUI DINDING. SAMAKANLAH W BERAT AIR PENDINGIN YANG DIBUTUHKAN DATA STANDAR SUHU ADALAH 100 o. F, YAITU SUHU KALENG KELUAR AUTOCLAVE.

JAWAB : KALOR MASUK -KALOR MASUK DI DALAM KALENG = BERAT KALENG X KALOR SPESIFIK X SUHU DIATAS STANDAR = 1000 X 2/ 16 X 0, 12 X (240 -100) = 2100 Btu -KALOR DI DALAM ISI KALENG = BERAT SOP KACANG X KALOR JENIS X SUHU DIATAS STANDAR = 1000 X 1 X 0, 98 X (240 - 100) = 137. 200 Btu -KALOR DI DALAM AIR = BERAT AIR X KALOR JENIS X SUHU DI ATAS DATA STANDAR = w X 1 X (65 – 100) = - 35 w Btu -Catatan : 1 lb = 16 oz

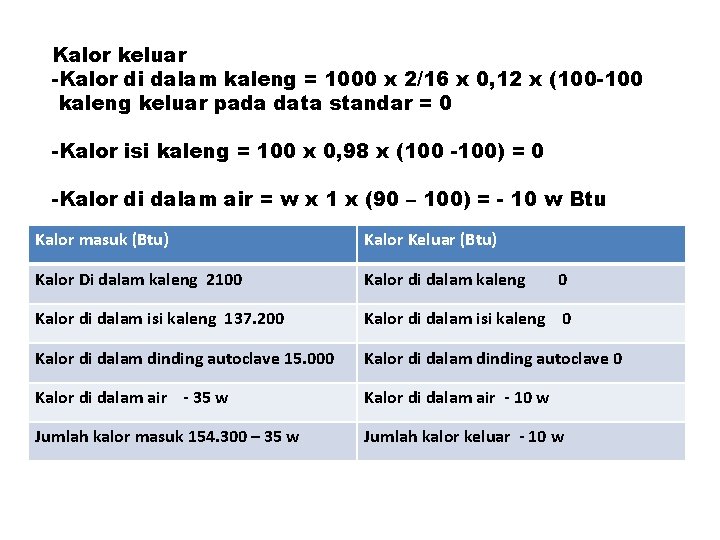
Kalor keluar -Kalor di dalam kaleng = 1000 x 2/16 x 0, 12 x (100 -100 kaleng keluar pada data standar = 0 -Kalor isi kaleng = 100 x 0, 98 x (100 -100) = 0 -Kalor di dalam air = w x 1 x (90 – 100) = - 10 w Btu Kalor masuk (Btu) Kalor Keluar (Btu) Kalor Di dalam kaleng 2100 Kalor di dalam kaleng Kalor di dalam isi kaleng 137. 200 Kalor di dalam isi kaleng 0 Kalor di dalam dinding autoclave 15. 000 Kalor di dalam dinding autoclave 0 Kalor di dalam air - 35 w Kalor di dalam air - 10 w Jumlah kalor masuk 154. 300 – 35 w Jumlah kalor keluar - 10 w 0

JUMLAH KALOR MASUK = JUMLAH KALOR KELUAR 154. 300 – 35 w = - 10 w w = 6172 lb Jadi jumlah air yang dibutuhkan = 6172 lb
 Contoh komunikasi tatap muka
Contoh komunikasi tatap muka Carnot körfolyamat
Carnot körfolyamat Thermodinamika
Thermodinamika Sistem terisolasi
Sistem terisolasi Membaca tatap adalah
Membaca tatap adalah Antarmuka memori utama
Antarmuka memori utama Konsep esensial dasar-dasar desain grafis
Konsep esensial dasar-dasar desain grafis Peta konsep tentang jaringan komputer
Peta konsep tentang jaringan komputer Konsep dasar unit pemrosesan dan dasar datapath
Konsep dasar unit pemrosesan dan dasar datapath Konsep dasar akuntansi manajemen
Konsep dasar akuntansi manajemen Konsep dasar etika keguruan
Konsep dasar etika keguruan Konsep dasar wirausaha
Konsep dasar wirausaha Peta konsep bab 2
Peta konsep bab 2 Konsep dasar komunikasi
Konsep dasar komunikasi Hamlet act iii scene iii
Hamlet act iii scene iii Dasar dasar manajemen
Dasar dasar manajemen Dasar dasar prosedur pembukuan
Dasar dasar prosedur pembukuan