PANDANGAN UMUM TENTANG THERMODINAMIKA Thermodinamika adalah ilmu yang


































- Slides: 54

PANDANGAN UMUM TENTANG THERMODINAMIKA Thermodinamika adalah ilmu yang membahas hubungan antara panas dengan kerja. Hubungan ini didasarkan pada dua hukum-hukum dasar thermodinamika, yaitu HUKUM THERMODINAMIKA PERTAMA dan HUKUM THERMODINAMIKA KEDUA.

PANDANGAN UMUM TENTANG THERMODINAMIKA Kedua hukum dasar ini akan dibicarakan pada bab III dan bab V berikutnya. Prinsif-prinsif dan metode-metode thermodinamika dipakai pada perencanaan motor-motor bakar (Turbin), pusat tenaga nuklir, pesawat-pesawat pendingin, roket (pesawat terbang), pesawat-pesawat dengan tenaga listrik dan lain-lain.

SISTEM THERMODINAMIKA Pada pelajaran (pengetahuan) thermodinamika, benda kerja yang dimaksudkan sering disebut dengan sistem. Hal ini dimaksudkan untuk memisahkan benda kerja dengan sekelilingnya (sekitarnya).

SISTEM THERMODINAMIKA Adapun definisi dari sistem adalah : suatu batasan yang dipakai untuk menunjukan suatu benda (benda kerja) dalam suatu permukaan tertutup.

SISTEM THERMODINAMIKA Misalnya : *) Udara dikompresi di dalam silinder. Dalam hal ini sistem adalah udara yang dikompresikan dan permukaan tertutup adalah permukaan yang dibatasi silinder

KOORDINAT SISTEM DAN KEADAAN SISTEM Pada thermodinamika, volume V, temperatur T, tekanan P, kerapatan ρ dan lain-lain disebut sebagai koordinat sistem. Keadaan sistem tergantung pada koordinat sistem, bila koordinat sistem berubah maka keadaan sistem akan berubah. Sehingga koordinat sistem sering disebut sebagai perubah (variabel) keadaan sistem/zat. Dimana perubahan keadaan sistem dari suatu keadaan ke keadaan lain dapat digambarkan pada diagram V, T, P.

KOORDINAT SISTEM DAN KEADAAN SISTEM Dalam thermodinamika, besaran sistem dapat dibagi menjadi dua besaran thermodinamika yaitu : besaran Extensive dan besaran Intensive. Besaran extensive dipengaruhi oleh massa atau mole sistem, sedangkan besaran intensive tidak dipengaruhi oleh massa atau mole sistem. Contoh : Besaran extensive : Volume, Kapasitas Panas, Kerja (energi), entropy dll. Besaran intensive : Tekanan, Temperatur, kerapatan dll.

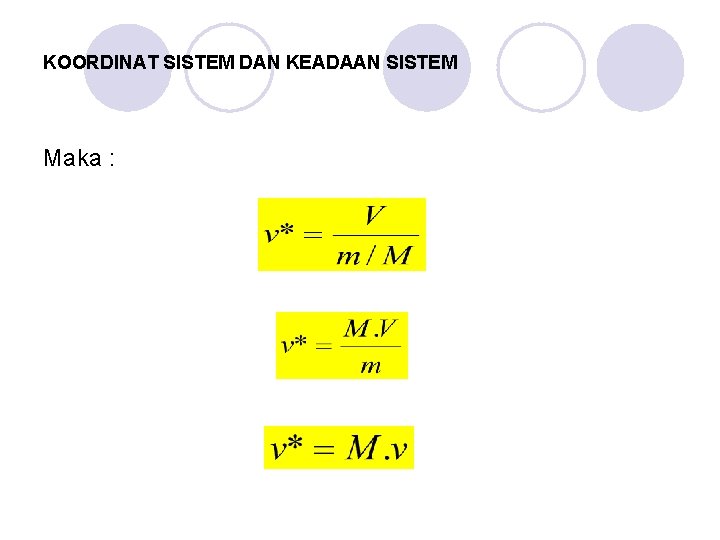
KOORDINAT SISTEM DAN KEADAAN SISTEM Dari besaran-besaran extensive akan diperoleh harga-harga jenis (specific Value) dan harga molar (molal specific value) dari suatu sistem, seperti berikut : *) Haraga Jenis (specific value) adalah perbandingan antara besaran extensive dengan massa sistem/zat.

KOORDINAT SISTEM DAN KEADAAN SISTEM Contoh : Volume jenis dari sistem: V = Volume sebenarnya (m 3 ; ft 3) M = massa sistem (kg ; lb)

KOORDINAT SISTEM DAN KEADAAN SISTEM **) Haraga jenis molar adalah perbandingan antara besaran extensive dengan jumlah mole dari suatu sistem/zat. Contoh : Volume Jenis Molar : Dimana :

KOORDINAT SISTEM DAN KEADAAN SISTEM Maka :

KOORDINAT SISTEM DAN KEADAAN SISTEM Untuk kerapatan suatu sistem/zat dapat dibuat hubungan sebagai berikut : Sehingga didapat :

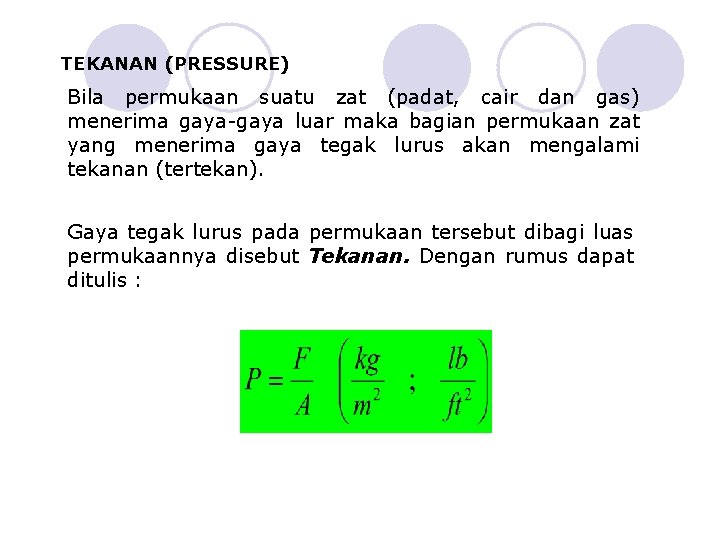
TEKANAN (PRESSURE) Bila permukaan suatu zat (padat, cair dan gas) menerima gaya-gaya luar maka bagian permukaan zat yang menerima gaya tegak lurus akan mengalami tekanan (tertekan). Gaya tegak lurus pada permukaan tersebut dibagi luas permukaannya disebut Tekanan. Dengan rumus dapat ditulis :

Dimana : Dalam thermodinamika, tekanan p umumnya dinyatakan dalam harga absolut (tekanan absolut/mutlak), maka dalam diktat ini simbol p menyatakan tekanan absolut dari sistem/zat Tekanan absolut tergantung pada tekanan pengukuran sistem, jadi:

1. Bila tekanan pengukuran (pressure gauge) sistem diatas tekanan atmosfir, maka : Tekanan absolut = Tekanan pengukuran + Tekanan Atmosfir Atau : Pabs = P gauge + P atm 2. Bila tekanan pengukuran (pressure gauge) sistem di bawah tekanan atmosfir maka : Tekanan absolut = Tekanan atmosfir – Tekanan pengukuran Atau : Pabs = Patm – Pgauge

Dalam satuan British, tekanan absolut dan tekanan pengukuran masing-masing dinyatakan dalam psia (pound persquare inch absolut) dan psig (pound persquare inch gauge). 1 standard atmosfir = 1, 01324 x 105 N/m 2 = 14, 7 lb/in 2 = 10332 kg/m 2

TEMPERATUR HUBUNGAN ANTARA SKALA RANKINE DAN FAHRENHEIT KELVIN, CELCIUS, Skala temperatur mutlak ada dua macam yakni : Dalam satuan internasional Tabs = 273 + T 0 C (0 K) Dalam satuan British Tabs = 460 + T 0 F (0 R)

Dimana : T 0 F = 9/5(T 0 C) + 32 T 0 C = 5/9(T 0 F - 32) Hubungan antara skala temperatur kelvin, celcius, rankine dan fahrenheit 0 R 672 492 0 0 F 0 K 0 C 212 373 100 32 273 0 - 460 0 - 273 Ttk. didih Ttk didih Nol absolut

PERSAMAAN KEADAAN GAS IDEAL (GAS SEMPURNA) Dalam thermodinamika, gas yang dipergunakan sebagai benda kerja umumnya semuanya dianggap bersifat sebagai gas ideal. Hal ini disebabkan karena sifat-sifat gas ideal hanya berbeda sedikit dari sifat-sifat gas yang sebenarnya Gas ideal (sempurna) adalah gas dimana tenaga ikat molekul-molekulnya dapat diabaikan. Jadi setiap gas Bila tenaga ikat molekulnya dapat diabaikan tergolong dalam gas ideal

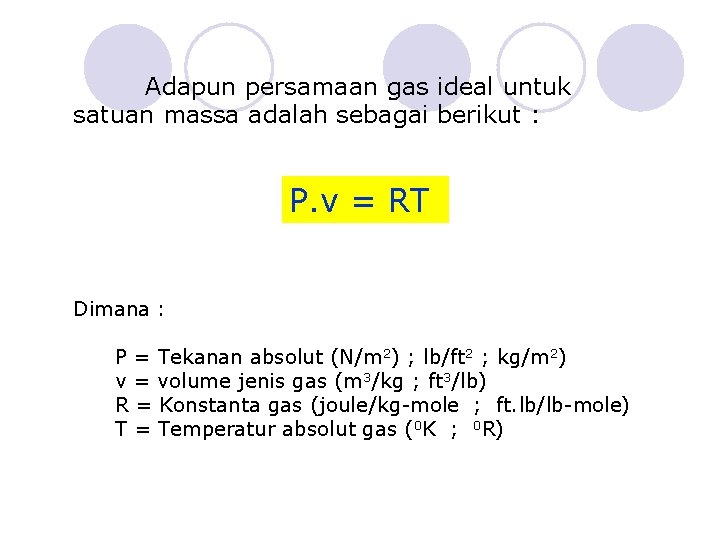
Adapun persamaan gas ideal untuk satuan massa adalah sebagai berikut : P. v = RT Dimana : P = Tekanan absolut (N/m 2) ; lb/ft 2 ; kg/m 2) v = volume jenis gas (m 3/kg ; ft 3/lb) R = Konstanta gas (joule/kg-mole ; ft. lb/lb-mole) T = Temperatur absolut gas (0 K ; 0 R)

Untuk massa m persamaan gas ideal dapat ditulis : P. V = m. R. T Dimana : V = volume gas sebenarnya (m 3 ; ft 3) M = massa gas (kg ; lb) Untuk jumlah mole gas persamaan gas ideal menjadi : Pv* = R 0 T

Atau : PV = n. R 0. T Dimana : n = jumlah mole gas (kg-mole ; lb-mole) v* = volume jenis molar (m 3/kg-mole ; ft 3/lb-mole) R 0 = konstanta gas universil (joule/kg-mole. 0 K ; ft. lb/lbmole. 0 R) Dengan: R = R 0/M Dimana : M = berat molekul gas (kg/kg-mole ; lb/lb-mole)

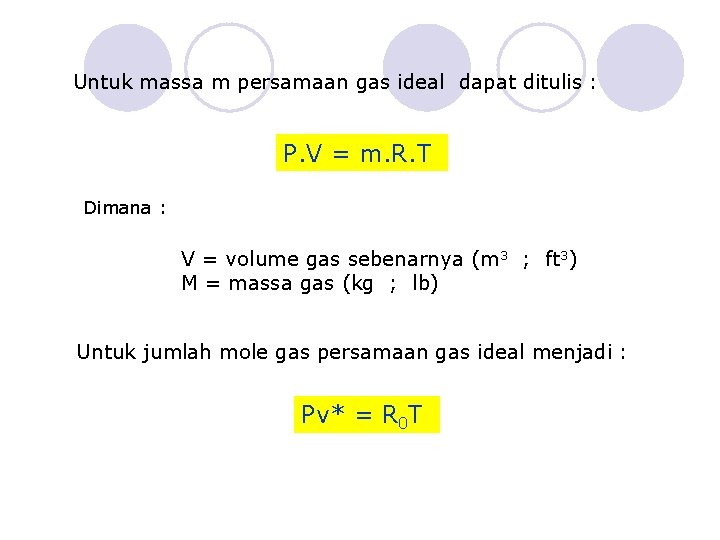
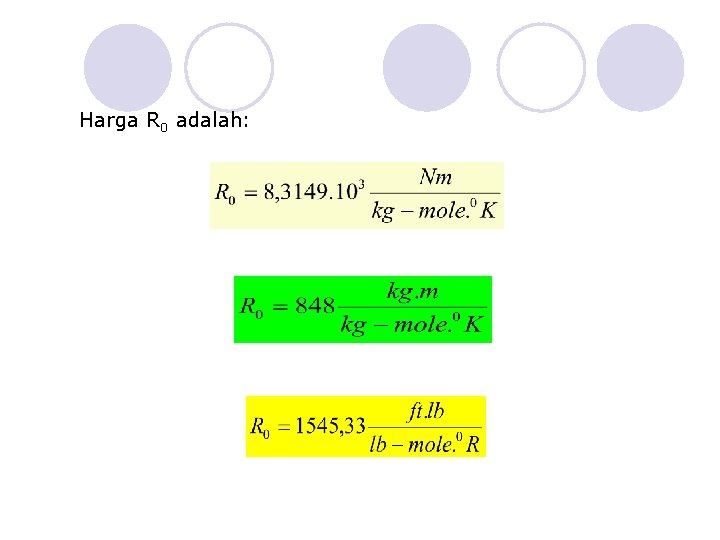
Harga R 0 adalah:

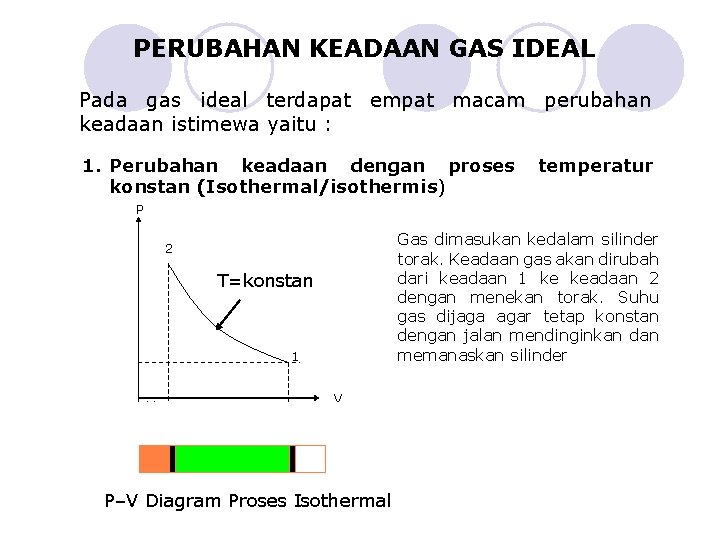
PERUBAHAN KEADAAN GAS IDEAL Pada gas ideal terdapat empat macam perubahan keadaan istimewa yaitu : 1. Perubahan keadaan dengan proses konstan (Isothermal/isothermis) temperatur P Gas dimasukan kedalam silinder torak. Keadaan gas akan dirubah dari keadaan 1 ke keadaan 2 dengan menekan torak. Suhu gas dijaga agar tetap konstan dengan jalan mendinginkan dan memanaskan silinder 2 T=konstan 1 V 2 V 1 V P–V Diagram Proses Isothermal

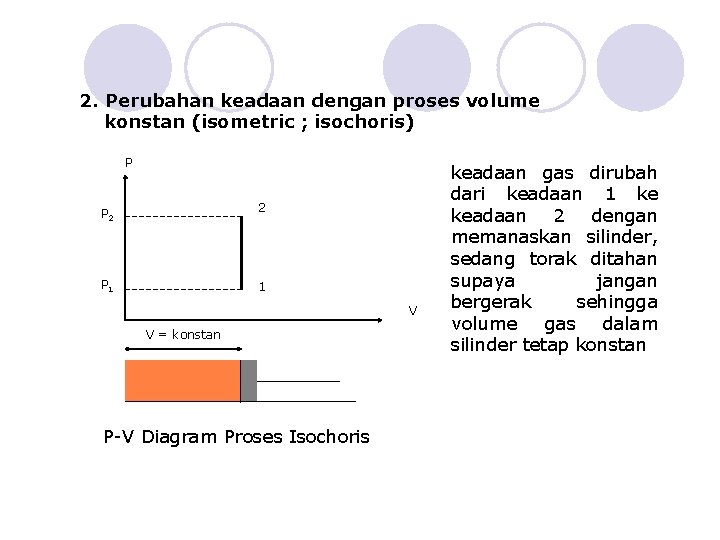
2. Perubahan keadaan dengan proses volume konstan (isometric ; isochoris) P 2 P 1 1 V V = konstan P-V Diagram Proses Isochoris keadaan gas dirubah dari keadaan 1 ke keadaan 2 dengan memanaskan silinder, sedang torak ditahan supaya jangan bergerak sehingga volume gas dalam silinder tetap konstan

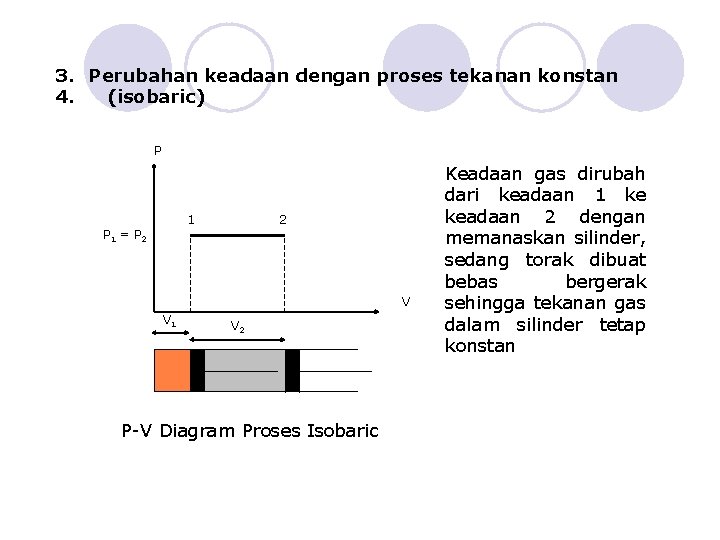
3. Perubahan keadaan dengan proses tekanan konstan 4. (isobaric) P 1 2 P 1 = P 2 V V 1 V 2 P-V Diagram Proses Isobaric Keadaan gas dirubah dari keadaan 1 ke keadaan 2 dengan memanaskan silinder, sedang torak dibuat bebas bergerak sehingga tekanan gas dalam silinder tetap konstan

HUKUM THERMODINAMIKA PERTAMA Bila kita berikan sejumlah panas kecil d. Q pada satu sistem, maka sistem tersebut akan berekspansi dan melakukan kerja luar yang kecil sebesar d. W.

HUKUM THERMODINAMIKA PERTAMA Tetapi disamping itu, pemanasan terhadap sistem juga akan menimbulkan hal-hal : 1. Pertambahan kecepatan molekul dari sistem. 2. Pertambahan jarak antara molekul-molekul sistem karena sistem berekspansi.

HUKUM THERMODINAMIKA PERTAMA Energi yang diperlukan untuk hal ini disebut pertambahan energi dalam (internal energy). Jadi panas d. Q sebagian dirubah untuk pertambahan energi dalam. Selain itu juga sistem mengalami pertambahan energi kinetik dan pertambahan energi potensial luar akibat gaya-gaya konservatif luar seperti gaya gravitasi dan lain-lain.

HUKUM THERMODINAMIKA PERTAMA Bila kita buat : d. U = Pertambahan energi dalam d. Ek = Pertambahan energi kinetik d. Ep = Pertambahan energi potensial luar. Maka dapatlah kita buat persamaan energi untuk sistem tadi : d. Q = d. W + d. U + d. Ek + d. Ep

HUKUM THERMODINAMIKA PERTAMA Persamaan ini menyatakan prinsip konservasi energi dari suatu sistem dan menjadi hukum thermodinamika pertama secara matematic. Tapi dalam persoalan thermodinamika, sistem -sistem sebagian besar mengalami energi kinetik dan energi potensial yang konstan (pada sistem-sistem yang diisolasi) atau d. Ek = 0 dan d. Ep = 0

HUKUM THERMODINAMIKA PERTAMA Maka hukum thermodinamika pertama menjadi : d. Q = d. U + d. W

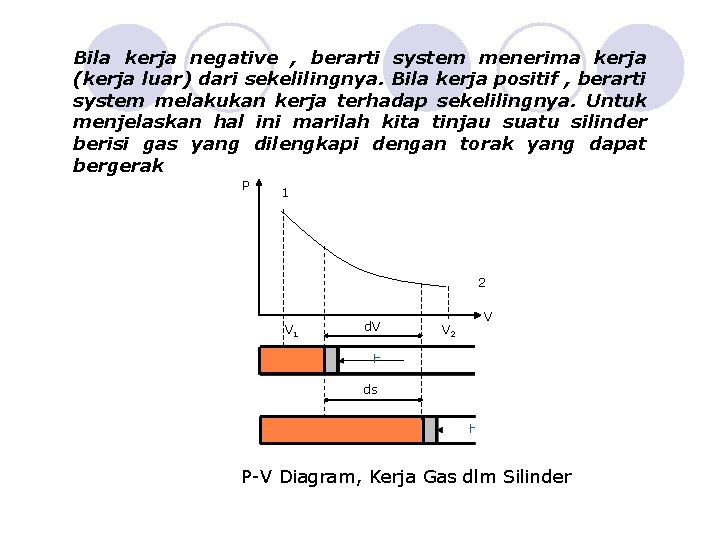
Bila kerja negative , berarti system menerima kerja (kerja luar) dari sekelilingnya. Bila kerja positif , berarti system melakukan kerja terhadap sekelilingnya. Untuk menjelaskan hal ini marilah kita tinjau suatu silinder berisi gas yang dilengkapi dengan torak yang dapat bergerak P 1 2 V 1 d. V V 2 V ds P-V Diagram, Kerja Gas dlm Silinder

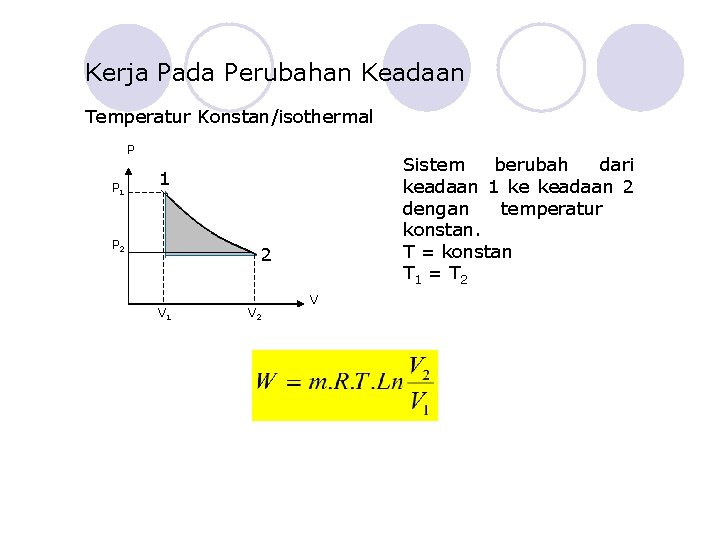
Kerja Pada Perubahan Keadaan Temperatur Konstan/isothermal P P 1 Sistem berubah dari keadaan 1 ke keadaan 2 dengan temperatur konstan. T = konstan T 1 = T 2 1 P 2 2 V 1 V 2 V

Tekanan Konstan/isobaric P P 1 = P 2 1 V 1 Sistem berubah dari keadaan 1 ke keadaan 2 dengan tekanan konstan. P = konstan P 1 = P 2 2 V W = P(V 2 – V 1) Volume Konstan W = 0 why?

PANAS JENIS (SPESIFIC HEAT) Bila pada suatu sistem diberikan panas d. Q hingga menaikan temperatur sistem sebesar d. T, maka perbandingan panas d. Q dengan kenaikan temperatur d. T disebut kapasitas panas dari sistem. Bila C adalah kapasitas panas dari sistem, maka :

Bila proses berjalan dengan volume konstan, maka kapasitas panas tersebut diatas disebut dengan kapasitas panas pada volume konstan disimbolkan dengan Cv. Selanjutnya bila proses berjalan dengan tekanan konstan, maka kapasitas panas tersebut disebut dengan kapasitas panas pada tekanan konstan yang disimbolkan dengan Cp.

Kapasitas panas C persatuan massa m disebut panas jenis (specific heat) disimbol dengan c, jadi panas jenis suatu sistem adalah :

Panas yang masuk kesistem persatuan massa untuk perubahan temperatur d. T, besarnya : dq = c. d. T Untuk proses dengan volume konstan : dq = du = cv. d. T Untuk proses dengan tekanan konstan : dq = cp. d. T

Panas total yang masuk kesistem (untuk massa m), besarnya : d. Q = m. dq = m. cp. d. T atau :

Bila cp konstan, maka : Q = m. cp (T 2 – T 1) Untuk proses dengan volume konstan : Q = U 2 – U 1 = m cv (T 2 – T 1) Untuk semua gas dapat ditulis : cp – cv = R dimana : cp/cv = γ , maka : cv = R / (γ – 1) cp = γ. R / (γ – 1)

PENGGUNAAN HUKUM THERMODINAMIKA PERTAMA PROSES ADIABATIK Perubahan keadaan disebut adiabatik bila tidak ada panas yang dikeluarkan/diterima sistem dari/terhadap sekelilingnya atau dq = 0.

PENGGUNAAN HUKUM THERMODINAMIKA PERTAMA Hal ini dimungkinkan bila sistem diisolasi. Kejadian ini terjadi pada motor-motor bakar jenis diesel, pada akhir kompresi temperatur udara sangat tinggi hingga sanggup membakar bahan bakar tanpa menggunakan bunga api.

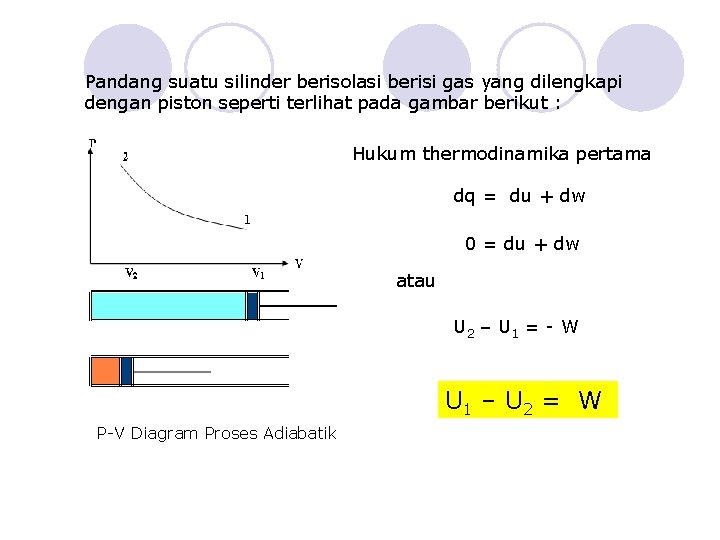
Pandang suatu silinder berisolasi berisi gas yang dilengkapi dengan piston seperti terlihat pada gambar berikut : Hukum thermodinamika pertama dq = du + dw 0 = du + dw atau U 2 – U 1 = - W U 1 – U 2 = W P-V Diagram Proses Adiabatik

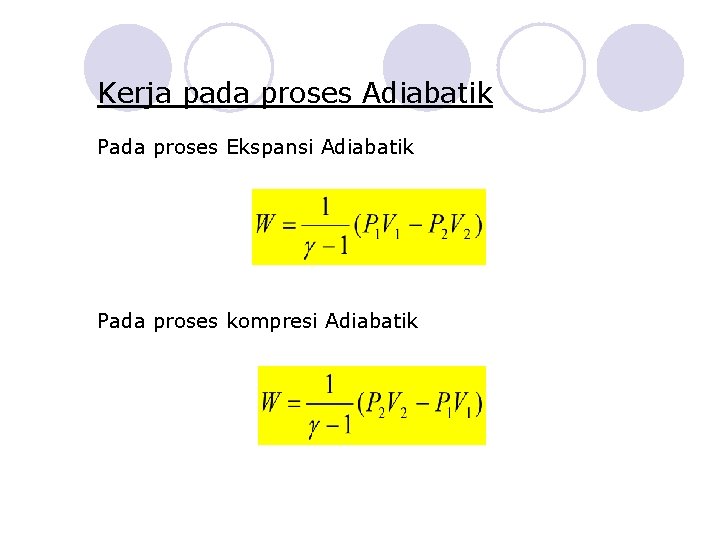
Kerja pada proses Adiabatik Pada proses Ekspansi Adiabatik Pada proses kompresi Adiabatik

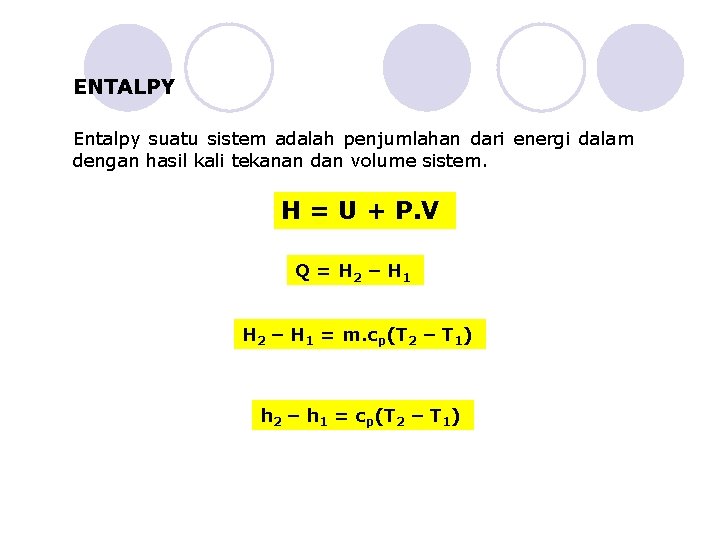
ENTALPY Entalpy suatu sistem adalah penjumlahan dari energi dalam dengan hasil kali tekanan dan volume sistem. H = U + P. V Q = H 2 – H 1 = m. cp(T 2 – T 1) h 2 – h 1 = cp(T 2 – T 1)

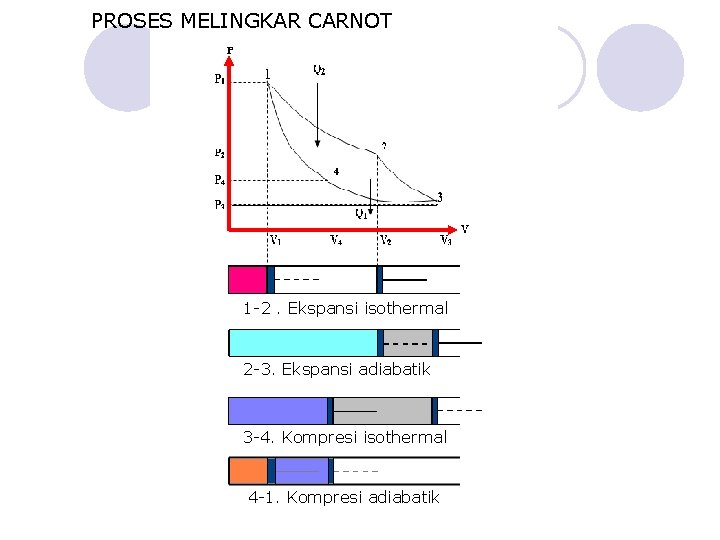
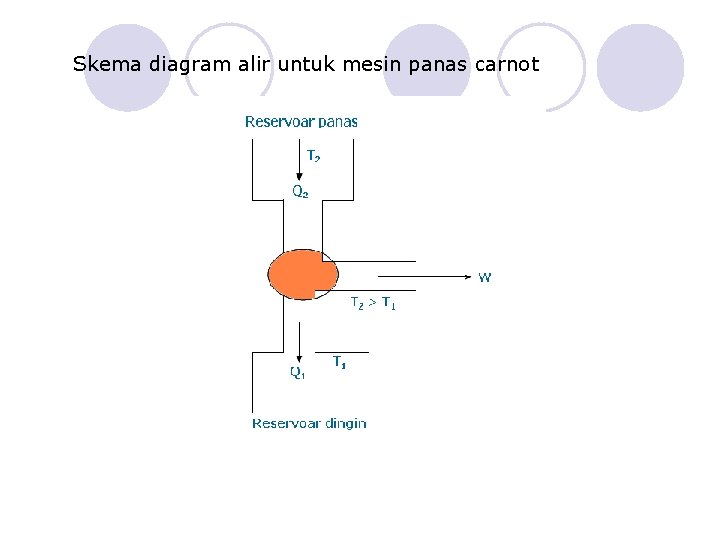
PROSES MELINGKAR CARNOT 1 -2. Ekspansi isothermal 2 -3. Ekspansi adiabatik 3 -4. Kompresi isothermal 4 -1. Kompresi adiabatik

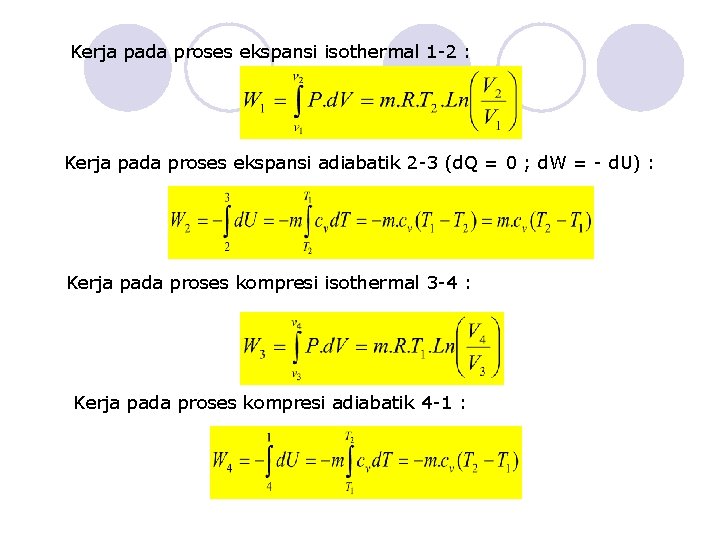
Kerja pada proses ekspansi isothermal 1 -2 : Kerja pada proses ekspansi adiabatik 2 -3 (d. Q = 0 ; d. W = - d. U) : Kerja pada proses kompresi isothermal 3 -4 : Kerja pada proses kompresi adiabatik 4 -1 :

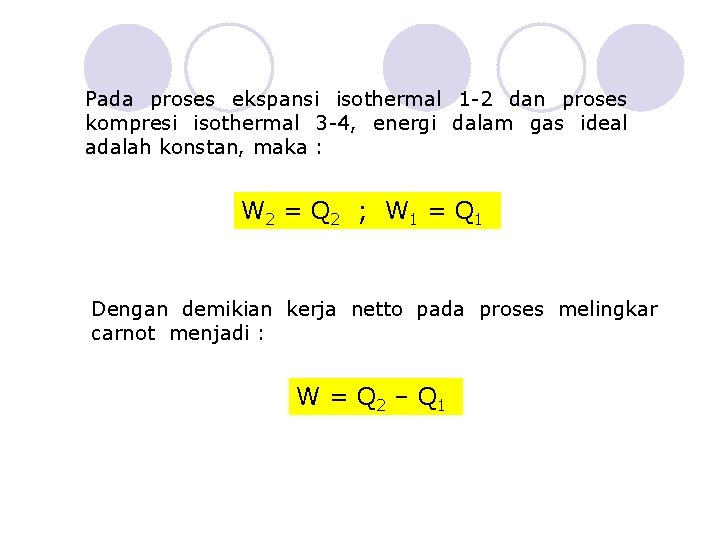
Pada proses ekspansi isothermal 1 -2 dan proses kompresi isothermal 3 -4, energi dalam gas ideal adalah konstan, maka : W 2 = Q 2 ; W 1 = Q 1 Dengan demikian kerja netto pada proses melingkar carnot menjadi : W = Q 2 – Q 1

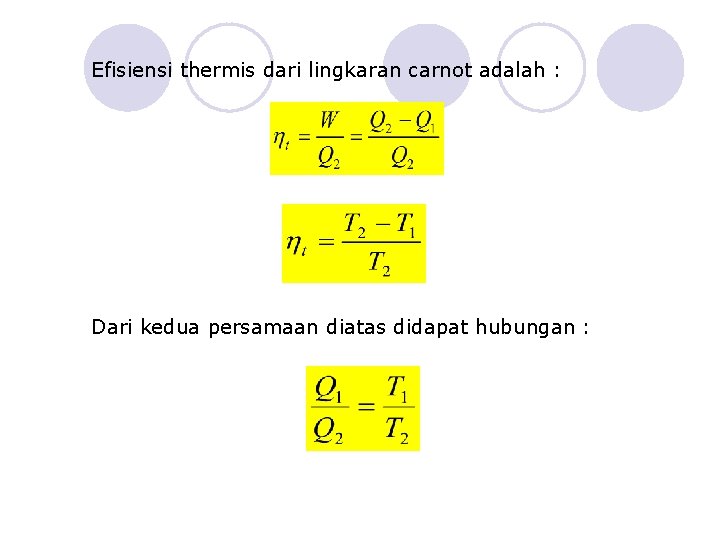
Efisiensi thermis dari lingkaran carnot adalah : Dari kedua persamaan diatas didapat hubungan :

Skema diagram alir untuk mesin panas carnot

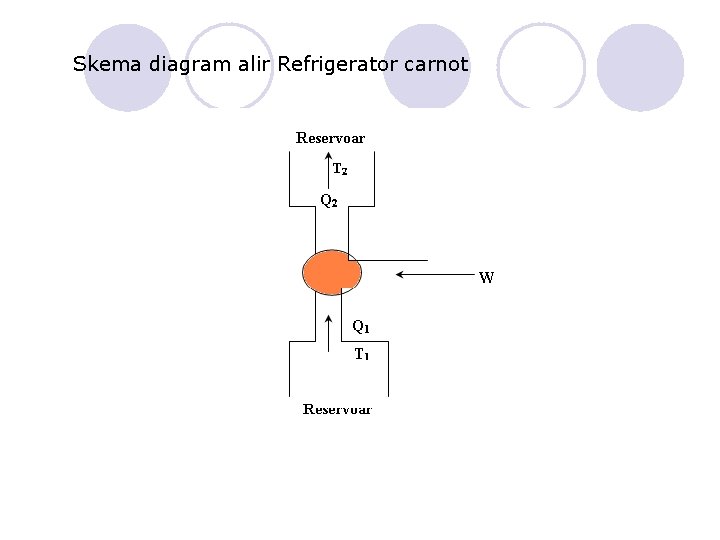
REFRIGERATOR (PENDINGIN) CARNOT Karena proses melingkar carnot reversibel, maka proses dapat dibalik adalah proses Proses yang dibalik ini disebut dengan refrigerator carnot. Jadi refrigerator carnot bekerja dengan kebalikan dari mesin panas carnot. Mesin carnot disebut dengan direct cycle sedang refrigerator carnot disebut reversed cycle Refrigerator carnot menerima kerja luar W dan menyerap panas Q 1 dari reservoar dingin (heat sink) temperatur T 1 serta memberikan panas Q 2 ke reservoar panas temperatur T 2

Skema diagram alir Refrigerator carnot

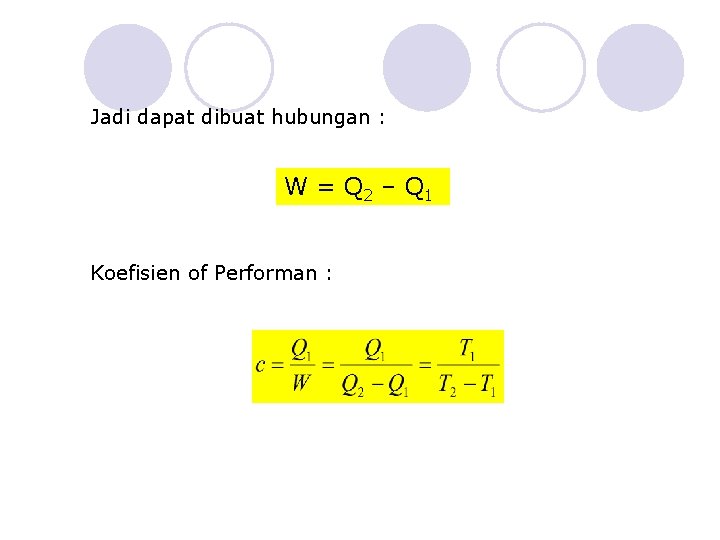
Jadi dapat dibuat hubungan : W = Q 2 – Q 1 Koefisien of Performan :
 Ilmu galenika adalah ilmu yang mempelajari tentang
Ilmu galenika adalah ilmu yang mempelajari tentang Unsur manusia
Unsur manusia Thermodinamika
Thermodinamika Thermodinamika
Thermodinamika Energi bebas gibbs
Energi bebas gibbs Meteorologi merupakan ilmu yang mempelajari
Meteorologi merupakan ilmu yang mempelajari Termokimia adalah cabang ilmu kimia yang mempelajarai ... *
Termokimia adalah cabang ilmu kimia yang mempelajarai ... * Kewirausahaan mempelajari tentang
Kewirausahaan mempelajari tentang Stoikiometri adalah ilmu yang mempelajari tentang
Stoikiometri adalah ilmu yang mempelajari tentang Kriptografi adalah ilmu yang mempelajari tentang
Kriptografi adalah ilmu yang mempelajari tentang Ilmu yang mempelajari tentang fluida tak mengalir disebut
Ilmu yang mempelajari tentang fluida tak mengalir disebut Anatomi topografi
Anatomi topografi Periklinal adalah
Periklinal adalah Imunologi adalah ilmu yang mempelajari tentang
Imunologi adalah ilmu yang mempelajari tentang Tanggung jawab sosial manajer
Tanggung jawab sosial manajer Manusia menurut pandangan ilmiah dan filsafat
Manusia menurut pandangan ilmiah dan filsafat Apa pandangan gereja tentang dunia
Apa pandangan gereja tentang dunia Cabang cabang fisika
Cabang cabang fisika Gambar model sistem umum perusahaan
Gambar model sistem umum perusahaan Hubungan ilmu politik dengan ilmu lainnya
Hubungan ilmu politik dengan ilmu lainnya Hubungan ilmu farmasi dengan ilmu fisika
Hubungan ilmu farmasi dengan ilmu fisika Perbedaan ilmu alamiah dasar dan ilmu pengetahuan alam
Perbedaan ilmu alamiah dasar dan ilmu pengetahuan alam Hubungan antropologi dengan ilmu lain
Hubungan antropologi dengan ilmu lain Struktur ilmu pengetahuan filsafat ilmu
Struktur ilmu pengetahuan filsafat ilmu Hubungan ilmu akhlak dengan ilmu tasawuf
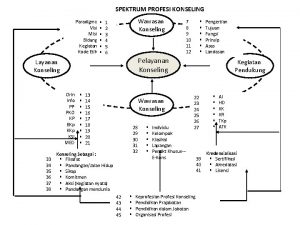
Hubungan ilmu akhlak dengan ilmu tasawuf Konseling sebagai pandangan yang mendunia
Konseling sebagai pandangan yang mendunia Keintelektualan dalam profesi konseling
Keintelektualan dalam profesi konseling Konsep seni bergaul
Konsep seni bergaul Sanitasi tempat umum adalah
Sanitasi tempat umum adalah Aum ptsdl
Aum ptsdl Sejarah singkat perkembangan ips di indonesia
Sejarah singkat perkembangan ips di indonesia Jelaskan tentang prinsip umum perencanaan alur pelayaran
Jelaskan tentang prinsip umum perencanaan alur pelayaran Pengenalan tentang gambaran umum
Pengenalan tentang gambaran umum Pertanyaan tentang karakteristik peserta didik
Pertanyaan tentang karakteristik peserta didik Pertanyaan tentang asbabun nuzul
Pertanyaan tentang asbabun nuzul Hubungan semantik dengan ilmu lain pdf
Hubungan semantik dengan ilmu lain pdf Ayat al-qur'an tentang menghargai waktu dan menuntut ilmu
Ayat al-qur'an tentang menghargai waktu dan menuntut ilmu Kapan penggambaran pandangan sebagian dapat digunakan
Kapan penggambaran pandangan sebagian dapat digunakan Verryn stuart mengemukakan ada dua tugas bank yaitu
Verryn stuart mengemukakan ada dua tugas bank yaitu Algoritma sekuensial
Algoritma sekuensial Batuan meteorit dan eksosfer umumnya hancur di lapisan
Batuan meteorit dan eksosfer umumnya hancur di lapisan Termokimia adalah
Termokimia adalah Eksoterm
Eksoterm Termokimia adalah cabang ilmu kimia yang mempelajari
Termokimia adalah cabang ilmu kimia yang mempelajari Al-kulliyah fit-thibb ibnu rusyd
Al-kulliyah fit-thibb ibnu rusyd Gambar penyepuhan logam
Gambar penyepuhan logam Pseudocode test
Pseudocode test Gambar proyeksi amerika
Gambar proyeksi amerika Potongan setempat
Potongan setempat Pancasila pandangan hidup bangsa
Pancasila pandangan hidup bangsa Gambar pandangan setempat
Gambar pandangan setempat Pandangan klasik keynes dan pendekatan masa kini
Pandangan klasik keynes dan pendekatan masa kini Gambar pandangan tambahan
Gambar pandangan tambahan Pandangan supresi freud
Pandangan supresi freud Ciri ciri prinsip pandangan hidup islam
Ciri ciri prinsip pandangan hidup islam