TEMA 4 DIFUSIN 1 DIFUSIN l l l

















- Slides: 29

TEMA 4: DIFUSIÓN 1

DIFUSIÓN l l l l INTRODUCCIÓN MECANISMOS DE DIFUSION LEYES DE FICK COEFICIENTE DE DIFUSION FACTORES DE LOS QUE DEPENDE LA DIFUSION INFLUENCIA DEL TIPO DE SÓLIDO APLICACIONES INDUSTRIALES DE LA DIFUSION PROBLEMAS 2

INTRODUCCIÓN DIFUSIÓN: Es el movimiento de átomos en un material con el fin de eliminar las diferencias de concentración y llegar a una composición homogénea y uniforme Ejemplos: Aleaciones, tratamientos térmicos, tratamientos superficiales de endurecimiento, conductividad térmica, transistores, etc… 3

INTRODUCCIÓN RITMO DE DIFUSION O MOVIMIENTO ATOMICO. – Los átomos y también los defectos, se desplazan en el material dependiendo de su energía térmica (excitación) y por tanto de su temperatura – determinada temperatura, T, tienen una energía mayor o igual que E*, esto es: N = N 0 exp(-E* / RT) 4

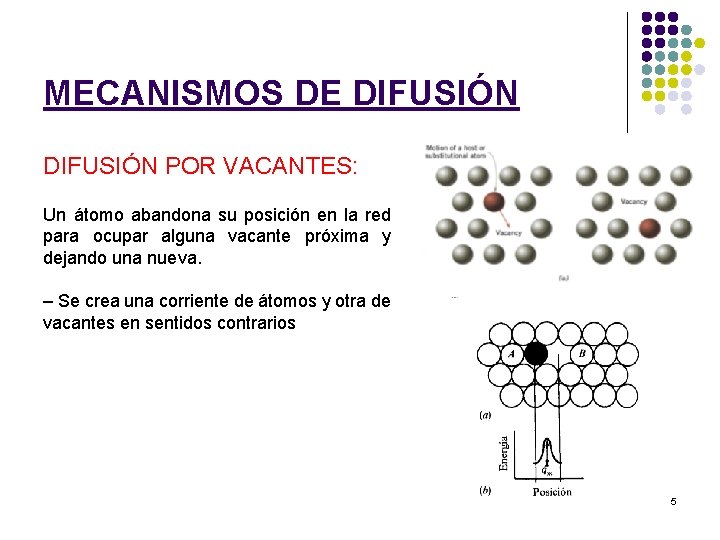
MECANISMOS DE DIFUSIÓN POR VACANTES: Un átomo abandona su posición en la red para ocupar alguna vacante próxima y dejando una nueva. – Se crea una corriente de átomos y otra de vacantes en sentidos contrarios 5

MECANISMOS DE DIFUSIÓN INTERSTICIAL: Los átomos intersticiales se difunden a otros puntos intersticiales. – Se crea una corriente de átomos y otra de puntos intersticiales vacantes en sentidos contrarios – Este proceso de difusión es más rápido y fácil que el debido a las vacantes pues los intersticios existen siempre (no se necesita una energía adicional para su creación) 6

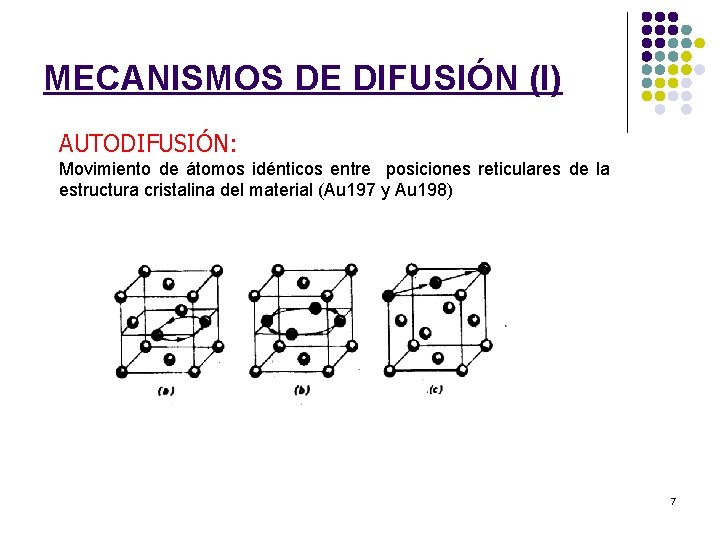
MECANISMOS DE DIFUSIÓN (I) AUTODIFUSIÓN: Movimiento de átomos idénticos entre posiciones reticulares de la estructura cristalina del material (Au 197 y Au 198) 7

MECANISMOS DE DIFUSIÓN HETERODIFUSIÓN: Distintos átomos intercambian sus posiciones en la red (soldadura de dos materiales Ni y Cu) 8

MECANISMOS DE DIFUSIÓN • Un átomo debe abrirse paso entre los átomos circundantes para su difusión a otro sitio. Este proceso requiere superar cierta barrera energética (energía de activación), E* • Sólo los átomos con una energía térmica mayor o igual a E* podrán difundirse de un punto a otro del material 9

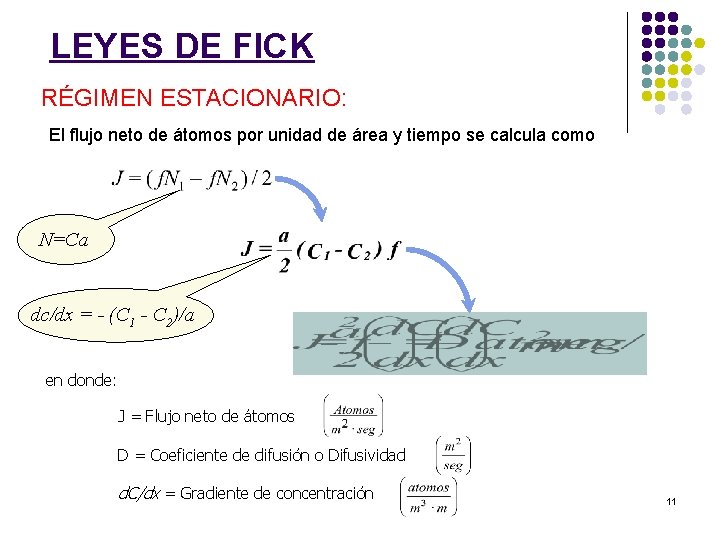
LEYES DE FICK RÉGIMEN ESTACIONARIO: -La variación de concentración a lo largo de la distancia de separación es dc/dx = - (C 1 - C 2)/a -El flujo neto de átomos a través de una superficie es N el nº de átomos por unidad de superficie en cada plano y f la frecuencia de salto. calculándose N como N=Ca C el nº de átomos por unidad de volumen y a la superficie. 10

LEYES DE FICK RÉGIMEN ESTACIONARIO: El flujo neto de átomos por unidad de área y tiempo se calcula como N=Ca dc/dx = - (C 1 - C 2)/a en donde: J = Flujo neto de átomos D = Coeficiente de difusión o Difusividad d. C/dx = Gradiente de concentración 11

LEYES DE FICK 1ºLEY DE FICK Determina el flujo neto de átomos, J, que se difunden de una región a otra dentro del material. donde dc es la diferencia en la concentración de átomos a lo largo de una distancia dx dentro del material, D es el coeficiente de difusión y dc/dx es el gradiente de concentración. Según la 1ª ley de Fick, a una temperatura dada J es constante. ¡En realidad J(T, t, …. ) y no es constante! Objeciones: - Con el tiempo, las concentraciones tienden a igualarse y J disminuye - D(T, t) - Otros factores… 12

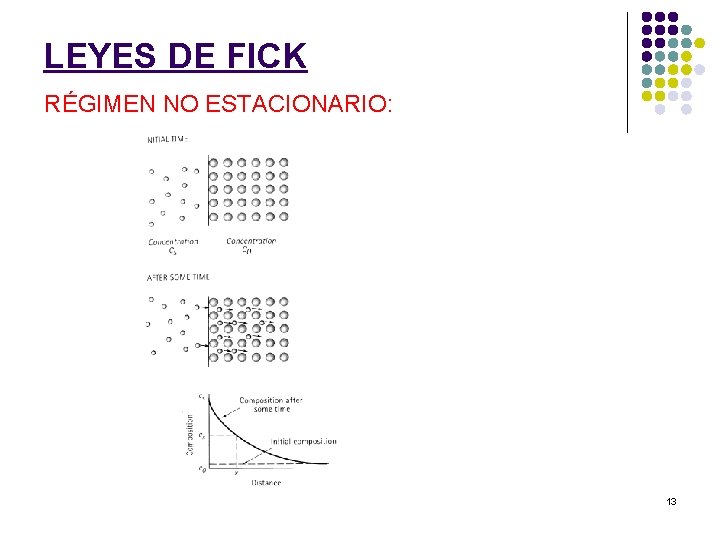
LEYES DE FICK RÉGIMEN NO ESTACIONARIO: 13

LEYES DE FICK RÉGIMEN NO ESTACIONARIO: En los procesos reales, la concentración y el gradiente de concentración dependen del tiempo y de la distancia. J(x) y J(x+dx) < J(x) La variación de la concentración con el tiempo será: en donde J corresponde al flujo neto de átomos determinado por la 1ª Ley de Fick. 14

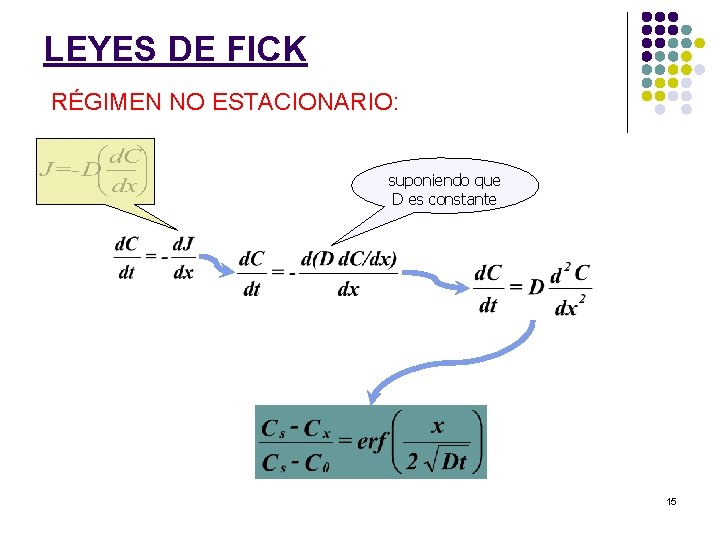
LEYES DE FICK RÉGIMEN NO ESTACIONARIO: suponiendo que D es constante 15

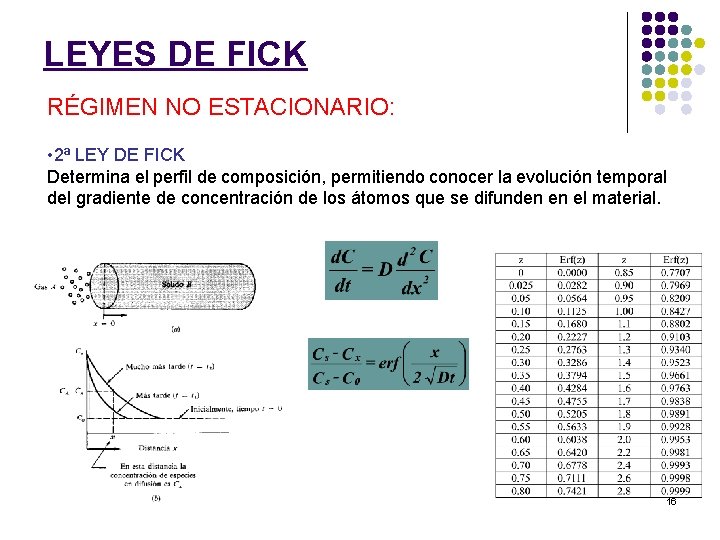
LEYES DE FICK RÉGIMEN NO ESTACIONARIO: • 2ª LEY DE FICK Determina el perfil de composición, permitiendo conocer la evolución temporal del gradiente de concentración de los átomos que se difunden en el material. 16

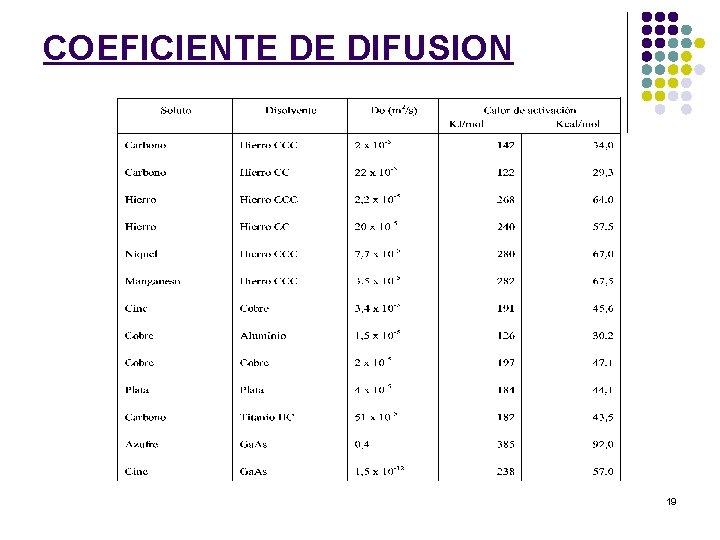
COEFICIENTE DE DIFUSION El COEFICIENTE DE DIFUSION D se determina a partir de la expresión del flujo J tal que La posibilidad de que un átomo abandone su posición de equilibrio y se desplace hacia otra posición cercana, implica la superación de una barrera energética, denominada energía de activación. siendo υ la frecuencia de vibración. 17

COEFICIENTE DE DIFUSIÓN siendo: D = Coeficiente de difusión o difusividad (m 2/seg) D 0 = Constante independiente del tiempo y función del sistema (m 2/seg) Q = Energía de activación (J/mol; cal/mol) R = Cte. Molar gases = 1, 987 cal/mol·K = 8, 314 J/mol·K = 1, 38· 10 -23 J/at·K (Cte. Boltzmann) 18

COEFICIENTE DE DIFUSION 19

FACTORES DE LOS QUE DEPENDE LA DIFUSIÓN. MECANISMO DE DIFUSIÓN La difusión intersticial de pequeños átomos en redes de disolventes con átomos grandes es más fácil que la difusión por sustitución en átomos de tamaño similar. • TEMPERATURA Este factor tiene gran influencia sobre la difusión. A medida que la temperatura aumenta la difusión es más fácil debido a que crece el coeficiente de difusión. 20

FACTORES DE LOS QUE DEPENDE LA DIFUSIÓN l ESTRUCTURA CRISTALINA: el tipo influye debido al distinto espaciado interatómico en las redes. El factor de empaquetamiento nos da una idea de los espacios intersticiales que existen en cada red. A menor factor de empaquetamiento más fácil es la posibilidad de movimiento de los átomos a través de los huecos. l IMPERFECCIONES CRISTALINAS: Al aumentar estas se producen más huecos en la red matriz, siendo las estructuras más abiertas y produciéndose mayor movimiento atómico. l TAMAÑO DEL GRANO: Al ser este más pequeño, la superficie del límite de grano aumenta, y por tanto la difusión. 21

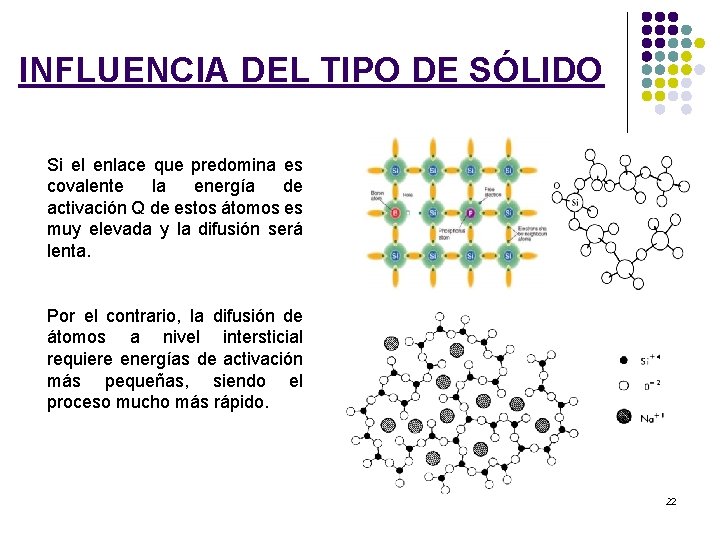
INFLUENCIA DEL TIPO DE SÓLIDO Si el enlace que predomina es covalente la energía de activación Q de estos átomos es muy elevada y la difusión será lenta. Por el contrario, la difusión de átomos a nivel intersticial requiere energías de activación más pequeñas, siendo el proceso mucho más rápido. 22

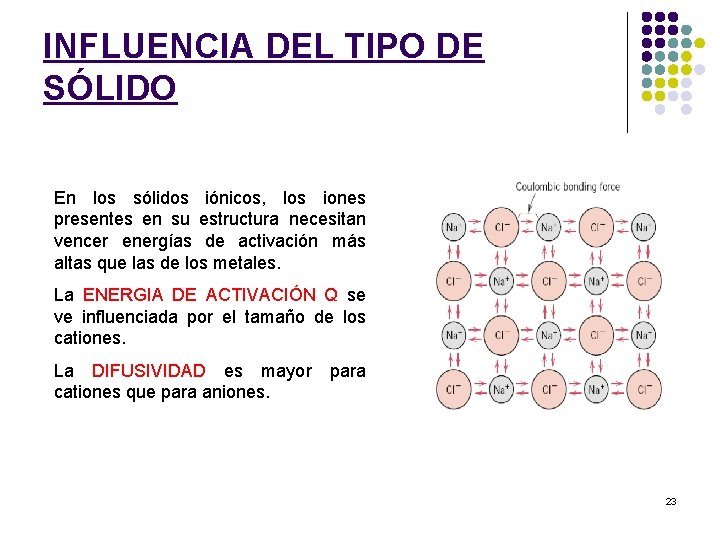
INFLUENCIA DEL TIPO DE SÓLIDO En los sólidos iónicos, los iones presentes en su estructura necesitan vencer energías de activación más altas que las de los metales. La ENERGIA DE ACTIVACIÓN Q se ve influenciada por el tamaño de los cationes. La DIFUSIVIDAD es mayor cationes que para aniones. para 23

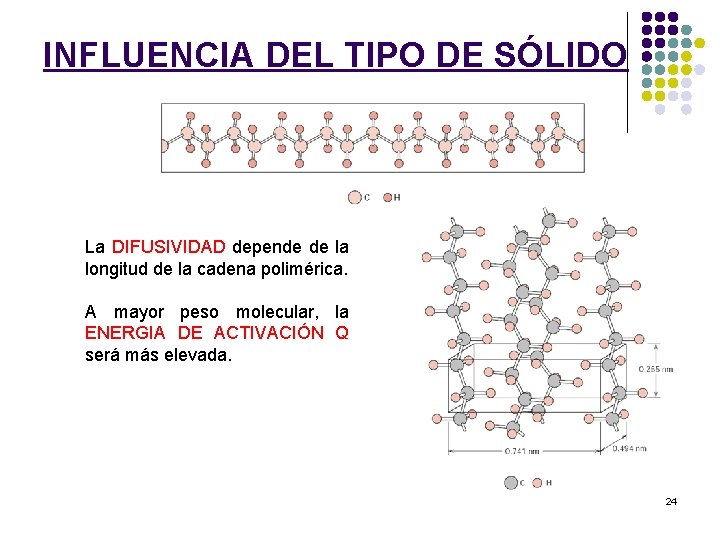
INFLUENCIA DEL TIPO DE SÓLIDO La DIFUSIVIDAD depende de la longitud de la cadena polimérica. A mayor peso molecular, la ENERGIA DE ACTIVACIÓN Q será más elevada. 24

INFLUENCIA DEL TIPO DE SÓLIDO 25

APLICACIONES INDUSTRIALES DE LA DIFUSIÓN TRATAMIENTOS TERMOQUÍMICOS 26

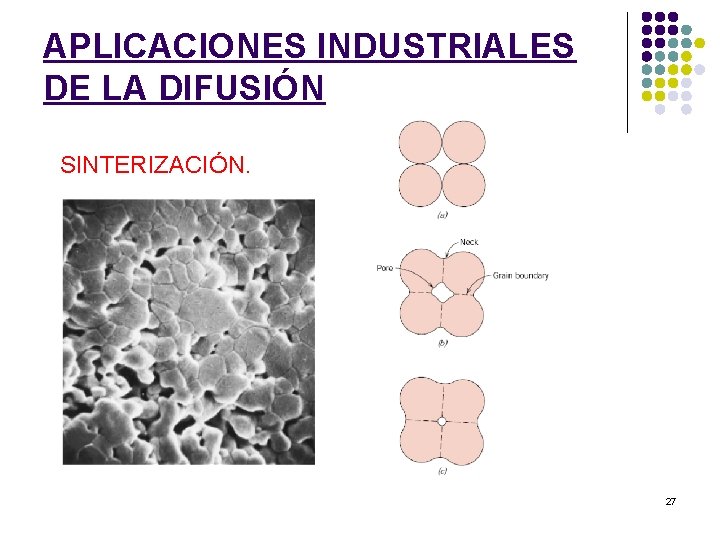
APLICACIONES INDUSTRIALES DE LA DIFUSIÓN SINTERIZACIÓN. 27

APLICACIONES INDUSTRIALES DE LA DIFUSIÓN TRATAMIENTOS TÉRMICOS. 28

APLICACIONES INDUSTRIALES DE LA DIFUSIÓN OBTENCIÓN DE ELEMENTOS CON ALTO GRADO DE PUREZA. 29
 Difusin
Difusin Aliran ini umumnya ditandai oleh tema-tema yang fantastis
Aliran ini umumnya ditandai oleh tema-tema yang fantastis Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Ejemplo de delimitacion del tema
Ejemplo de delimitacion del tema El tema y sub tema
El tema y sub tema Ventajas de una entrevista
Ventajas de una entrevista Temas de multimedia
Temas de multimedia Pop art kunst
Pop art kunst Tema 1 titulo
Tema 1 titulo Tema 28 escola de aprendizes do evangelho
Tema 28 escola de aprendizes do evangelho Tema as auginu
Tema as auginu Tema pedagogia
Tema pedagogia Un tema muy interesante
Un tema muy interesante Tema del diverso
Tema del diverso Tema de medidas
Tema de medidas Vodenpauk
Vodenpauk Romeo and juliet tema
Romeo and juliet tema Isnma
Isnma Nox et solitudo rozbor
Nox et solitudo rozbor Puteje kahulugan
Puteje kahulugan Contoh karangan formal
Contoh karangan formal Resumen la metamorfosis de kafka
Resumen la metamorfosis de kafka Analisis taksonomi adalah
Analisis taksonomi adalah Bodas de sangre resumen por actos
Bodas de sangre resumen por actos Derivação imprópria
Derivação imprópria Cerpen senyum karyamin beserta strukturnya
Cerpen senyum karyamin beserta strukturnya Komponen utama sig terdiri atas
Komponen utama sig terdiri atas Juan 10 1 18
Juan 10 1 18 Nord e sud del mondo tema argomentativo
Nord e sud del mondo tema argomentativo Tema y rema ejemplos
Tema y rema ejemplos