STRUKTURA LTEK MOLEKULOV FYZIKA A TERMIKA SKUPENSK PEMNY







































![REFERENCE 1. KRYNICKÝ, Martin. Elektronické učebnice matematiky a fyziky. [online]. 2013 -01 -28 [cit. REFERENCE 1. KRYNICKÝ, Martin. Elektronické učebnice matematiky a fyziky. [online]. 2013 -01 -28 [cit.](https://slidetodoc.com/presentation_image_h2/ec710ee03ace907cb3b1b7847ece62b0/image-58.jpg)
- Slides: 58

STRUKTURA LÁTEK, MOLEKULOVÁ FYZIKA A TERMIKA, SKUPENSKÉ PŘEMĚNY Antonín Procházka

TERMODYNAMIKA § Nauka o vlastnostech látek spojených s teplem a tepelnými jevy § Původní termodynamika se zabývá látkami jako celkem (termodynamický systém) Dnes víme, jak látky vypadají na částicové úrovni, což nám může pomoct k pochopení chování látek jako celku

KINETICKÁ TEORIE STAVBY LÁTEK § Vznik koncem 19. století Tři poznatky: 1. Látky jakéhokoliv skupenství jsou tvořeny částicemi. 2. Částice vykonávají neustálý a neuspořádaný pohyb. 3. Mezi částicemi působí přitažlivé a odpudivé síly s ohledem na vzdálenost mezi nimi.

1. LÁTKA SE SKLÁDÁ Z ČÁSTIC Částicí myslíme: A) Atomy B) Molekuly C) Ionty Obr. : Krystalická látka (Grafen) pod elektronovým mikroskopem

2. POHYB ČÁSTIC Rychlost pohybu se s teplotou zvyšuje Teoreticky by se zastavily při dosažení teploty absolutní nuly (0 K), ale té dle 3. termodynamického zákona nelze dosáhnout

2. POHYB ČÁSTIC BROWNŮV POHYB

2. POHYB ČÁSTICE Cekem rozeznáváme tři typy pohybu částic Ale ne všechny částice vykonávají všechny tři typy pohybu 1. Posuvný (translační ) 2. Otáčivý (rotační) víceatomové molekuly 3. Kmitavý (vibrační)

3. ČÁSTICE NA SEBE PŮSOBÍ SILAMI

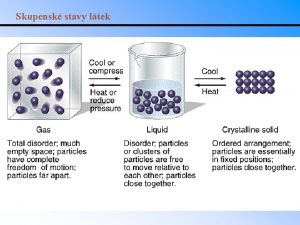
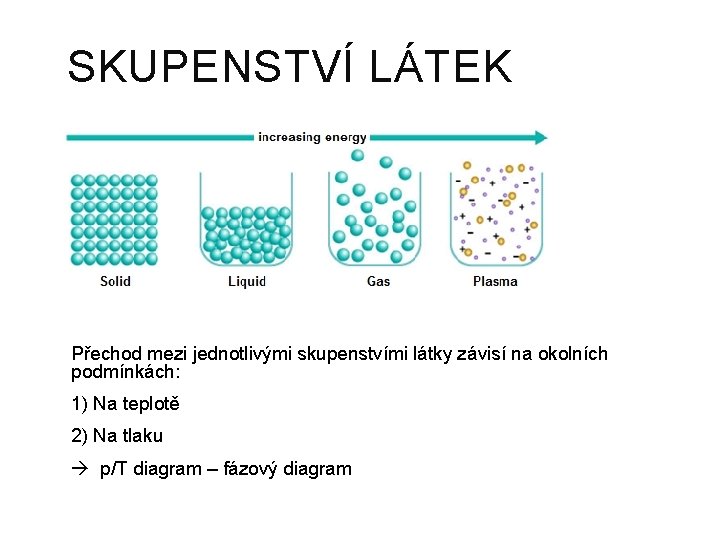
SKUPENSTVÍ LÁTEK Přechod mezi jednotlivými skupenstvími látky závisí na okolních podmínkách: 1) Na teplotě 2) Na tlaku p/T diagram – fázový diagram

PLYNNÉ SKUPENSTVÍ § Velká vzdálenost mezi molekulami § Základní vlastnost plynů rozpínavost ukazuje, že mezi molekulami působí jen slabé přitažlivé síly § Rovnoměrný přímočarý pohyb molekul dokud nenarazí na jiné molekuly Ideální plyn: 1) Dokonale stlačitelný 2) Dokonale tekutý 3) Molekuly ideálního plynu nepůsobí na sebe navzájem silami - potenciální energie soustavy molekul ideálního plynu je nulová, vnitřní energie je dána pouze kinetickou energií molekul

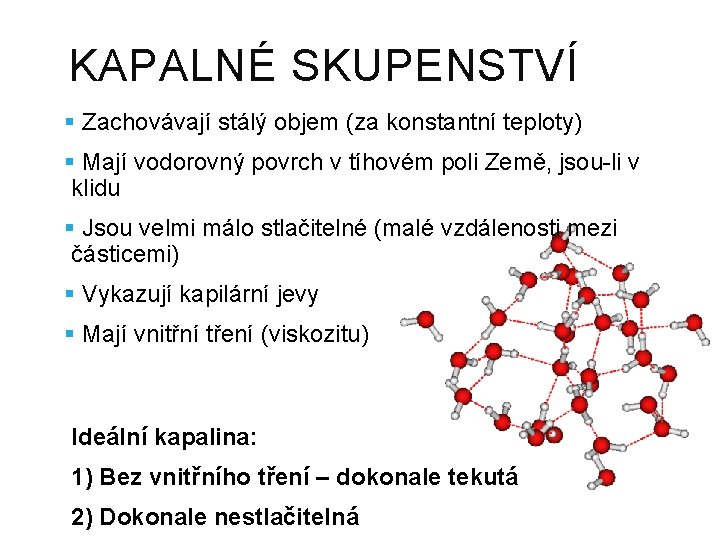
KAPALNÉ SKUPENSTVÍ § Zachovávají stálý objem (za konstantní teploty) § Mají vodorovný povrch v tíhovém poli Země, jsou-li v klidu § Jsou velmi málo stlačitelné (malé vzdálenosti mezi částicemi) § Vykazují kapilární jevy § Mají vnitřní tření (viskozitu) Ideální kapalina: 1) Bez vnitřního tření – dokonale tekutá 2) Dokonale nestlačitelná

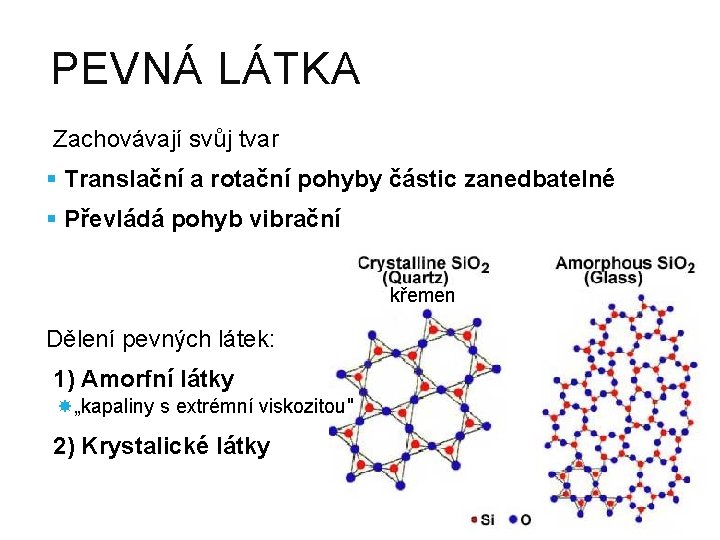
PEVNÁ LÁTKA Zachovávají svůj tvar § Translační a rotační pohyby částic zanedbatelné § Převládá pohyb vibrační křemen Dělení pevných látek: 1) Amorfní látky „kapaliny s extrémní viskozitou" 2) Krystalické látky

PLASMA – „IONIZOVANÝ PLYN“

PLAZMA Volné nosiče náboje: atomy v plazmatu jsou alespoň částečně ionizované Většina molekul je roztrhaná, nebo jsou od nich odtrhnuty elektrony (v důsledku vysokého tlaku nebo teploty) Kvazineutralita – plazma se navenek jeví jako nenabitá tekutina – stejný počet kladně a záporně nabitých částic Plazma vykazuje „kolektivní chování“ – navenek generuje globální elektrická a magnetická pole



VNITŘNÍ ENERGIE A TEPLOTA Vnitřní energie Částicový systém má vždy nějakou energii v důsledku neustálého pohybu částic. Je dána kinetikou energií v důsledku translačního, rotačního a vibračního pohybu, a dále pak potenciální energií mikroskopických sil (např. chem. vazeb) Teplota Dána pohybem částic – „manifestace vnitřní energie“ Při vyšší teplotě se částice pohybují rychleji

TEPLOTNÍ STUPNICE

PRVNÍ ZÁKON TERMODYNAMIKY Změna vnitřní energie může nastat: 1. Konáním práce třecí síla, stlačování plynu kompresorem 2. Tepelnou výměnou děj, při kterém neuspořádaně pohybující se částice teplejšího tělesa narážejí do částic studenějšího tělesa a odevzdávají mu část své energie.

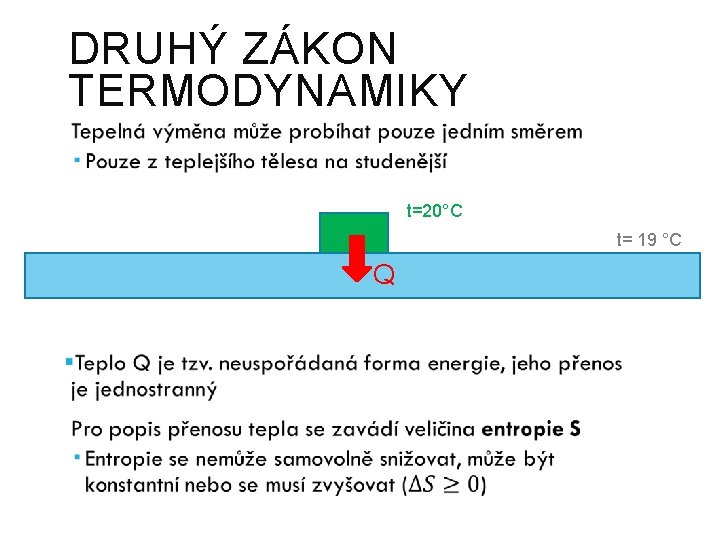
DRUHÝ ZÁKON TERMODYNAMIKY t=20°C t= 19 °C Q

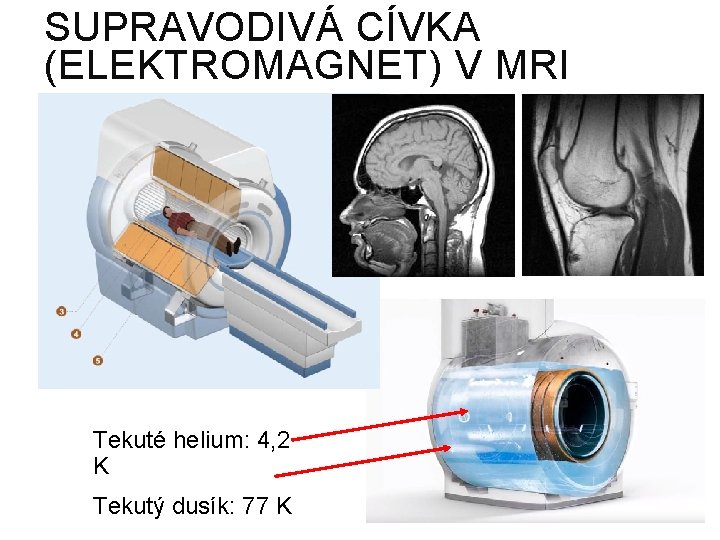
TŘETÍ ZÁKON TERMODYNAMIKY Teploty absolutní nuly (0 K) nelze dosáhnout § Dnes už bylo dosaženo nižších teplot než 10 -9 K (u malých skupin atomů) Za velmi nízkých teplot se můžou látky chovat velice podivně Supratekutost kapalného hélia (pod 2 K) Supravodivost (u klasických vodičů pod 25 K) Bezodporové vedení proudu Supravodivá levitace

SUPRAVODIVÁ CÍVKA (ELEKTROMAGNET) V MRI Tekuté helium: 4, 2 K Tekutý dusík: 77 K

CO JE TO TEPLO? Teplo je energie, kterou při tepelné výměně odevzdá teplejší těleso chladnějšímu. c - měrná tepelná kapacita látky množství tepla, které musí přijmout 1 kg látky, aby se jeho teplota zvýšila o 1 Kelvin, či °C) Jednotkou tepla je Joule (je to forma energie)

MĚRNÁ TEPELNÁ KAPACITA VS. TEPELNÁ KAPACITA Měrná tepelná kapacita c (dříve „specifické teplo“): Teplo k ohřátí 1 kg látky Tepelná kapacita C: Teplo k ohřátí celku Vztah mezi tepelnou kapacitou a měr. tep. kap:

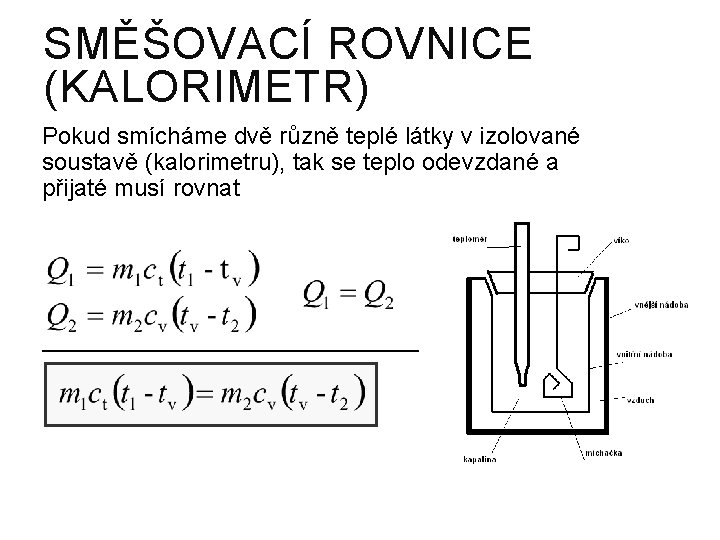
SMĚŠOVACÍ ROVNICE (KALORIMETR) Pokud smícháme dvě různě teplé látky v izolované soustavě (kalorimetru), tak se teplo odevzdané a přijaté musí rovnat


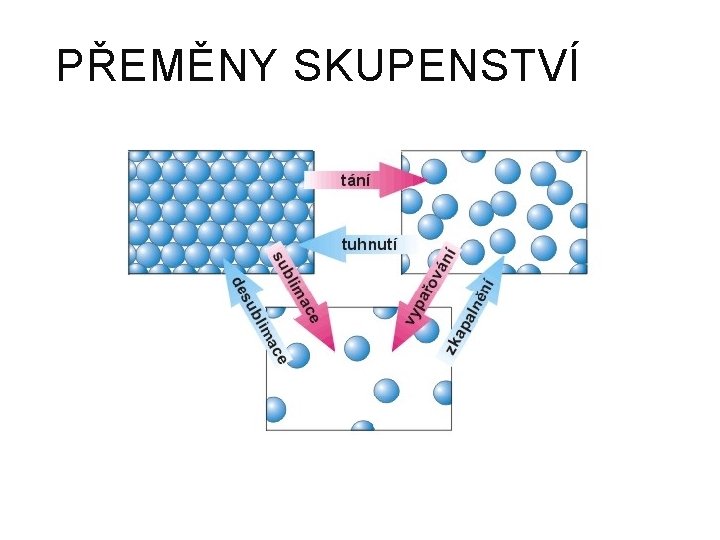
PŘEMĚNY SKUPENSTVÍ

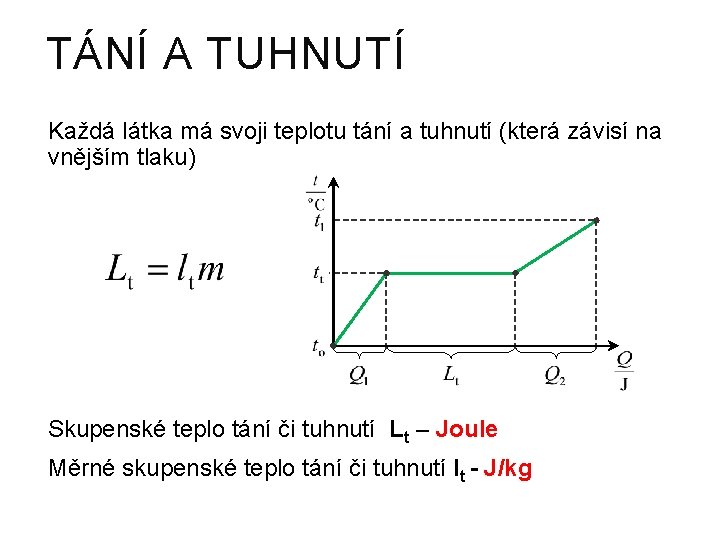
TÁNÍ A TUHNUTÍ Každá látka má svoji teplotu tání a tuhnutí (která závisí na vnějším tlaku) Skupenské teplo tání či tuhnutí Lt – Joule Měrné skupenské teplo tání či tuhnutí lt - J/kg

VYPAŘOVÁNÍ Na rozdíl od tání a tuhnutí dochází k vypařování při každé teplotě – kapalina se na povrchu mění v plyn a vypařuje se Var je vypařování v celém objemu kapaliny Teplota varu specifická pro každou látku Skupenské teplo varu – J Měrné skupenské teplo varu lv – J/kg

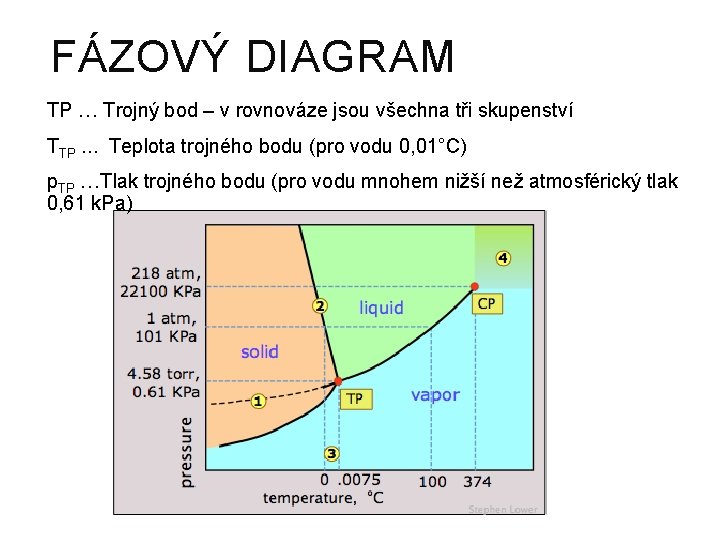
FÁZOVÝ DIAGRAM TP … Trojný bod – v rovnováze jsou všechna tři skupenství TTP. . . Teplota trojného bodu (pro vodu 0, 01°C) p. TP …Tlak trojného bodu (pro vodu mnohem nižší než atmosférický tlak 0, 61 k. Pa)

609. Počet fází ve stavu, který odpovídá kterémukoliv bodu v oblastech mezi křivkami fázového diagramu dané čisté látky je a) 1 b) 2 c) 3 d) 0 613. Ve fázovém diagramu látky je pod křivkou syté páry a) Oblast pevné látky b) Oblast kapaliny c) Oblast přehřáté páry d) Oblast syté páry



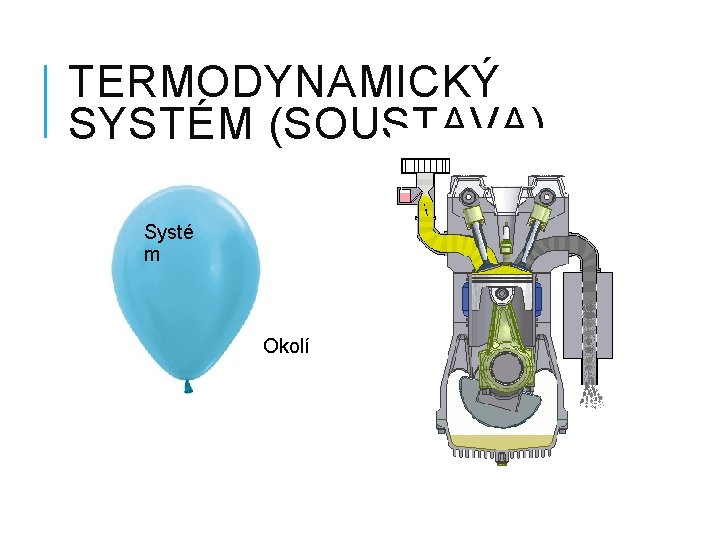
TERMODYNAMICKÝ SYSTÉM (SOUSTAVA) Systé m Okolí

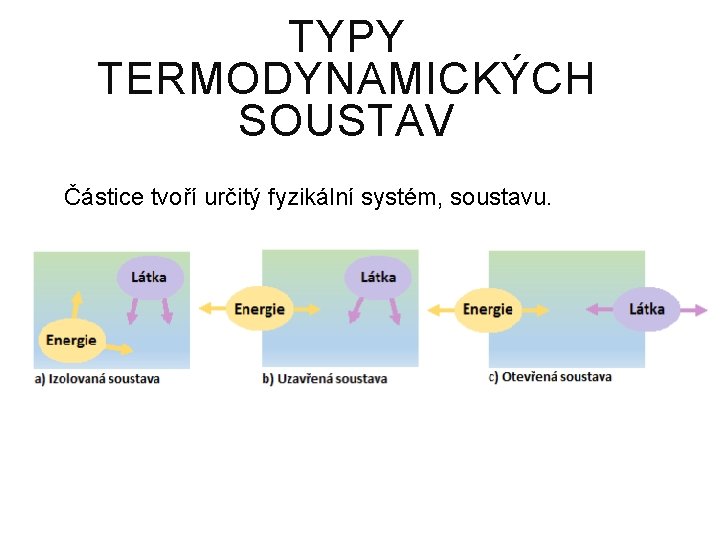
TYPY TERMODYNAMICKÝCH SOUSTAV Částice tvoří určitý fyzikální systém, soustavu.

VELIČINY CHARAKTERIZUJÍCÍ STAV FYZIKÁLNÍ SOUSTAVY Stav soustavy – nezáleží nám na procesu, jakým do tohoto stavu soustava dospěla. vnitřní energie U teplota T tlak p objem V počet částic N hmotnost m hustota ρ látkové množství n entropie S

VELIČINY POPISUJÍCÍ DĚJ SOUSTAVY Děj – zajímá nás proces, jakým se soustava dostane do určitého stavu. § teplo Q § práce W

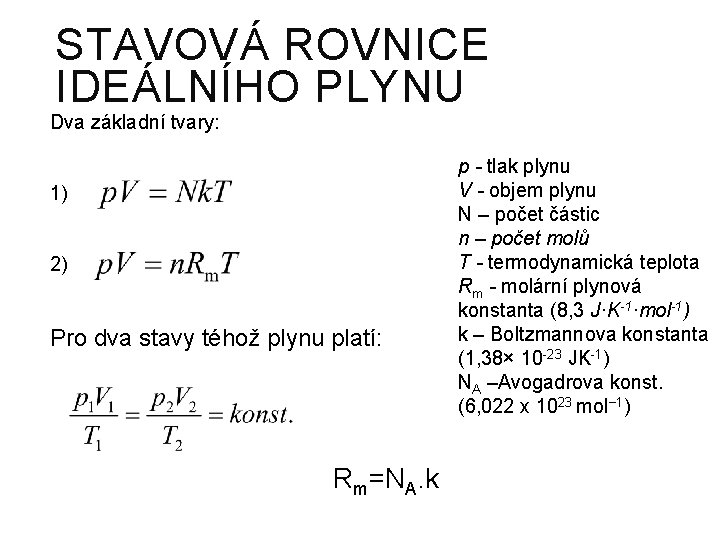
STAVOVÁ ROVNICE IDEÁLNÍHO PLYNU Dva základní tvary: 1) 2) Pro dva stavy téhož plynu platí: Rm=NA. k p - tlak plynu V - objem plynu N – počet částic n – počet molů T - termodynamická teplota Rm - molární plynová konstanta (8, 3 J·K-1·mol-1) k – Boltzmannova konstanta (1, 38× 10 -23 JK-1) NA –Avogadrova konst. (6, 022 x 1023 mol− 1)


IZOPROCESY IDEÁLNÍHO PLYNU Vyjadřují, co se děje v plynu, pokud zůstává jedna z veličin konstantní. Zajímají nás 3 věci: 1. Jak izoproces upraví rovnici ideálního plynu 2. Jak vypadá p/V diagram 3. Energetická bilance Jak se mění vnitřní energie (aplikace 1. termodynamického zákona) Plyn vykonává práci, pokud mění svůj objem Plyn mění svoji vnitřní energii, pokud se mění teplota

IZOBARICKÝ DĚJ Nemá-li se měnit tlak plynu, pak: při zahřívání se zvětšuje teplota a objem plynu, při ochlazování se zmenšuje teplota a objem plynu. Gay-Lussacův zákon Při izobarickém ději s ideálním plynem stálé hmotnosti je objem plynu přímo úměrný jeho termodynamické teplotě.

IZOBARICKÝ DĚJ II Částice se začnou pohybovat rychleji, chaotičtěji a pokud má zůstat tlak konstantní, musí začít expandovat do okolí – plyn koná práci. Energetická bilance: ΔU = Q + W Q = m. cp. ΔT W = p. ΔV cp … měrná tepelná kapacita při stálém tlaku 0

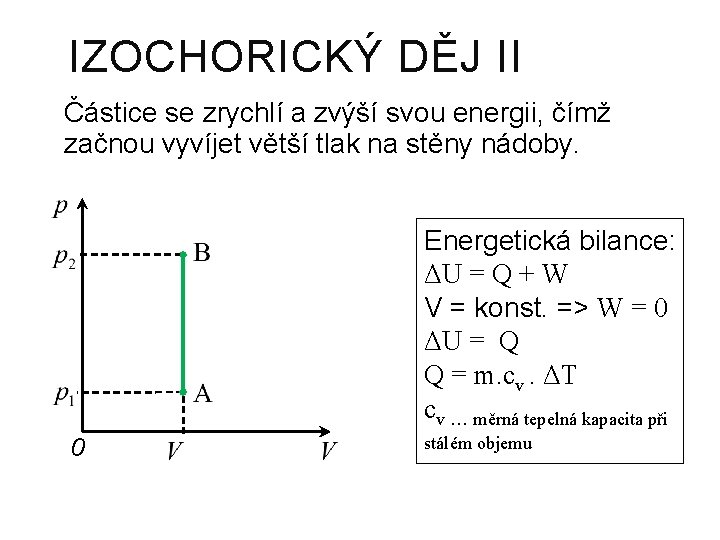
IZOCHORICKÝ DĚJ Nemění-li se objem plynu, pak: při zahřívání se zvětšuje teplota a tlak plynu, při ochlazování se zmenšuje teplota a tlak plynu. Charlesův zákon Při izochorickém ději s ideálním plynem stálé hmotnosti je tlak plynu přímo úměrný jeho termodynamické teplotě.

IZOCHORICKÝ DĚJ II Částice se zrychlí a zvýší svou energii, čímž začnou vyvíjet větší tlak na stěny nádoby. Energetická bilance: ΔU = Q + W V = konst. => W = 0 ΔU = Q Q = m. cv. ΔT cv … měrná tepelná kapacita při 0 stálém objemu

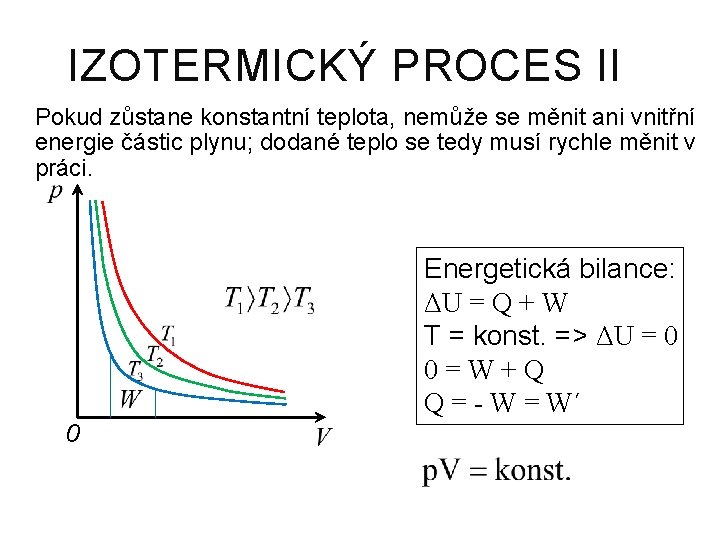
IZOTERMICKÝ PROCES Nemění se teplota -> nemění se ani vnitřní energie Boylův-Mariottův zákon Při izotermickém ději s ideálním plynem se stálou hmotností je součin tlaku a objemu plynu stálý.

IZOTERMICKÝ PROCES II Pokud zůstane konstantní teplota, nemůže se měnit ani vnitřní energie částic plynu; dodané teplo se tedy musí rychle měnit v práci. Energetická bilance: ΔU = Q + W T = konst. => ΔU = 0 0=W+Q Q = - W = W´ 0

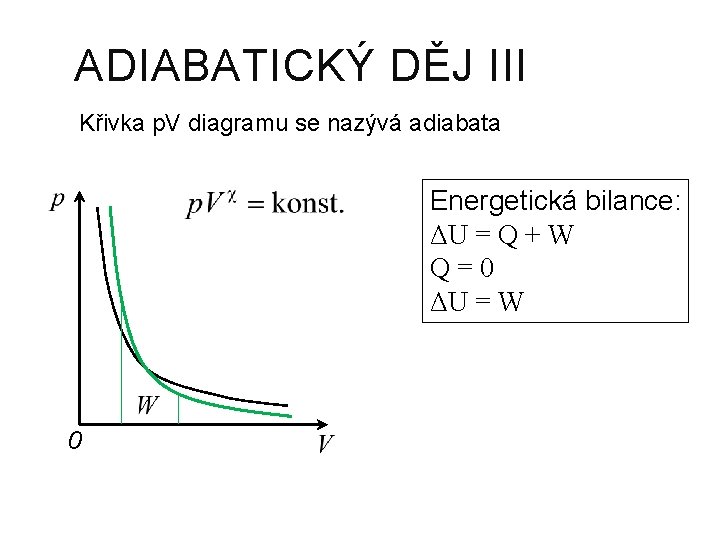
ADIABATICKÝ DĚJ Teplo je nulové Při adiabatickém ději neprobíhá tepelná výměna mezi plynem a okolím. Adiabatická expanze Všechna energie se přemění na práci – využití ve spalovacích motorech Energetická bilance: ΔU = Q + W Q=0 ΔU = W

ADIABATICKÝ DĚJ II Poissonův zákon: - Poissonova konstanta

ADIABATICKÝ DĚJ III Křivka p. V diagramu se nazývá adiabata Energetická bilance: ΔU = Q + W Q=0 ΔU = W 0

PŘÍKLADY

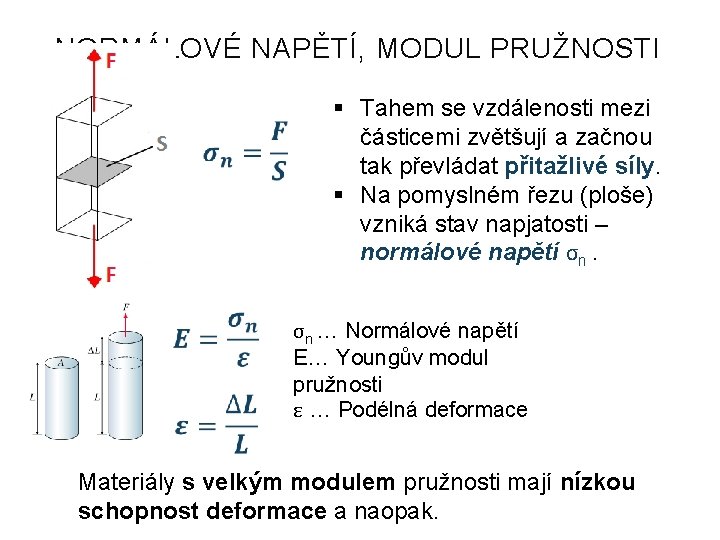
NORMÁLOVÉ NAPĚTÍ, MODUL PRUŽNOSTI § Tahem se vzdálenosti mezi částicemi zvětšují a začnou tak převládat přitažlivé síly. § Na pomyslném řezu (ploše) vzniká stav napjatosti – normálové napětí σn. σn … Normálové napětí E… Youngův modul pružnosti ε … Podélná deformace Materiály s velkým modulem pružnosti mají nízkou schopnost deformace a naopak.

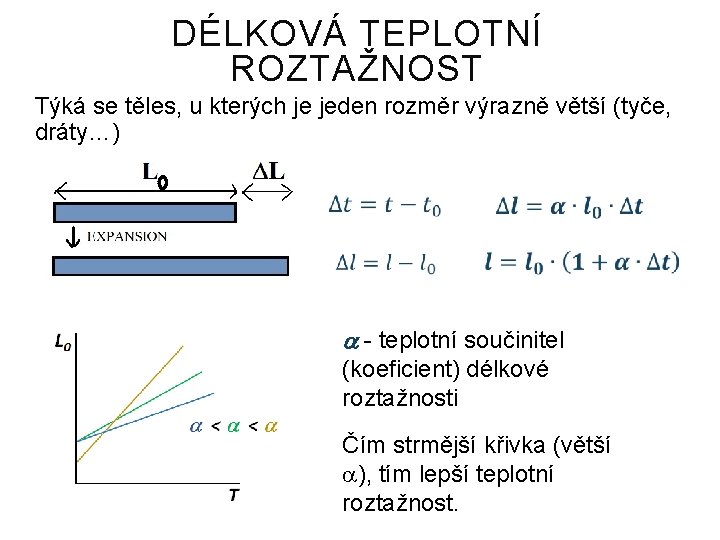
DÉLKOVÁ TEPLOTNÍ ROZTAŽNOST Týká se těles, u kterých je jeden rozměr výrazně větší (tyče, dráty…) - teplotní součinitel (koeficient) délkové roztažnosti Čím strmější křivka (větší ), tím lepší teplotní roztažnost.

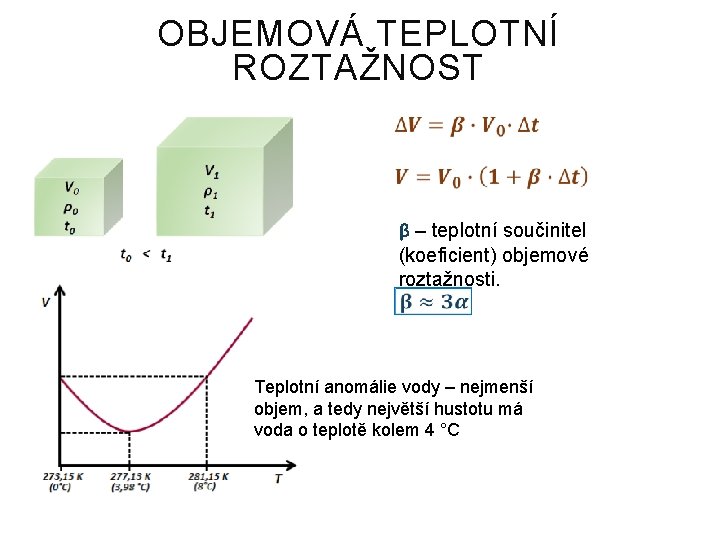
OBJEMOVÁ TEPLOTNÍ ROZTAŽNOST β – teplotní součinitel (koeficient) objemové roztažnosti. Teplotní anomálie vody – nejmenší objem, a tedy největší hustotu má voda o teplotě kolem 4 °C


POVRCHOVÉ NAPĚTÍ Tekutina (resp. její částice) na rozhraní se snaží dosáhnout stavu s nejnižší energií a „stáhnout se“ tak, aby měla při daném objemu co nejnižší povrch. Pokud bychom chtěli zvětšit povrch tekutiny, museli bychom vyvinout sílu právě kvůli vazební energii povrchových částic, tedy povrchovému napětí:


![REFERENCE 1 KRYNICKÝ Martin Elektronické učebnice matematiky a fyziky online 2013 01 28 cit REFERENCE 1. KRYNICKÝ, Martin. Elektronické učebnice matematiky a fyziky. [online]. 2013 -01 -28 [cit.](https://slidetodoc.com/presentation_image_h2/ec710ee03ace907cb3b1b7847ece62b0/image-58.jpg)
REFERENCE 1. KRYNICKÝ, Martin. Elektronické učebnice matematiky a fyziky. [online]. 2013 -01 -28 [cit. 2013 -02 -29]. Dostupné z: http: //www. realisticky. cz/ 2. REICHL, Jaroslav, VŠETIČKA Martin. Encyklopedie fyziky [online]. [cit. 2013 -02 -29]. Dostupné z: http: //fyzika. jreichl. com/ 3. Wikipedia [online]. [cit. 2013 -02 -29]. Dostupné z: http: //en. wikipedia. org 4. GESCHA H. , PFLANZ S. Kompendium fyziky. Univerzum 2003, překlad: Ludmila Eckertová
 Pemny
Pemny Pemny
Pemny Ltek
Ltek Plasmorhiza
Plasmorhiza Ltek ex pro 2
Ltek ex pro 2 Ludk
Ludk Maņu orgāni
Maņu orgāni Metrolgia
Metrolgia Stavba oko
Stavba oko Elektromagnetická indukce fyzika 9.ročník
Elektromagnetická indukce fyzika 9.ročník Druhy zrcadel fyzika
Druhy zrcadel fyzika Premena plynneho skupenstva na kvapalne
Premena plynneho skupenstva na kvapalne Polovodiče test fyzika
Polovodiče test fyzika Fyzika
Fyzika Hertz fyzika
Hertz fyzika Dakujem za pozornost fyzika
Dakujem za pozornost fyzika Pascal matematik
Pascal matematik Odchýlka merania fyzika 6 rocnik
Odchýlka merania fyzika 6 rocnik Zrážkomer fyzika
Zrážkomer fyzika Ohnisko fyzika
Ohnisko fyzika Hustota piesku
Hustota piesku Kvantová fyzika
Kvantová fyzika Fyzika 8 rocnik pohyb telesa
Fyzika 8 rocnik pohyb telesa Tepelná výměna druhy
Tepelná výměna druhy Mikroklima nedir
Mikroklima nedir Dakujem za pozornost fyzika
Dakujem za pozornost fyzika Prepolovanie zeme
Prepolovanie zeme Zuzana gibova
Zuzana gibova Fyzika v kuchyni
Fyzika v kuchyni Fyzika var
Fyzika var Kvantová fyzika
Kvantová fyzika Kvantová fyzika
Kvantová fyzika Atomová hmotnost
Atomová hmotnost Fvz fyzika
Fvz fyzika Výpočet tepla fyzika 7 ročník příklady
Výpočet tepla fyzika 7 ročník příklady Fyzika
Fyzika Deformacne ucinky sily
Deformacne ucinky sily Rezonancia fyzika
Rezonancia fyzika Fyzika v praxi
Fyzika v praxi Kvantová fyzika test
Kvantová fyzika test Fyzika
Fyzika Kladka jednoduchý stroj
Kladka jednoduchý stroj S v t fyzika
S v t fyzika Emetropia
Emetropia Oko
Oko Benjamin franklin bleskozvod
Benjamin franklin bleskozvod Jákobův žebřík fyzika
Jákobův žebřík fyzika Ivana gibová
Ivana gibová Rovnoramenné váhy popis
Rovnoramenné váhy popis Fyzika
Fyzika Fyzika jednotky objemu
Fyzika jednotky objemu Elektrické schéma značky
Elektrické schéma značky škodlivé trenie
škodlivé trenie Optické vlastnosti oka
Optické vlastnosti oka Zrážkomer fyzika
Zrážkomer fyzika Man lat
Man lat Energia v prirode fyzika
Energia v prirode fyzika Kedy je teleso v pohybe
Kedy je teleso v pohybe Spojky fyzika
Spojky fyzika