Molekulov fyzika 1 pednka Svt se skld z
















- Slides: 17

Molekulová fyzika 1. přednáška „Svět se skládá z atomů“

Starověcí atomisté Leukippos Demokritos Epikuros

John Dalton (1776 -1844) 1. Daltonův zákon (zákon stálých poměrů slučovacích) - hmotnostní poměr prvků nebo součástí dané sloučeniny je vždy stejný a nezávisí na způsobu přípravy této sloučeniny (J. L. Proust 1799. . . ) 100 g vody vždy obsahuje 11, 19 g vodíku a 88, 81 g kyslíku 2. Daltonův zákon (zákon násobných poměrů slučovacích) - tvoří-li dva prvky několik podvojných sloučenin, potom jejich hmotnosti ve sloučeninách jsou v poměrech, které lze vyjádřit malými celými čísly Daltonova atomová teorie

Daltonova atomová teorie atomy jsou velmi malé, dále nedělitelné částice Ø prvky představují určité třídy atomů takové, že chemické vlastnosti všech atomů daného prvku jsou stejné Ø atomy různých prvků se liší hmotností, velikostí a dalšími vlastnostmi Ø v průběhu chemických dějů se atomy spojují, oddělují nebo přeskupují – nemohou však vzniknout nebo zaniknout Ø

Joseph Louis Gay-Lussac (1778 -1850) Zákon stálých poměrů objemových při slučování plynů - slučují-li se dva nebo více plynů, jsou jejich objemy při téže teplotě a tlaku v poměru malých celých čísel 1 objem kyslíku + 2 objemy vodíku 2 objemy vodní páry Proč ze tří stejných objemů vodíku a kyslíku vzniknou dvě objemové jednotky vodní páry? ? ? existují molekuly Amadeo Avogadro

Lorenzo Romano Amedeo Carlo Avogadro, Conte di Quaregna e Cerreto (1776 -1856) Existují molekuly. Molekuly prvků mohou být v plynném stavu složeny z více atomů, podobně jako je sloučenina složena z více atomů. Stejné objemy plynů obsahují za stejné teploty a tlaku stejný počet molekul. (Avogadrův zákon) 2 H 2 + O 2 2 H 2 O

Základní veličiny a pojmy v molekulové fyzice relativní atomová (resp. molekulová) hmotnost Ø atomová hmotnostní jednotka Ø látkové množství Ø molární, hmotnostní a objemový zlomek Ø molární koncentrace, hmotnostní koncentrace Ø molalita Ø relativní molární koncentrace Ø relativní molalita Ø relativní tlak Ø

Hmotnosti atomů a molekul často není nutné znát absolutní hmotnost atomů (molekul) relativní atomová (resp. molekulová) hmotnost dřívější „standardy“: vodík, kyslík od roku 1961 je základem pro stanovení relativních (resp. molekulových) hmotností používán nuklid 12 C

Látkové množství n Vzorek ze stejnorodé látky má látkové množství jeden mol, obsahuje-li právě tolik částic (atomů, iontů, molekul), kolik je atomů ve vzorku nuklidu uhlíku 12 C o hmotnosti 12 g. Počet částic připadající na 1 mol látky udává Avogadrova konstanta NA NA= (6, 022 045 ± 0, 000 31) l 023 mol-1

Molární hmotnost M hmotnost dané látky látkové množství dané látky jednotka: g mol-1 Vydělením molární hmotnosti Avogadrovou konstantou dostaneme hmotnost m(X) jednoho atomu X: Např. : vodík m(1 H) = 1, 67355 10 -27 kg uhlík m(12 C) = 1, 99267 10 -26 kg

Atomová hmotnostní jednotka u 1 u = (1, 660 565 5 0, 000 008 6) 10 -27 kg - je definována tak, aby hmotnost mu atomové hmotnostní konstanty (která je rovna dvanáctině hmotnosti atomu nuklidu 12 C) byla právě 1 u: takže: m(12 C) = 12, 0000 u m(1 H) = 1, 00782 u

Relativní atomová hmotnost je dána poměrem hmotnosti m(X) atomu X a atomové hmotnostní konstanty: - bezrozměrná veličina, která udává, kolikrát je hmotnost dané částice X větší než atomová hmotnostní konstanta V přírodní směsi vodíku je 99, 985% izotopu 1 H (Ar (1 H) = 1, 00782) a 0, 015% izotopu 2 H (Ar (2 H) = 2, 01410). Relativní atomová hmotnost přírodní směsi vodíku tedy je Ar (H) = 1, 00797.

Relativní molekulová hmotnost je dána poměrem hmotnosti m(Y) molekuly Y a atomové hmotnostní konstanty: - bezrozměrná veličina, která udává, kolikrát je hmotnost dané molekuly Y větší než atomová hmotnostní konstanta

Vícesložkové soustavy (relativní obsah dané složky v soustavě) Ø molární zlomek (A) látky A: podíl látkového množství n(A) látky A a látkového množství n celé soustavy Ø hmotnostní zlomek w (A) látky A: podíl hmotnosti m(A) látky A a hmotnosti m celé soustavy Ø objemový zlomek (A) látky A: podíl objemu V(A) látky A a objemu V celé soustavy

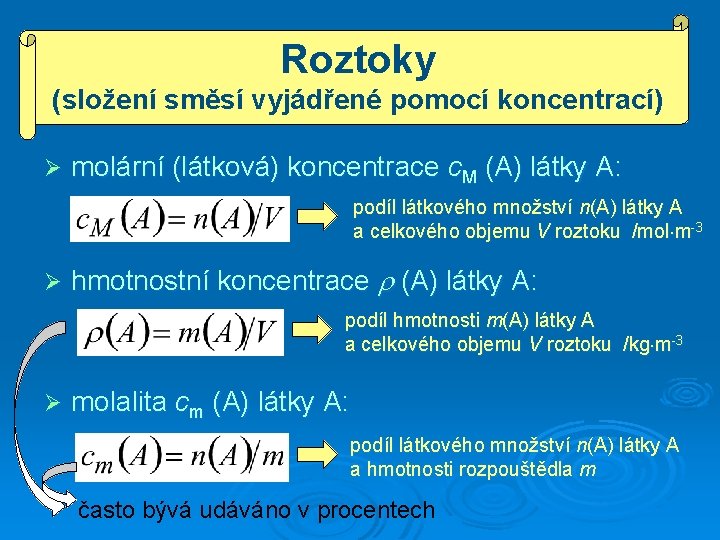
Roztoky (složení směsí vyjádřené pomocí koncentrací) Ø molární (látková) koncentrace c. M (A) látky A: podíl látkového množství n(A) látky A a celkového objemu V roztoku /mol m-3 Ø hmotnostní koncentrace (A) látky A: podíl hmotnosti m(A) látky A a celkového objemu V roztoku /kg m-3 Ø molalita cm (A) látky A: podíl látkového množství n(A) látky A a hmotnosti rozpouštědla m často bývá udáváno v procentech

Některé pojmy z teorie pravděpodobnosti Ø Ø Ø Ø vlastnosti výsledků experimentů ovlivněných náhodou pravděpodobnost i-tého výsledku pravděpodobnost určitého výsledku hustota pravděpodobnosti pravděpodobnost, že výsledek experimentu padne do určitého intervalu neslučitelné výsledky (pravděpodobnost výskytu aspoň jednoho z výsledků) normovací podmínka pro hustotu pravděpodobnosti nezávislost dvou náhodných pokusů (pravděpodobnost současného výskytu dvou konkrétních výsledků dvou nezávislých pokusů)

Charakteristiky náhodné veličiny střední hodnota (diskrétní výsledky, spojité rozložení náhodné veličiny) Ø rozptyl (kvadratická fluktuace) Ø