MOLEKULOV FYZIKA KAPALIN Struktura kapalin Povrchov vrstva kapaliny
























- Slides: 33

MOLEKULOVÁ FYZIKA KAPALIN Struktura kapalin Povrchová vrstva kapaliny Povrchová energie, povrchová síla, povrchové napětí Kapilární tlak Kapilarita Prof. RNDr. Emanuel Svoboda, CSc.

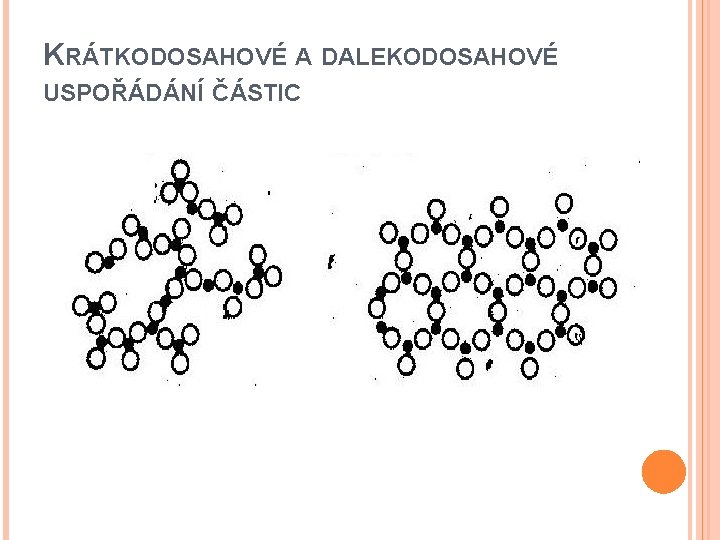
STRUKTURA KAPALIN Tvoří přechod mezi pevnými látkami a plyny, poměrně složitá struktura, vzdálenosti mezi molekulami řádově 0, 1 nm Složeny z nevelkých skupin molekul, v každé skupině uspořádání pravidelné; jednotlivé skupiny ale nepravidelně uspořádány, vzájemně odděleny – krátkodosahové uspořádání Časově nestálé rovnovážné polohy, kolem nichž kmitají molekuly anharmonicky s f 1012 Hz Střední kvadratická rychlost menší než u plynů Přemístění z jedné rovnovážné polohy do druhé, je-li k dispozici prostor s lineárním rozměrem molekuly; doba přemístění 10– 12 s

KRÁTKODOSAHOVÉ A DALEKODOSAHOVÉ USPOŘÁDÁNÍ ČÁSTIC

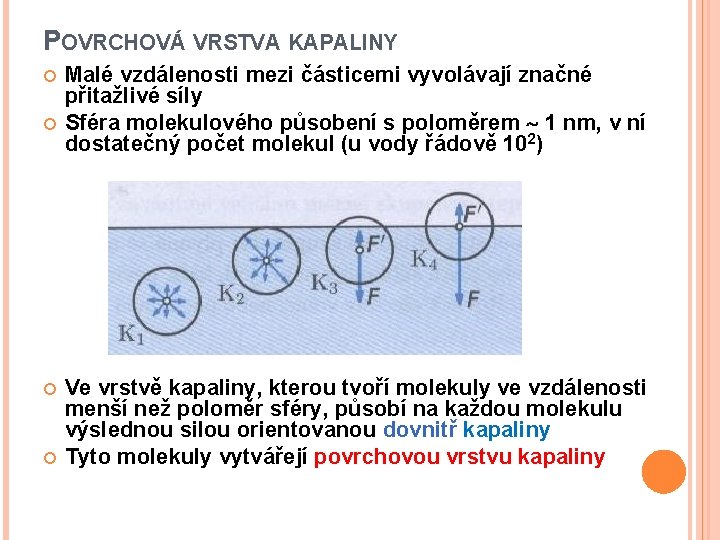
POVRCHOVÁ VRSTVA KAPALINY Malé vzdálenosti mezi částicemi vyvolávají značné přitažlivé síly Sféra molekulového působení s poloměrem 1 nm, v ní dostatečný počet molekul (u vody řádově 102) Ve vrstvě kapaliny, kterou tvoří molekuly ve vzdálenosti menší než poloměr sféry, působí na každou molekulu výslednou silou orientovanou dovnitř kapaliny Tyto molekuly vytvářejí povrchovou vrstvu kapaliny

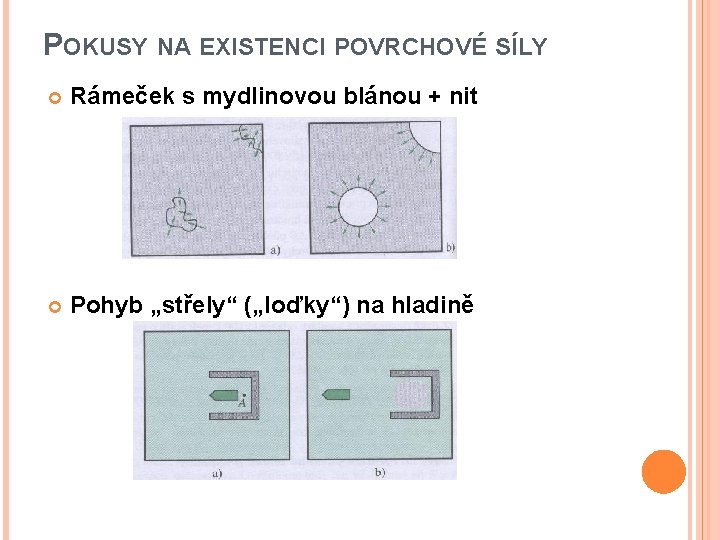
KOHÉZNÍ TLAK Účinkem sil v povrchové vrstvě vzniká tzv. kohézní (vnitřní) tlak pi uvnitř kapaliny Nelze ho měřit, ale odhadem podle van der Waalsova korekčního členu na tlak Pro vodu a = 0, 552 J m 3 mol– 2 , Vm 18 cm 3 mol– 1 pi 2 GPa !! Běžný tlak nad vodou 0, 1 MPa Kapaliny špatně stlačitelné při běžných tlacích ve srovnání s plyny Vstřikovací tlaky u motorů jsou (135 -220) MPa, takže nafta se stává stlačitelnou, ale chová se jako velmi tvrdá pružina Pokusy na projev povrchové vrstvy (pružná tenká blána): - špendlík, čepelka, mince na povrchu vody; - kapka vody u vodovodního kohoutku ; - mýdlová bublina na nálevce - v přírodě bruslařka (vodní ploštice), vodoměrka Rozdíl mezi nafouknutým balonkem a povrchovou vrstvou

Bruslařka (vodní ploštice)

Vodoměrka

BAZILIŠEK Dokáže běhat po hladině a zvládnout po ní uběhnout klidně deset až dvacet metrů (proto přezdívka Ježíšova ještěrka). Hlavně ale skvěle běhá po souši (až 10 km/h), šplhá po stromech a je výborný plavec Některé druhy patří mezi nejjedovatější druhy ještěrů

SEDMIKRÁSKA NA VODĚ

POTENCIÁLNÍ ENERGIE POVRCHOVÉ VRSTVY POVRCHOVÁ ENERGIE –VYPLÝVAJÍCÍ ZE SILOVÉHO PŮSOBENÍ MEZI MOLEKULAMI KAPALINY Z existence povrchové vrstvy vyplývá, že při posunutí molekuly z vnitřku kapaliny do povrchové vrstvy se musí vykonat práce Neboli potenciální energie vrstvy je větší než potenciální energie vnitřní vrstvy (o stejném počtu molekul) – rozdíl energií je povrchová energie kapaliny ES = * S resp. d. ES = *d. S hustota povrchové energie, kapilární konstanta Rovnovážný stav: minimum ES kulový tvar kapek, vodorovná hladina vody v otevřené nádobě

KULOVÝ TVAR KAPEK –POKUS( VODA + LÍH + KAPKA OLEJE) Obrázky Větší kapky vody na listu Malá kapka rosy Kapka vody ve volném prostoru

POKUSY Drátěné modely Mýdlové bubliny: zaplnění povrchové vrstvy vody jinými molekulami – adsorpce (saponát, mýdlo); molekuly vtahovány dovnitř kapaliny Zmenšení kapilární konstanty přidáním např. cukru, soli – vytlačování mýdla na povrch vody (využití při vaření mýdla) Přírodní nebo chemicky upravené tuky působením Na. OH nebo KOH (tzv. louhy) + zahříváním (80 o. C až 100 o. C) se vylučují na povrchu jako mýdlový klih vysolováním (Na. Cl) se rozruší mýdelné micely a mýdlo se vyloučí jako tzv. jádrové mýdlo Pak další úpravy + sušení atd…

Mýdla jsou v podstatě hydratované sodné nebo draselné soli vyšších karboxylových kyselin. Molekuly těchto solí obsahují nerozvětvený řetězec 10 až 22 atomů uhlíku. V důsledku toho mají dvě části s velice rozdílnými fyzikálněchemickými vlastnostmi. Dlouhá alifatická část molekuly, tvořená uhlovodíkovým řetězcem methylenových skupin CH 2 a zakončená skupinou methylovou CH 3 je hydrofobní a nepolární; menší karboxylová skupina, tedy lipofobní část (buď neutrální –COOH, nebo ve formě aniontu –COO−), je hydrofilní a polární. V důsledku toho mohou tvořit „propojovací můstek“ mezi částečkami hydrofobních látek (např. tuků a olejů) a hydrofilním prostředím, např. vodou, a tak vytvářet stabilní emulse nebo nepravé roztoky těchto látek ve vodě. Toto je základním mechanismem čisticího účinku mýdel.

Při rozpuštění mýdla ve vodě vzniká nepravý roztok, v němž molekuly mýdelných sloučenin vytvářejí shluky, zvané mýdlové micely, Při kontaktu s částečkou tuku micela pohltí tuk do svého nitra a víceméně ji celou obalí. Protože se nepolární části mýdlových molekul ponoří do tukového prostředí a jejich polární části stále ční do okolního prostředí, tuk se efektivně převede do roztoku. Tento proces, kdy jsou do micel mýdla (nebo obecněji tenzidu) včleňovány molekuly jiné látky (ať už se jedná o tuk, nečistoty, a jiné látky hydrofobního charakteru) nazýváme solubilizace.

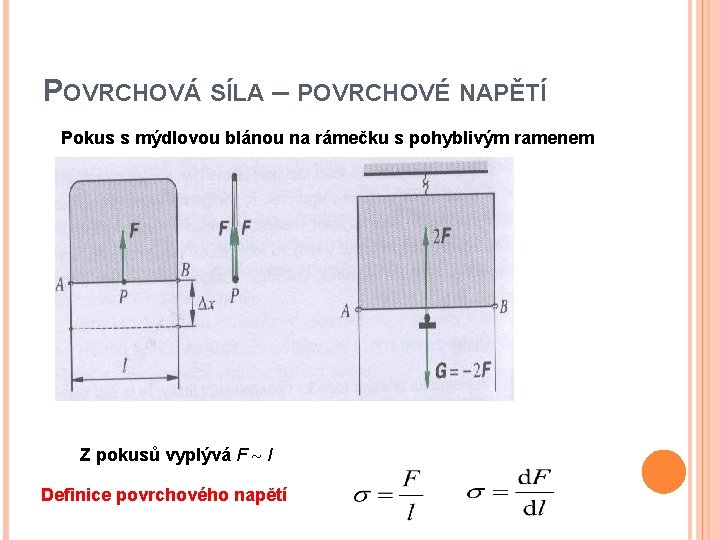
POVRCHOVÁ SÍLA – POVRCHOVÉ NAPĚTÍ Pokus s mýdlovou blánou na rámečku s pohyblivým ramenem Z pokusů vyplývá F l Definice povrchového napětí

VZTAH MEZI KAPILÁRNÍ KONSTANTOU A POVRCHOVÝM NAPĚTÍM Při posunutí příčky o vzdálenost x musíme působit silou F´ = 2 F (mýdlová blána má dva povrchy) Vykonaná práce: W = 2 F x = 2 l x Zvýšení povrchové energie o ES = *2 l x Porovnáním: = * (hledisko energetické – hledisko silové) Jednotka povrchového napětí N m– 1 (= J m– 2) Interpretace: povrchové napětí se rovná podílu povrchové síly působící kolmo v povrchu kapaliny a délky okraje povrchové blány Příklady hodnot : voda 73 m. N m– 1, líh 22 m. N m– 1, rtuť 476 m. N m– 1, mýdlový roztok 40 m. N m– 1 (vše ve styku se vzduchem)

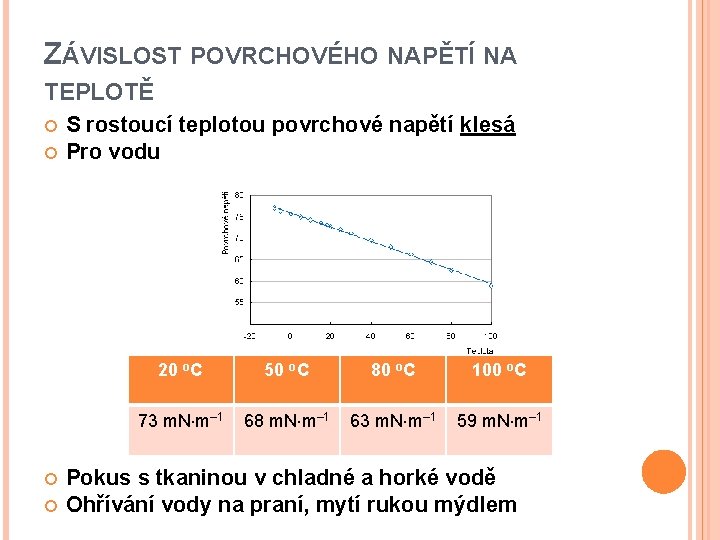
ZÁVISLOST POVRCHOVÉHO NAPĚTÍ NA TEPLOTĚ S rostoucí teplotou povrchové napětí klesá Pro vodu 20 o. C 50 o. C 80 o. C 100 o. C 73 m. N m– 1 68 m. N m– 1 63 m. N m– 1 59 m. N m– 1 Pokus s tkaninou v chladné a horké vodě Ohřívání vody na praní, mytí rukou mýdlem

POKUSY NA EXISTENCI POVRCHOVÉ SÍLY Rámeček s mydlinovou blánou + nit Pohyb „střely“ („loďky“) na hladině

ÚLOHA 1 ? ? = 73 10– 3 N m– 1, d = 0, 126 m, m = 8 10– 3 kg ; F = ? Voda přilne k vrchní straně víčka. Když se snažíme víčko z vody vytáhnout, musíme překonat tíhovou sílu a povrchovou sílu vodního sloupce, který táhneme za víčkem.

POKRAČ. ŘEŠENÍ ÚLOHY 1

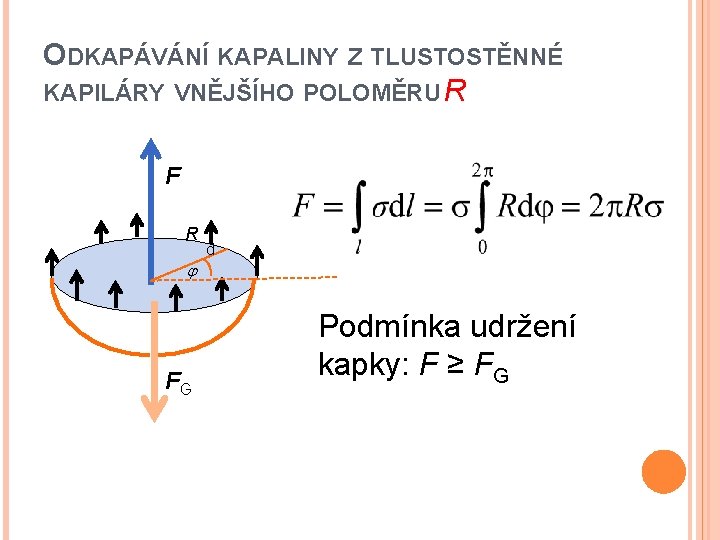
ODKAPÁVÁNÍ KAPALINY Z TLUSTOSTĚNNÉ KAPILÁRY VNĚJŠÍHO POLOMĚRU R F R d FG Podmínka udržení kapky: F ≥ FG

ÚLOHA 2 Vypočtěte maximální průměr ocelové jehly, která se ještě udrží na vodní hladině. Jehla je pokryta tenkým olejovým filtrem, aby ji voda nesmáčela. Řešení: podmínka FG povrchová síla F Jehla tvaru válce o poloměru r a výšky v Tíha válce FG = r 2 v Feg Povrchová síla F = 2 v Z podmínky řešení pak vyplývá Početně

ZAKŘIVENÍ POVRCHU KAPALINY U STĚNY NÁDOBY Z charakteru vzájemného působení mezi molekulami na rozhraní kapalina – pevné těleso – plyn vyplývají tyto možnosti výsledného působení: Výsledná síla F míří A) dovnitř kapaliny vypuklé zakřivení povrchu Stykový (krajní) úhel tupý Např. rtuť + sklo ( = 128 o) Stejný úhel vznikne u kapky rtuti na vodorovném skle

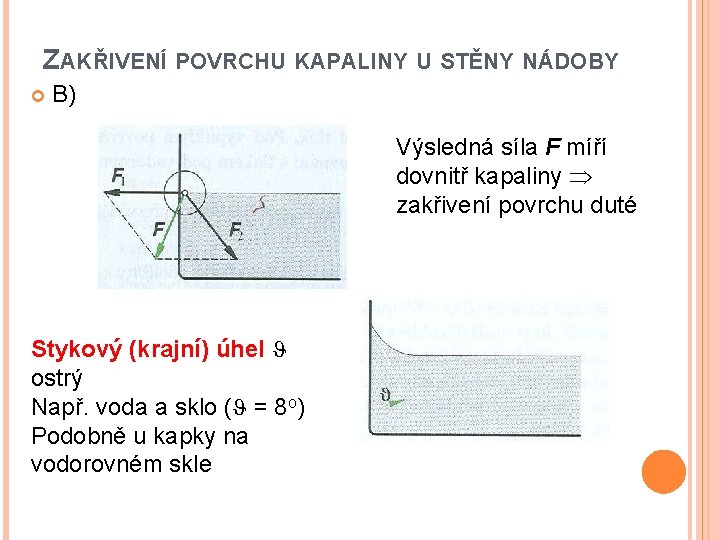
ZAKŘIVENÍ POVRCHU KAPALINY U STĚNY NÁDOBY B) Výsledná síla F míří dovnitř kapaliny zakřivení povrchu duté Stykový (krajní) úhel ostrý Např. voda a sklo ( = 8 o) Podobně u kapky na vodorovném skle

ZAKŘIVENÍ POVRCHU KAPALINY U STĚNY NÁDOBY, NA VODOROVNÉ PODLOŽCE C) Je-li = 0 o, kapalina dokonale smáčí stěny (v řezu hladina kapaliny u stěny část kružnice; kapka petroleje se rozteče po povrchu měděné desky) D) Pro = 90 o rovinná plocha E) Pro skutečné kapaliny je 0 o 90 o nebo 90 o 180 o Kapka: Kulový tvar kapky rtuti na skle, vodní kapky na voskové desce, kapičky mlhy; deformace tíhovou silou

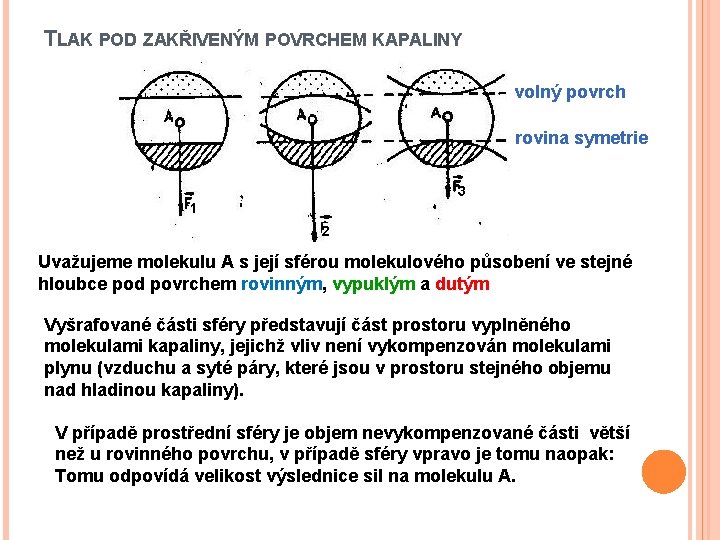
TLAK POD ZAKŘIVENÝM POVRCHEM KAPALINY volný povrch rovina symetrie 3 1 2 Uvažujeme molekulu A s její sférou molekulového působení ve stejné hloubce pod povrchem rovinným, vypuklým a dutým Vyšrafované části sféry představují část prostoru vyplněného molekulami kapaliny, jejichž vliv není vykompenzován molekulami plynu (vzduchu a syté páry, které jsou v prostoru stejného objemu nad hladinou kapaliny). V případě prostřední sféry je objem nevykompenzované části větší než u rovinného povrchu, v případě sféry vpravo je tomu naopak: Tomu odpovídá velikost výslednice sil na molekulu A.

TLAK POD ZAKŘIVENÝM POVRCHEM KAPALINY Závěr: V případě zakřiveného povrchu je jiné silové působení povrchové vrstvy než u povrchu rovinného: F 2 F 1 F 3 Vlivem zakřivení povrchu kapaliny vzniká v kapalině přídavný tlak - kapilární tlak pk Duté zakřivení vyvolá menší vnitřní tlak než rovinné, vypuklé zakřivení větší vnitřní tlak než rovinný povrch; (pi pk)

VÝPOČET KAPILÁRNÍHO TLAKU Využijeme podmínky d. W = d. ES Pro kulovou kapku poloměru r: Objem V = (4/3) r 3 změna objemu d. V = 4 r 2 dr Povrch S = 4 r 2 změna povrchu d. S = 8 r dr d. W = pk d. V , d. ES = d. S pk 4 r 2 dr = 8 r dr Pro kulovou bublinu s dvěma povrchy Pro válcový povrch (např. rtuť nebo voda mezi dvěma deskami) Závěr: Kapilární tlak nepřímo úměrný poloměru zakřivení

EXPERIMENT SE DVĚMA MÝDLOVÝMI BUBLINAMI

ÚLOHA 3 Určete kapilární tlak uvnitř kulové mýdlové bubliny o průměru d = 2, 0 cm. Povrchové napětí roztoku mýdla ve styku se vzduchem je 40 m. N m– 1. Řešení: Početně Kdyby se jednalo o vzduchovou bublinu ve vodě a bublina by měla poloměr 1, 0 mm, pak pk 0, 15 k. Pa; při poloměru 0, 001 mm je pak pk 1, 46 105 Pa (převyšuje vnější atmosférický tlak!)

KAPILARITA Úzká trubice malého vnitřního průměru (kapiláru) ponoříme do kapaliny v široké nádobě Nastává kapilární elevace (z latiny elevo = výše zvedám, capilus = vlas) nebo kapilární deprese (z lat. deprimo = stlačuji) Kapilarita je důsledkem existence kapilárního tlaku. Těsně pod dutým povrchem je vnitřní tlak menší než pod rov. povrchem v okolí kapiláry. Proto kapalina vystoupí výše v kapiláře, aby hydrostatický tlak vyrovnal rozdíl vnitřních tlaků. Opačně u kapilární deprese

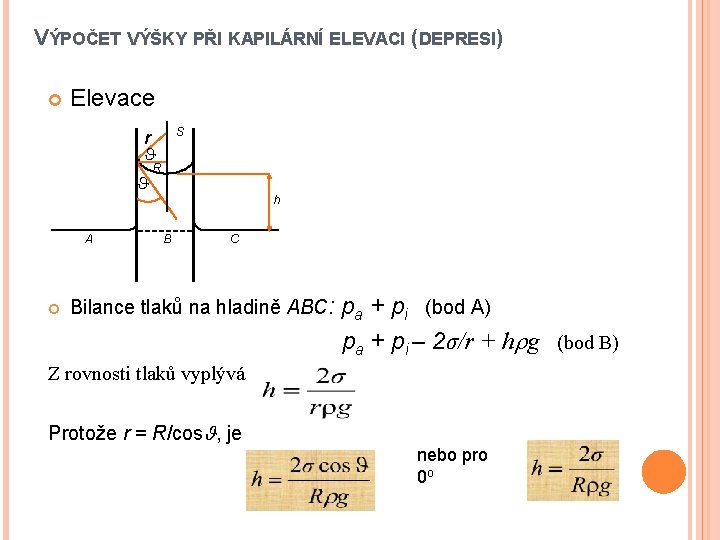
VÝPOČET VÝŠKY PŘI KAPILÁRNÍ ELEVACI (DEPRESI) Elevace S r A R h B C Bilance tlaků na hladině ABC: pa + pi (bod A) pa + pi – 2σ/r + h g (bod B) Z rovnosti tlaků vyplývá Protože r = R/cos , je nebo pro 0 o

PODMÍNKA VARU KAPALINY –ROZBOR Z HLEDISKA KINETICKÉ TEORIE LÁTEK Při varu kapaliny se uvnitř kapaliny vytvářejí bublinky syté páry, které postupně zvětšují svůj objem a vystupují k povrchu kapaliny. Bublinky syté páry vznikají v místech, ve kterých jsou v kapalině mikroskopické bubliny pohlceného vzduchu. Tlaková bilance Uvnitř bubliny pv + ps(t) Vně bubliny po + ph + pk Zanedbáme pv proti ps(t) Zanedbáme ph + pk v porovnání s vnějším tlakem po Potom podmínka varu: ps(t) po Var nastává při teplotě, při které je tlak syté páry kapaliny přibližně roven vnějšímu tlaku nad volným povrchem kapaliny.
 Sféra molekulového působení
Sféra molekulového působení Struktura a vlastnosti kapalin
Struktura a vlastnosti kapalin Struktura a vlastnosti kapalin test
Struktura a vlastnosti kapalin test Závislost hustoty kapaliny na teplotě
Závislost hustoty kapaliny na teplotě Kapalina smáčí stěny nádoby
Kapalina smáčí stěny nádoby Závislost hustoty kapaliny na teplotě
Závislost hustoty kapaliny na teplotě Dysonø
Dysonø Smáčivé a nesmáčivé kapaliny
Smáčivé a nesmáčivé kapaliny Proč se nemůže do venkovních teploměrů použít voda
Proč se nemůže do venkovních teploměrů použít voda Těleso ponořené do kapaliny je nadlehčováno
Těleso ponořené do kapaliny je nadlehčováno Společná vlastnost kapalín a plynu
Společná vlastnost kapalín a plynu Archimedův zákon
Archimedův zákon Mechanické vlastnosti kapalin - test
Mechanické vlastnosti kapalin - test Základní vlastnosti kapalin
Základní vlastnosti kapalin Různorodá směs navzájem rozptýlených kapalin
Různorodá směs navzájem rozptýlených kapalin Guov
Guov Povrchová vrstva kvapaliny
Povrchová vrstva kvapaliny Stylové rozvrstvení slovní zásoby
Stylové rozvrstvení slovní zásoby Jazykové prostředky
Jazykové prostředky Lexikalne prostriedky
Lexikalne prostriedky Jazykové prostředky
Jazykové prostředky Systema genitale
Systema genitale Obsah zeme
Obsah zeme Gulovy vrchlik
Gulovy vrchlik Polus posterior
Polus posterior Man lat
Man lat Energia v prirode fyzika
Energia v prirode fyzika Ivana gibová
Ivana gibová Historie měření hmotnosti
Historie měření hmotnosti Spojky fyzika
Spojky fyzika Polohová a pohybová energia priklady
Polohová a pohybová energia priklady Zvuk fyzika 8 třída
Zvuk fyzika 8 třída Fyzika v kuchyni
Fyzika v kuchyni Plynový teploměr princip
Plynový teploměr princip





















































