Rle de la matire organique particulaire linterface solide





![Résultats du calcul [XOH]tot = 1, 71 x 10 -4 mol/g S. Spéc : Résultats du calcul [XOH]tot = 1, 71 x 10 -4 mol/g S. Spéc :](https://slidetodoc.com/presentation_image_h/9ec417079ae69fac6d3b840e70e99302/image-12.jpg)
![Paramétrisation du modèle Concentration en sites de surface : [XOH]tot = 1, 71 x Paramétrisation du modèle Concentration en sites de surface : [XOH]tot = 1, 71 x](https://slidetodoc.com/presentation_image_h/9ec417079ae69fac6d3b840e70e99302/image-16.jpg)

![Adsorption du cuivre en présence d’acide humique Lorsque [AH] = 0 et 10 mg/L Adsorption du cuivre en présence d’acide humique Lorsque [AH] = 0 et 10 mg/L](https://slidetodoc.com/presentation_image_h/9ec417079ae69fac6d3b840e70e99302/image-21.jpg)


- Slides: 25

Rôle de la matière organique particulaire à l’interface solide / liquide : cas du cuivre et du nickel Charlotte Hurel, Christine Baduel, Nicolas Marmier

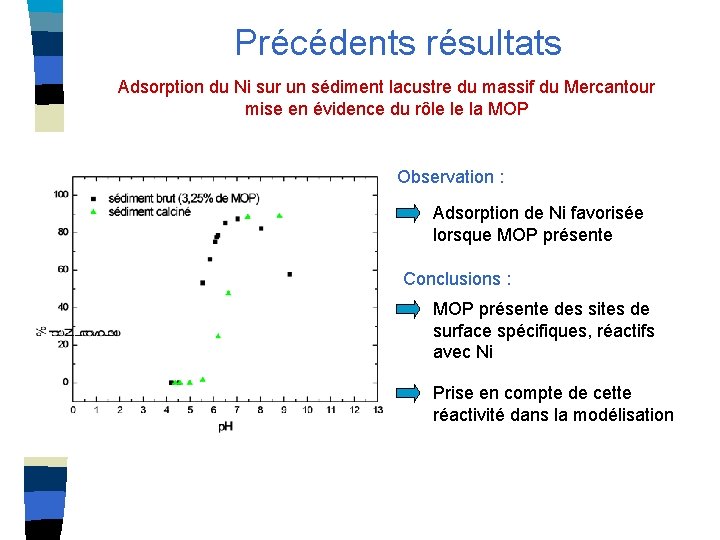
Précédents résultats Adsorption du Ni sur un sédiment lacustre du massif du Mercantour mise en évidence du rôle le la MOP Observation : Adsorption de Ni favorisée lorsque MOP présente Conclusions : MOP présente des sites de surface spécifiques, réactifs avec Ni Prise en compte de cette réactivité dans la modélisation

Objectifs de l’étude Réaliser des expériences d’adsorption du Cu et du Ni sur un sédiment en fonction du p. H dans le cas : échantillon brut échantillon débarrassé de la MOP échantillon débarrassé des oxydes de fer et manganèse BUT : Identifier les fractions responsables de l’adsorption Déduire des équilibres d’adsorption à intégrer dans un modèle de complexation de surface

Origine de l’échantillon Sediment de la Seine*(Vatteville) • Diamètre des particles < 2 mm Sédiment Seine Fe (%) 1, 96 Mn (%) 0, 05 MOP (%) 5 *Thèse C. Dange (2002) Université de Reims Champagne Ardenne - IFREMER

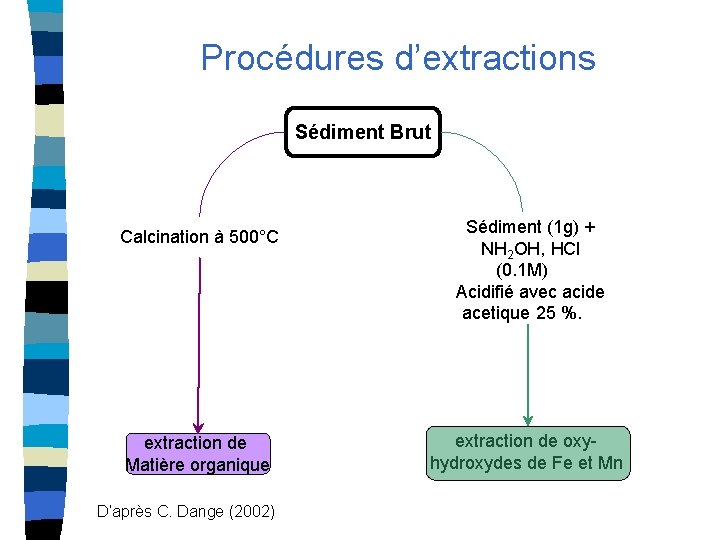
Procédures d’extractions Sédiment Brut Calcination à 500°C extraction de Matière organique D’après C. Dange (2002) Sédiment (1 g) + NH 2 OH, HCl (0. 1 M) Acidifié avec acide acetique 25 %. extraction de oxyhydroxydes de Fe et Mn

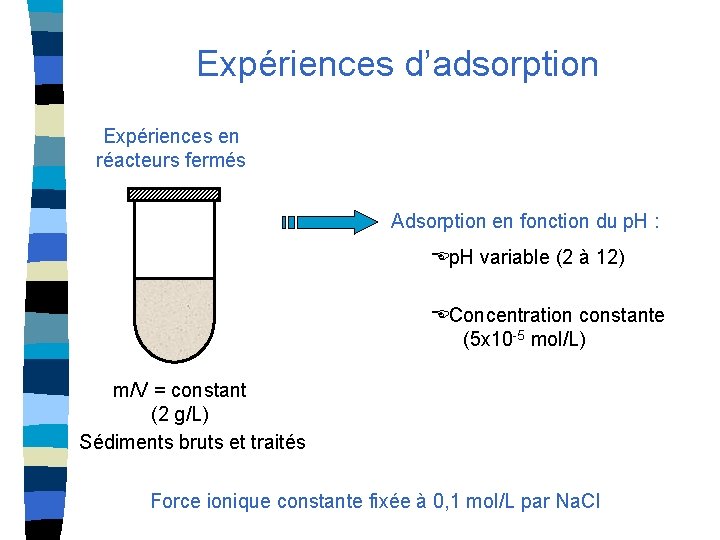
Expériences d’adsorption Expériences en réacteurs fermés Adsorption en fonction du p. H : p. H variable (2 à 12) Concentration constante (5 x 10 -5 mol/L) m/V = constant (2 g/L) Sédiments bruts et traités Force ionique constante fixée à 0, 1 mol/L par Na. Cl

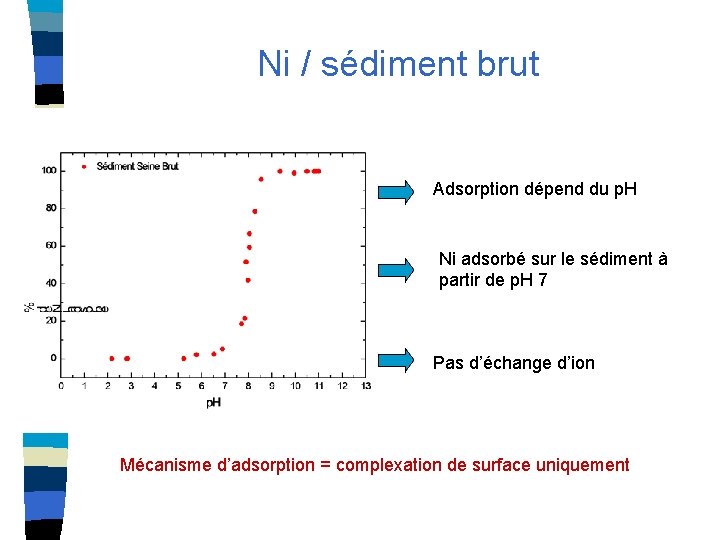
Ni / sédiment brut Adsorption dépend du p. H Ni adsorbé sur le sédiment à partir de p. H 7 Pas d’échange d’ion Mécanisme d’adsorption = complexation de surface uniquement

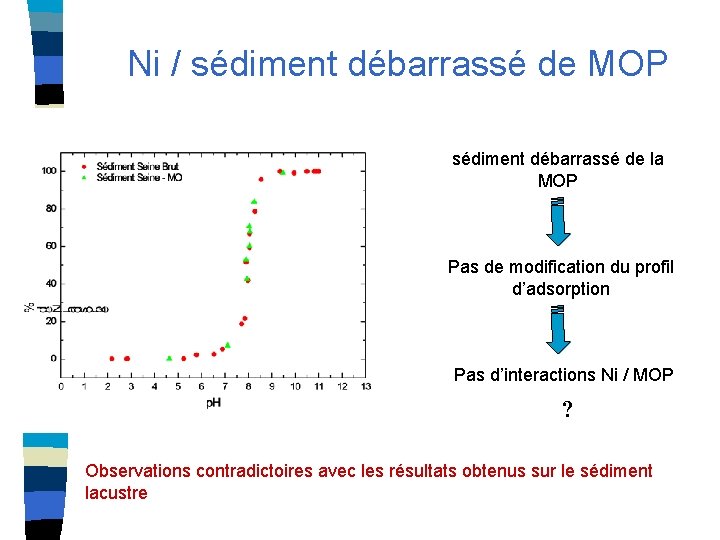
Ni / sédiment débarrassé de MOP sédiment débarrassé de la MOP Pas de modification du profil d’adsorption Pas d’interactions Ni / MOP ? Observations contradictoires avec les résultats obtenus sur le sédiment lacustre

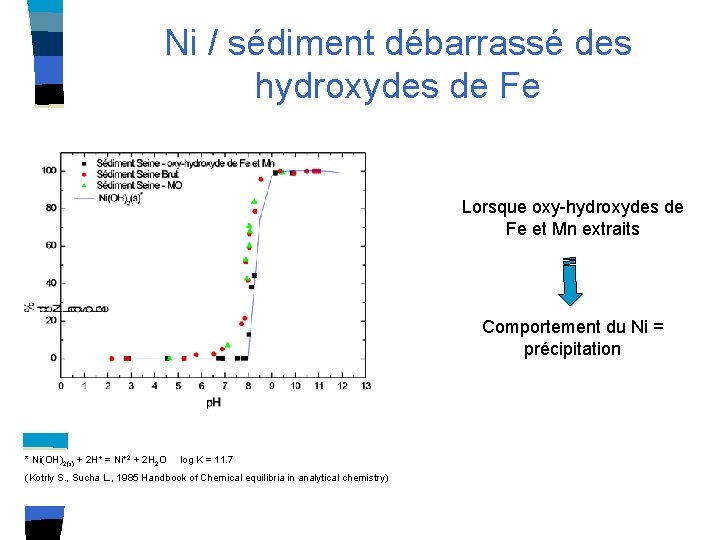
Ni / sédiment débarrassé des hydroxydes de Fe Lorsque oxy-hydroxydes de Fe et Mn extraits Comportement du Ni = précipitation * Ni(OH)2(s) + 2 H+ = Ni+2 + 2 H 2 O log K = 11. 7 (Kotrly S. , Sucha L. , 1985 Handbook of Chemical equilibria in analytical chemistry)

Conclusions sur le Ni Oxydes de Fe : seule phase responsable de la fixation du Ni à la surface du sédiment Prise en compte de ce type de sites de surface dans la détermination des équilibres de complexation de surface Comportement du nickel indépendant de la MOP

Paramétrisation du modèle Modèle DLM – théorie de complexation de surface Concentration en sites de surface : [XOH]tot = 1, 71 x 10 -4 mol/g* Surface spécifique : 6, 57 m 2/g* (BET) Hypothèse : les sites réactifs sont les oxydes de Fe (=XOH) XOH + H+ = XOH 2+ Log Ka 1 = 7, 18 XOH = XO- + H+ Log Ka 2 = - 8, 82 Données de la littérature** 1 seul paramètre non défini : stœchiométrie de fixation de Ni + constante associée *d’après thèse C. Dange **Dzomback et Morel « surface complexation modeling : hydrous ferric oxide »
![Résultats du calcul XOHtot 1 71 x 10 4 molg S Spéc Résultats du calcul [XOH]tot = 1, 71 x 10 -4 mol/g S. Spéc :](https://slidetodoc.com/presentation_image_h/9ec417079ae69fac6d3b840e70e99302/image-12.jpg)
Résultats du calcul [XOH]tot = 1, 71 x 10 -4 mol/g S. Spéc : 6, 57 m 2/g Réactivité acido-basique de surface : XOH + H+ = XOH 2+ Log Ka 1 = 7, 18 XOH = XO- + H+ Log Ka 2 = - 8, 82 Paramètre ajusté: XOH + Ni 2+ = XONi+ + H+ Log K = - 4, 19 Conclusion : 1 seul équilibre de complexation de surface est nécessaire pour rendre compte du comportement de Ni à la surface du sédiment.

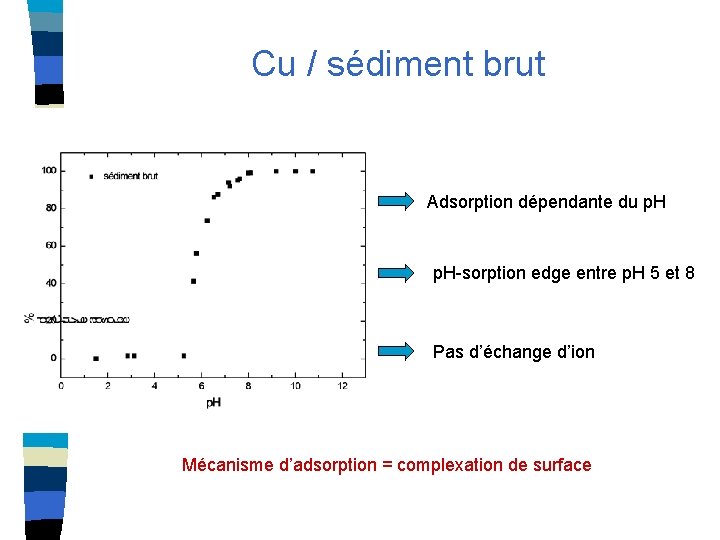
Cu / sédiment brut Adsorption dépendante du p. H-sorption edge entre p. H 5 et 8 Pas d’échange d’ion Mécanisme d’adsorption = complexation de surface

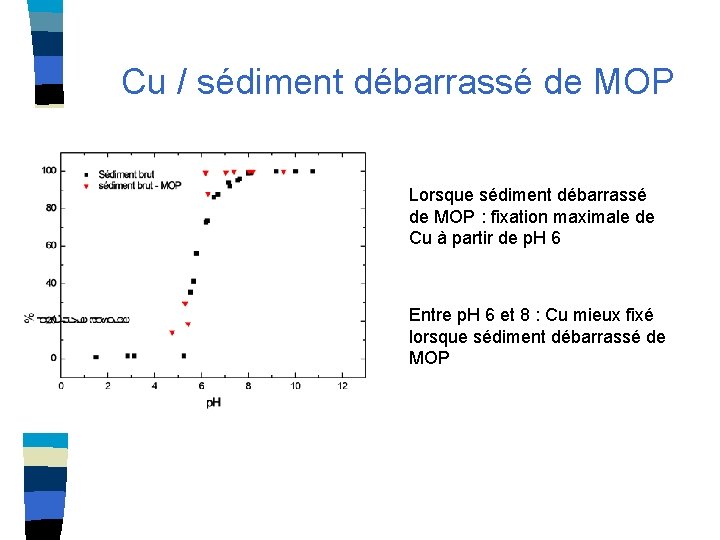
Cu / sédiment débarrassé de MOP Lorsque sédiment débarrassé de MOP : fixation maximale de Cu à partir de p. H 6 Entre p. H 6 et 8 : Cu mieux fixé lorsque sédiment débarrassé de MOP

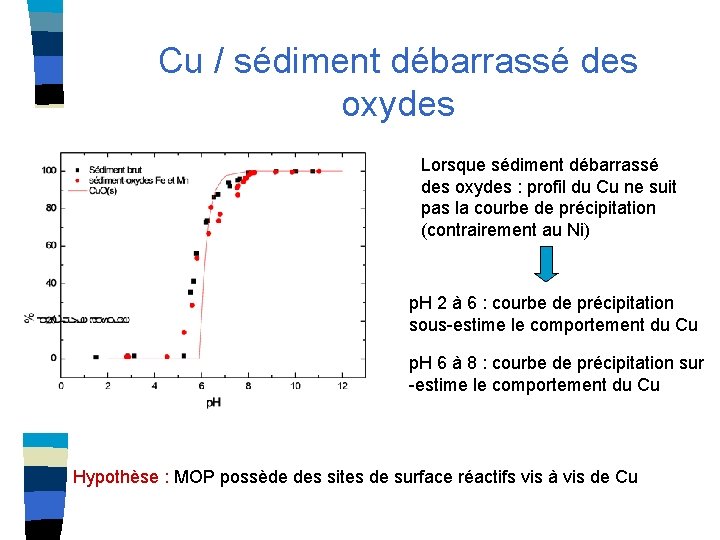
Cu / sédiment débarrassé des oxydes Lorsque sédiment débarrassé des oxydes : profil du Cu ne suit pas la courbe de précipitation (contrairement au Ni) p. H 2 à 6 : courbe de précipitation sous-estime le comportement du Cu p. H 6 à 8 : courbe de précipitation sur -estime le comportement du Cu Hypothèse : MOP possède des sites de surface réactifs vis à vis de Cu
![Paramétrisation du modèle Concentration en sites de surface XOHtot 1 71 x Paramétrisation du modèle Concentration en sites de surface : [XOH]tot = 1, 71 x](https://slidetodoc.com/presentation_image_h/9ec417079ae69fac6d3b840e70e99302/image-16.jpg)
Paramétrisation du modèle Concentration en sites de surface : [XOH]tot = 1, 71 x 10 -4 mol/g Surface spécifique : 6, 57 m 2/g Hypothèses : sites réactifs d’oxydes de Fe (=XOH) XOH + H+ = XOH 2+ Log Ka 1 = 7, 18 XOH = XO- + H+ Log Ka 2 = - 8, 82 Données de la littérature sites réactifs de MOP D’après littérature* Sites carboxyliques : R-COOH = R-COO- + H+ p. Ka 4, 67 Sites Phénoliques : R-OH = R-O- + H+ R-COOH + M z+ = R-COOM(z-1)+ + H+ p. Ka 10 Complexe monodentate Ou 2 (R-COOH) + M z+ = (R-COO)2 M(z-2)+ + 2 H+ *Lofts S et al. J. Environ. Radioactiv. 61 (2002) 133 -147 Ghabbour E. A et al. Chemosphere 63 (2006) 477 -483 Complexe bidentate

Paramétrisation du modèle (suite) Problème pour MOP On ne connaît pas le type de matière organique contenue dans le sédiment On ne connaît pas la proportion des sites carboxyliques et phénoliques de la MOP Solution envisagée On considère 1 type de site « moyen » caractérisant la MOP (=MOOH) MOOH = MOO- + H+ Log Ka et [MOOH]tot à déterminer On suppose que Cu est fixé sur MOP sous la forme d’un complexe monodentate MOOH + Cu 2+ = MOO-Cu+ + H+ Log K à déterminer

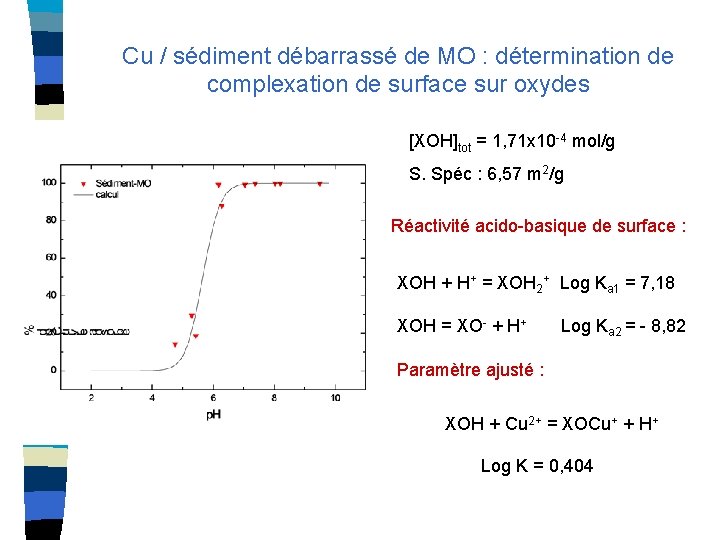
Cu / sédiment débarrassé de MO : détermination de complexation de surface sur oxydes [XOH]tot = 1, 71 x 10 -4 mol/g S. Spéc : 6, 57 m 2/g Réactivité acido-basique de surface : XOH + H+ = XOH 2+ Log Ka 1 = 7, 18 XOH = XO- + H+ Log Ka 2 = - 8, 82 Paramètre ajusté : XOH + Cu 2+ = XOCu+ + H+ Log K = 0, 404

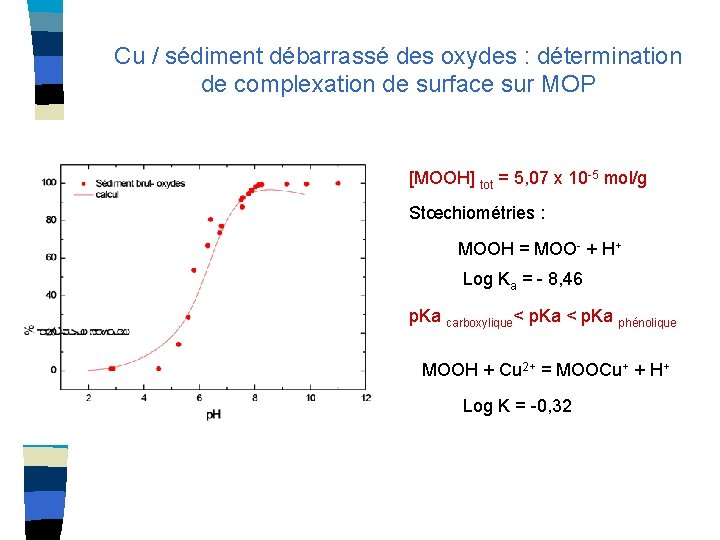
Cu / sédiment débarrassé des oxydes : détermination de complexation de surface sur MOP [MOOH] tot = 5, 07 x 10 -5 mol/g Stœchiométries : MOOH = MOO- + H+ Log Ka = - 8, 46 p. Ka carboxylique< p. Ka phénolique MOOH + Cu 2+ = MOOCu+ + H+ Log K = -0, 32

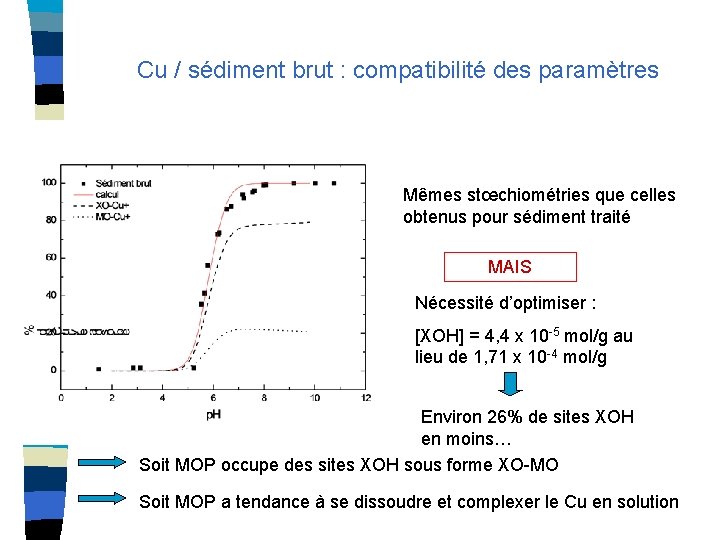
Cu / sédiment brut : compatibilité des paramètres Mêmes stœchiométries que celles obtenus pour sédiment traité MAIS Nécessité d’optimiser : [XOH] = 4, 4 x 10 -5 mol/g au lieu de 1, 71 x 10 -4 mol/g Environ 26% de sites XOH en moins… Soit MOP occupe des sites XOH sous forme XO-MO Soit MOP a tendance à se dissoudre et complexer le Cu en solution
![Adsorption du cuivre en présence dacide humique Lorsque AH 0 et 10 mgL Adsorption du cuivre en présence d’acide humique Lorsque [AH] = 0 et 10 mg/L](https://slidetodoc.com/presentation_image_h/9ec417079ae69fac6d3b840e70e99302/image-21.jpg)
Adsorption du cuivre en présence d’acide humique Lorsque [AH] = 0 et 10 mg/L Pas d’influence de AH sur adsorption du Cu sur le sédiment brut Diminution de la quantité de Cu fixée à p. H basique Décalage du profil d’adsorption Lorsque [AH] = 50 mg/L

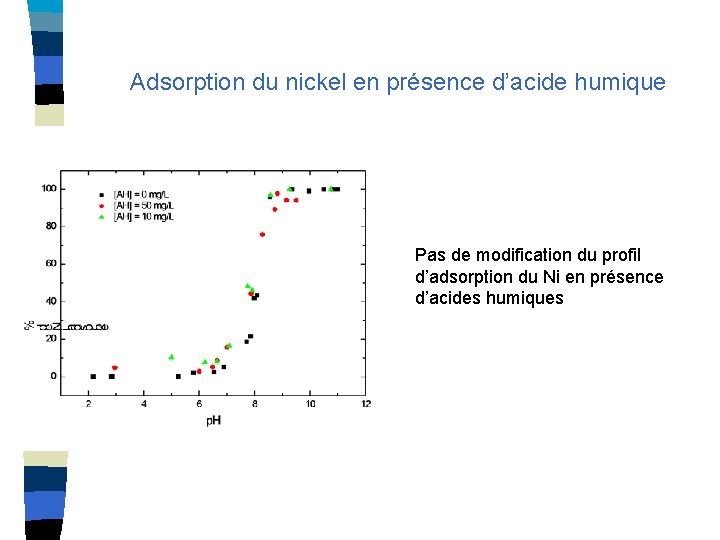
Adsorption du nickel en présence d’acide humique Pas de modification du profil d’adsorption du Ni en présence d’acides humiques

CONCLUSIONS Matière organique particulaire Nickel Pas d’influence de MOP sur fixation 1 stœchiométrie de complexation de surface sur oxydes de fer n Cuivre Réactivité de la MOP vis à vis du Cu 2 stœchiométries de complexation de surface sur oxydes de fer + MOP n Matière organique dissoute Nickel Pas d’influence sur fixation n Cuivre Adsorption favorisée à p. H acide Maintien en solution du Cu à p. H basique n

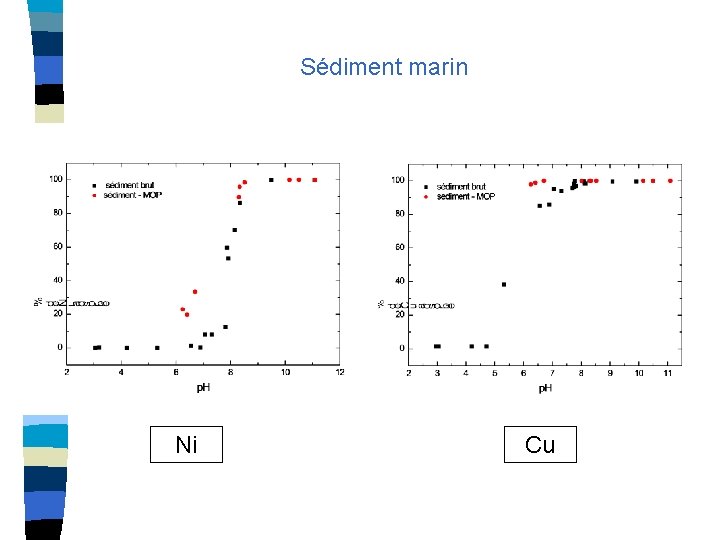
PERSPECTIVES Comprendre la différence de comportement du Ni entre un sédiment lacustre et un sédiment de rivière Peut être envisager une caractérisation plus précise de la MOP? Introduire des stœchiométries de complexation en solution dans le modèle Rendre compte du rôle de MOD dans la solution Comparer les résultats obtenus sur sédiment lacustre et de rivière à un sédiment marin Quelques résultats…

Sédiment marin Ni Cu
 Exemple de situation-problème en chimie organique
Exemple de situation-problème en chimie organique Microangiopathie organique
Microangiopathie organique Chimie organique descriptive
Chimie organique descriptive 6 postulats de la théorie particulaire
6 postulats de la théorie particulaire Modèle particulaire dissolution
Modèle particulaire dissolution Matire noir
Matire noir La matire
La matire Matire
Matire La matire
La matire Run length encoding
Run length encoding Rle 162
Rle 162 Rle ide
Rle ide Rle dvt
Rle dvt Half wave rectifier example
Half wave rectifier example Corpuri care au forma proprie si volum propriu
Corpuri care au forma proprie si volum propriu Prisme et pyramide exercices
Prisme et pyramide exercices Eau solide
Eau solide Temperatura
Temperatura Solide liquide gaz
Solide liquide gaz Solide ionique
Solide ionique David kazwini
David kazwini Soluzione gassosa
Soluzione gassosa Solido sinonimo
Solido sinonimo Solide ionique
Solide ionique Tp équilibre d'un solide soumis à trois forces
Tp équilibre d'un solide soumis à trois forces Theorie rpev
Theorie rpev