Qumic a CTe SP Tecnologias Integradas de Produo



















- Slides: 28

Químic a CTe. SP: Tecnologias Integradas de Produção Industrial Equilíbrio Ácido-Base Valentim M B Nunes Unidade Departamental de Engenharias Instituto Politécnico de Tomar, fevereiro, 2021

Equilíbrio Ácido-Base FAs reacções ácido-base têm grande importância em Química, intervindo em numerosos processos químicos industriais e em processos biológicos. F Em muitos destes processos é fundamental o controlo das características ácido-base do meio.

Ácidos e Bases de Arrhenius Definições de Arrhenius Um ácido é uma substância que quando dissolvida em água liberta iões hidrogénio, H+. Uma base é uma substância que, quando dissolvida em água (ou reagindo com água), origina iões OH-. HCl (aq) H+ (aq) + Cl- (aq) Na. OH (aq) Na+ (aq) + OH- (aq) As definições de Arrhenius são limitadas pois aplicam-se apenas a soluções aquosas.

Ácidos e Bases de Bronsted Definições mais gerais foram propostas pelo Químico Johannes Bronsted: Um ácido é um dador de protões e uma base é um aceitador de protões. HCl H+ + Cl. Na realidade, o ião H+ não existe “livre” em solução, mas hidratado por moléculas de água. Assim a reacção deve escrever-se: HCl (aq) + H 2 O (l) H 3 O+ (aq) + Cl- (aq)

Pares ácido/base conjugados Define-se par ácido-base conjugado, como um ácido e a sua base conjugada e vice-versa. A base conjugada é a espécie que resulta da remoção de um protão a um ácido. Um ácido conjugado resulta da adição de um protão a uma base de Bronsted. NH 3 (aq)+ H 2 O (l) base 1 ácido 2 CH 3 COOH(aq) + H 2 O (l) ácido 1 base 2 NH 4+ (aq) + OH- (aq) ácido 1 base 2 CH 3 COO- (aq) + H 3 O+ (aq) base 1 ácido 2 Se um ácido é forte, a força da respectiva base conjugada não é mensurável. A base conjugada de um ácido fraco é igualmente uma base fraca! A água é uma substância anfotérica.

Força relativa de ácidos Considere-se a seguinte reacção ácido-base: A + H 2 O B + H 3 O+ Podemos escrever a constante de equilíbrio: Em soluções diluídas a concentração de água é aproximadamente constante, logo: Ka é a constante de ionização do ácido ou constante de acidez.

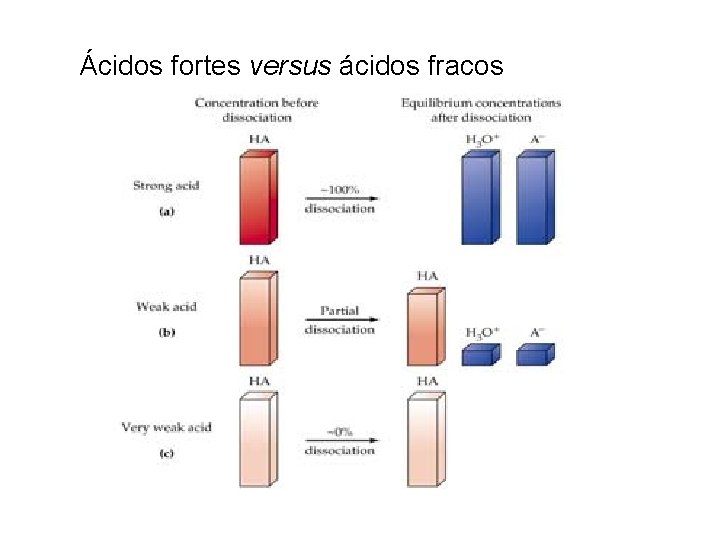
Ácidos fortes versus ácidos fracos

Força relativa de bases Para uma base fraca obtemos: Kb é a constante de ionização da base ou constante de basicidade

Produto iónico da água Para a reacção de autoionização da água: 2 H 20 (l) OH- (aq) + H 3 O+(aq) Kw é o produto iónico da água. A 25 ºC, Kw = 1× 10 -14 Para um par ácido-base conjugado, obtém-se:

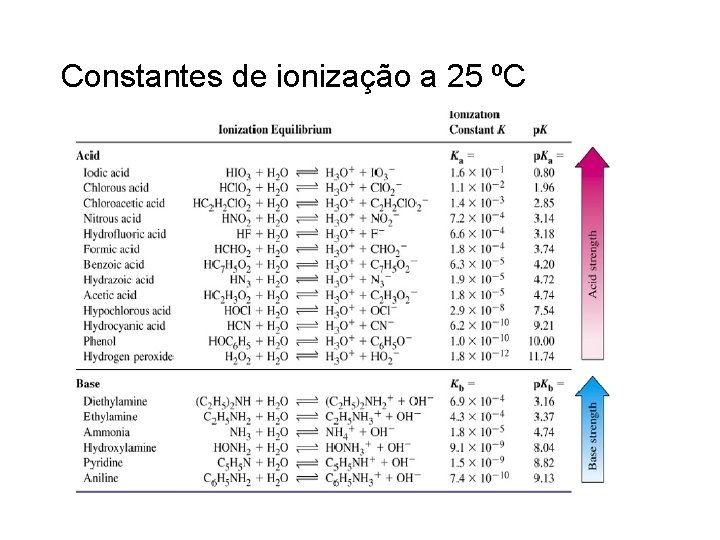
Constantes de ionização a 25 ºC

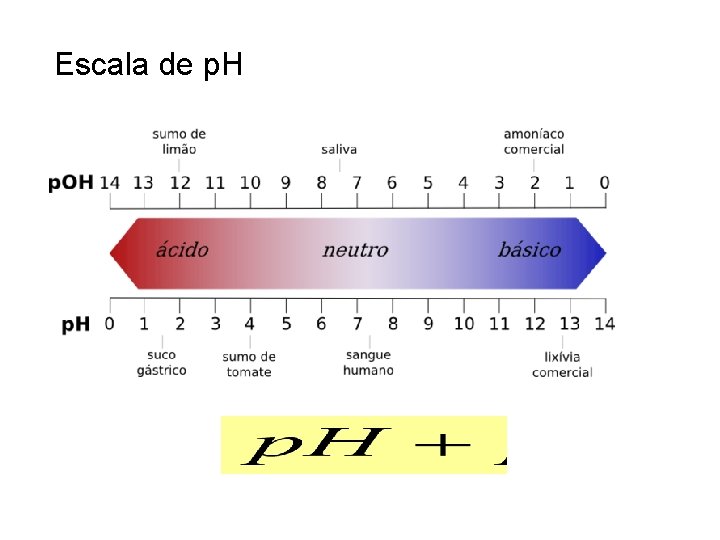
Conceito de p. H A escala de Sorensen permite traduzir a concentração de iões H+ através da relação: A 25 ºC, para a água pura obtemos: p. H = 7 é o p. H neutro.

Escala de p. H

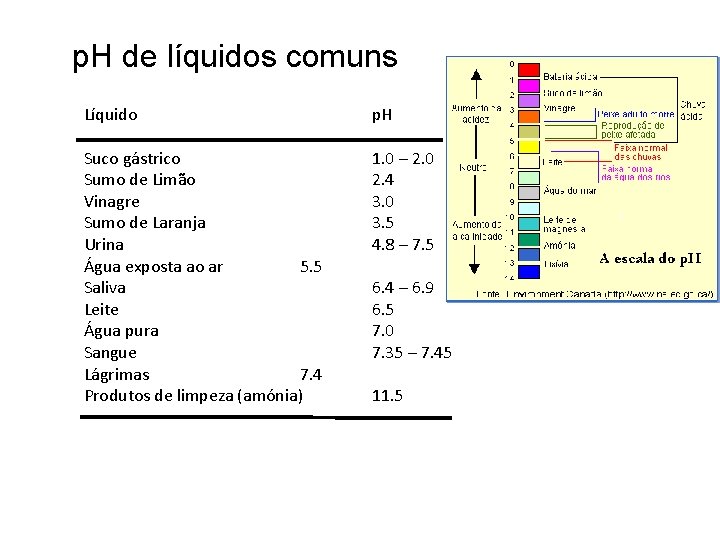
p. H de líquidos comuns Líquido p. H Suco gástrico Sumo de Limão Vinagre Sumo de Laranja Urina Água exposta ao ar 5. 5 Saliva Leite Água pura Sangue Lágrimas 7. 4 Produtos de limpeza (amónia) 1. 0 – 2. 0 2. 4 3. 0 3. 5 4. 8 – 7. 5 6. 4 – 6. 9 6. 5 7. 0 7. 35 – 7. 45 11. 5

Exercício 1. A tabela a seguir fornece a concentração hidrogeniónica ou de iões hidroxilo a 25°C, em mol/L, de alguns produtos. Calcular o respectivo p. H Exercício 2. O produto iónico (Kw) é 2, 5 x 10– 14, a 37 ºC. Calcule o p. H da água pura a essa temperatura.

Exercício 3. Considere-se a reacção: HCOOH (aq) H+ (aq) + HCOO- (aq) Calcular o p. H de uma solução 0. 1 M de HCOOH sabendo que Ka = 1. 7× 10 -4. Exercício 4. Calcular o p. H de uma solução de metilamina 0. 26 M, sabendo que Kb = 4. 4× 10 -4 CH 3 NH 2 + H 2 O CH 3 NH 3+ + OH-

Hidrólise salina O termo hidrólise salina (ou hidrólise) descreve a reacção de um anião ou catião de um sal, ou de ambos, com a água. Esta reacção pode afectar o p. H! Na. NO 3(aq) Na+(aq) + NO 3 -(aq) O ião NO 3 - provêm de um ácido forte (HNO 3) e não tem afinidade com o ião H+, logo não reage. O Na+ provêm de uma base forte e também não reage. A solução aquosa de nitrato de sódio é neutra. Geralmente, as soluções aquosas de metais alcalinos ou alcalino-terrosos são neutras!

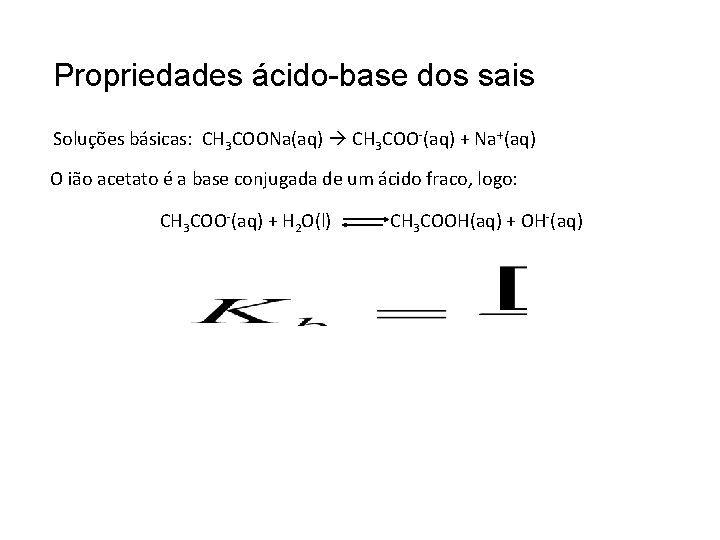
Propriedades ácido-base dos sais Soluções básicas: CH 3 COONa(aq) CH 3 COO-(aq) + Na+(aq) O ião acetato é a base conjugada de um ácido fraco, logo: CH 3 COO-(aq) + H 2 O(l) CH 3 COOH(aq) + OH-(aq)

Exercício 5. Calcular o p. H de uma solução 0. 15 M de acetato de sódio.

Soluções ácidas (produzidas por sais) NH 4 Cl(aq) NH 4+(aq) + Cl-(aq) O ião cloreto não hidrolisa, mas o ião NH 4+ é um ácido conjugado de uma base fraca, logo: NH 4+(aq) + H 2 O(l) Dá origem a uma solução ácida! NH 3(aq) + H 3 O+(aq)

Propriedades ácido-base dos sais (resumo) Tipo catião de base forte e anião de acido forte Catião de base forte e anião de ácido fraco catião de base fraca e anião de ácido forte catião de base fraca e anião de ácido fraco Catião pequeno fortemente carregado Exemplos Na. Cl KNO 3 etc. . CH 3 COONa KNO 2 etc. NH 4 Cl NH 4 NO 3 NH 4 NO 2 NH 4 CN Al. Cl 3 Fe(NO 3)3 Iões que hidrolisam nenhum anião catião anião e catião hidratado p. H da solução 7 > 7 (básico) < 7 (ácido) < 7 se Kb < Ka ~ 7 se Kb Ka > 7 se Kb > Ka <7

Efeito do ião comum A presença de um ião comum elimina a ionização de um ácido fraco ou de uma base fraca. CH 3 COONa(s) CH 3 COO-(aq) + Na+ (aq) CH 3 COOH(aq) CH 3 COO-(aq) + H+ (aq) Lei de Le Chatelier! Uma solução contendo CH 3 COOH e CH 3 COONa será menos ácida que uma solução contendo apenas CH 3 COOH na mesma concentração!

Equação de Henderson-Hasselbalch Consideremos um ácido fraco: HA(aq) H+(aq) + A-(aq) Geralmente são conhecidas as concentrações iniciais do ácido fraco e do sal. Desde que sejam elevadas ( > 0. 1 M) podemos usar as concentrações iniciais como concentrações de equilíbrio.

Exercício 6. Qual é o p. H de uma solução 0. 3 M de HCOOH e 0. 52 M em HCOOK?

Soluções tampão Uma solução tampão é uma solução de um ácido ou base fraca, de um seu sal, com ambos os componentes presentes. Tem a capacidade de resistir a variações no p. H resultantes da adição de pequenas quantidades de ácidos ou bases. São muito importantes em sistemas químicos e biológicos!

Exercício 7. Calcular o p. H de um sistema tampão NH 3(0. 3 M)/NH 4 Cl(0. 36 M).

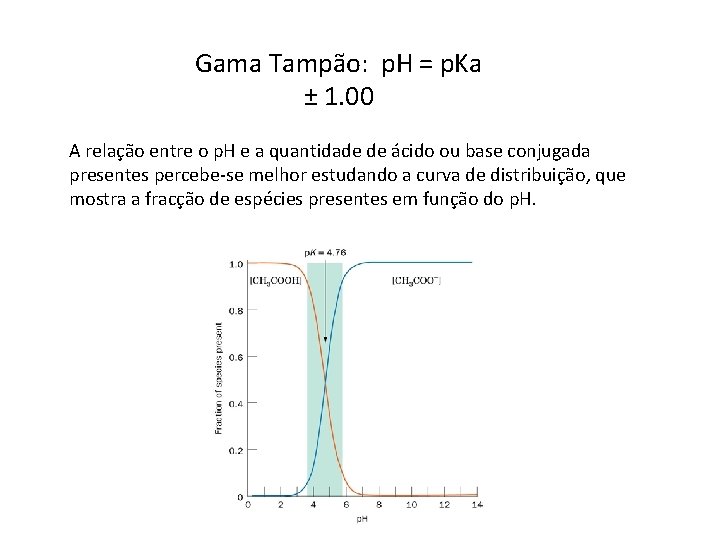
Gama Tampão: p. H = p. Ka ± 1. 00 A relação entre o p. H e a quantidade de ácido ou base conjugada presentes percebe-se melhor estudando a curva de distribuição, que mostra a fracção de espécies presentes em função do p. H.

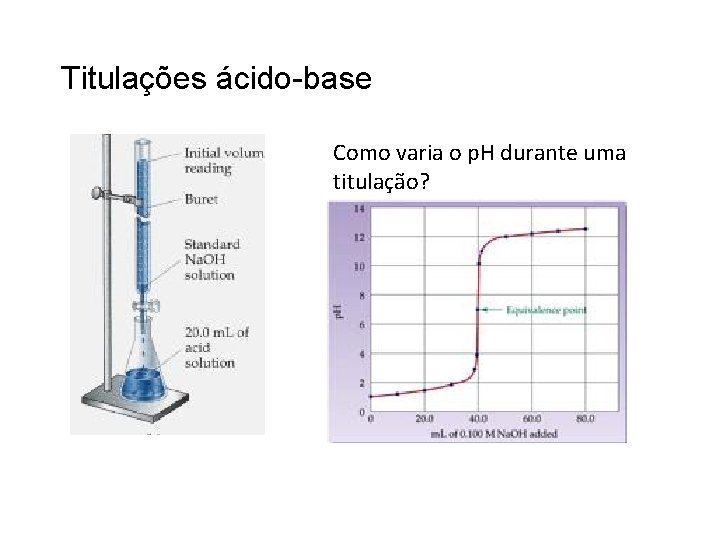
Titulações ácido-base Como varia o p. H durante uma titulação?

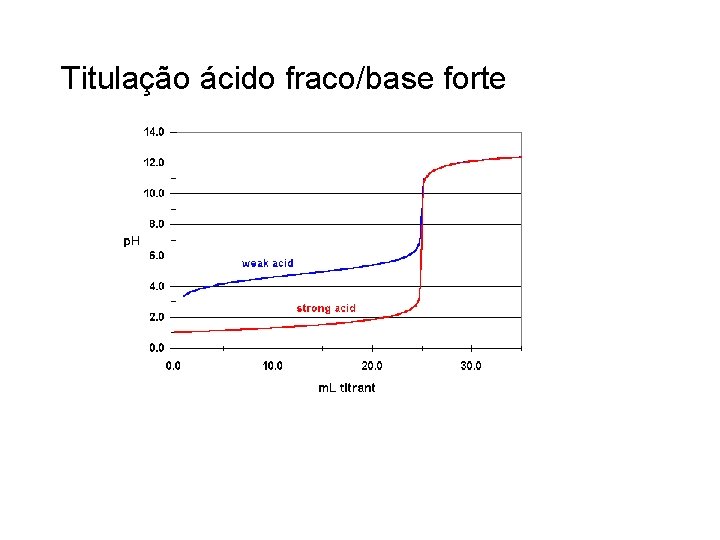
Titulação ácido fraco/base forte
 Qumic
Qumic Produo pamplona
Produo pamplona Ejemplos de tareas integradas para primaria
Ejemplos de tareas integradas para primaria Linealización de eadie hofstee
Linealización de eadie hofstee Redes integradas de servicios de salud
Redes integradas de servicios de salud Cuaderno de áreas integradas
Cuaderno de áreas integradas Faculdades integradas de caratinga
Faculdades integradas de caratinga Nuevas tecnologias
Nuevas tecnologias Infraestructura de ti y tecnologías emergentes
Infraestructura de ti y tecnologías emergentes Farmacos me too
Farmacos me too 4 tecnologias limpas
4 tecnologias limpas Novas tecnologias da comunicação aveiro
Novas tecnologias da comunicação aveiro Tecnologia end of pipe
Tecnologia end of pipe Cte slogans
Cte slogans Formula de volumen especifico
Formula de volumen especifico Cte school new mexico
Cte school new mexico Cte revitalization grant
Cte revitalization grant Cte technical skills assessments.azed.gov/student
Cte technical skills assessments.azed.gov/student Texas cte teks
Texas cte teks V=cte
V=cte F
F Abbott concur
Abbott concur Hisd cte
Hisd cte Lavecs
Lavecs Hensler cte center
Hensler cte center Lrfd
Lrfd Cte cimientos
Cte cimientos Perkins v texas
Perkins v texas Teks cte
Teks cte