Estructura dels slids Enlla Qumic Als slids les








- Slides: 14

Estructura dels sòlids. Enllaç Químic. � Als sòlids, les partícules què els formen es troben fortament lligades les unes a les altres, de tal forma què estan a prop les unes a les altres com és possible i tenen la llibertat de moviment molt limitada. � De fet aquestes partícules només poden vibrar al voltant de la seva posició d’equilibri. � La diferència d’electronegativitat entre els àtoms determina la polaritat de l’enllaç, recordem del tema anterior la següent gradació dels enllaços: ◦ Enllaç covalent apolar: ◦ Enllaç covalent polar: ◦ Enllaç iònic: � Però quina diferència hi ha entre un enllaç iònic i altre covalent?

Tipus d’enllaç. � El que determina el tipus d’enllaç és el grau de compartició dels electrons que intercanvien els àtoms: ◦ Enllaç iònic: Els àtoms s’intercanvien electrons, no hi ha compartició d’electrons. ◦ Enllaç covalent: Els electrons es comparteixen entre àtoms adjacents. ◦ Enllaç metàl·lic: Els electrons es comparteixen entre tots els àtoms de la xarxa cristal·lina.

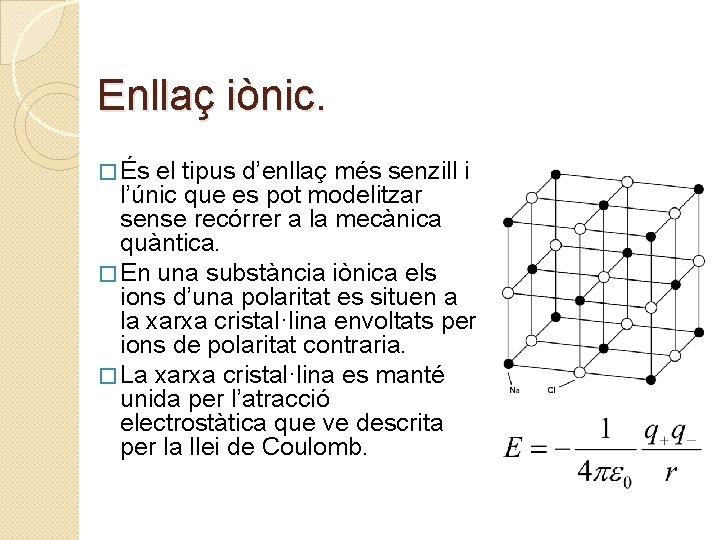
Enllaç iònic. � És el tipus d’enllaç més senzill i l’únic que es pot modelitzar sense recórrer a la mecànica quàntica. � En una substància iònica els ions d’una polaritat es situen a la xarxa cristal·lina envoltats per ions de polaritat contraria. � La xarxa cristal·lina es manté unida per l’atracció electrostàtica que ve descrita per la llei de Coulomb.

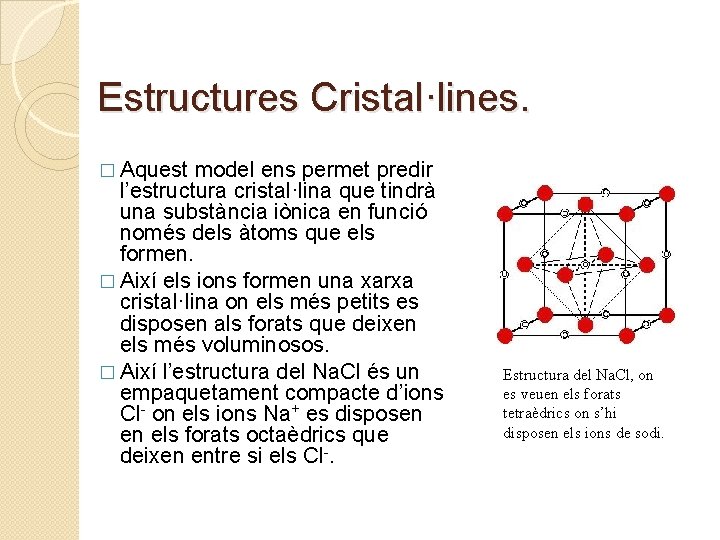
Estructures Cristal·lines. � Aquest model ens permet predir l’estructura cristal·lina que tindrà una substància iònica en funció només dels àtoms que els formen. � Així els ions formen una xarxa cristal·lina on els més petits es disposen als forats que deixen els més voluminosos. � Així l’estructura del Na. Cl és un empaquetament compacte d’ions Cl- on els ions Na+ es disposen en els forats octaèdrics que deixen entre si els Cl-. Estructura del Na. Cl, on es veuen els forats tetraèdrics on s’hi disposen els ions de sodi.

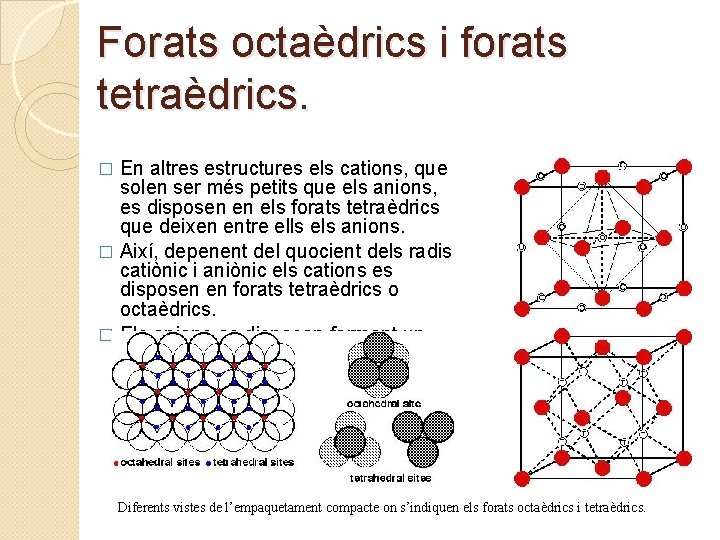
Forats octaèdrics i forats tetraèdrics. En altres estructures els cations, que solen ser més petits que els anions, es disposen en els forats tetraèdrics que deixen entre ells els anions. � Així, depenent del quocient dels radis catiònic i aniònic els cations es disposen en forats tetraèdrics o octaèdrics. � Els anions es disposen formant un empaquetament compacte d’esferes. � Diferents vistes de l’empaquetament compacte on s’indiquen els forats octaèdrics i tetraèdrics.

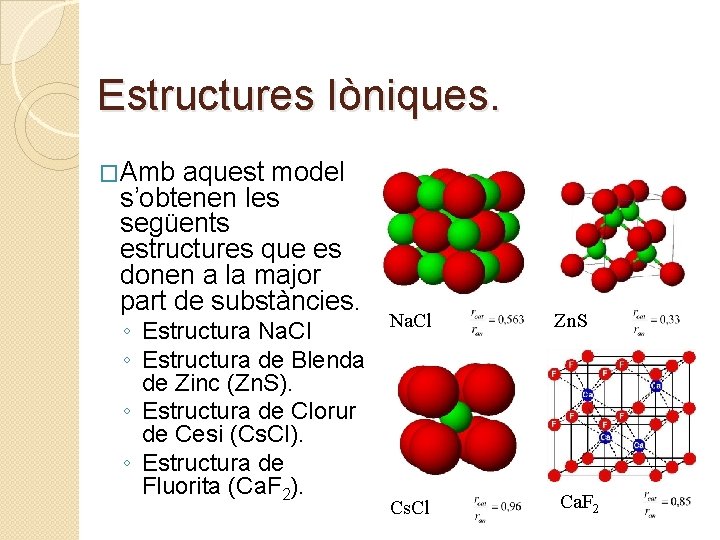
Estructures Iòniques. �Amb aquest model s’obtenen les següents estructures que es donen a la major part de substàncies. ◦ Estructura Na. Cl ◦ Estructura de Blenda de Zinc (Zn. S). ◦ Estructura de Clorur de Cesi (Cs. Cl). ◦ Estructura de Fluorita (Ca. F 2). Na. Cl Zn. S Cs. Cl Ca. F 2

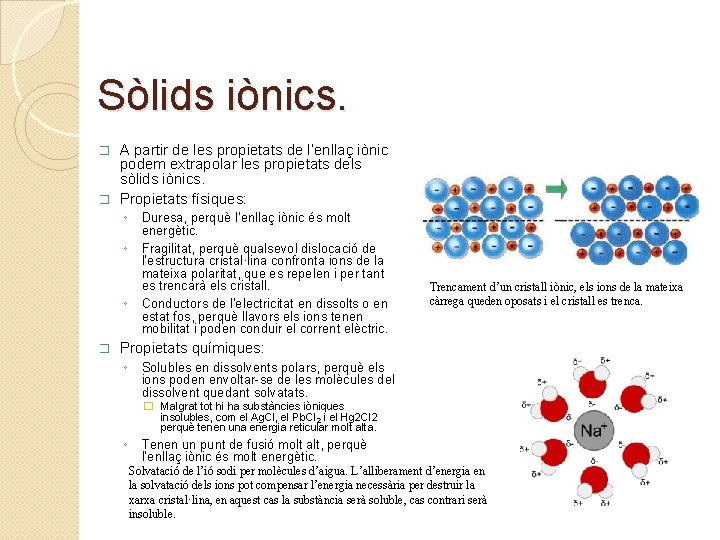
Sòlids iònics. A partir de les propietats de l’enllaç iònic podem extrapolar les propietats dels sòlids iònics. � Propietats físiques: � ◦ ◦ ◦ � Duresa, perquè l’enllaç iònic és molt energètic. Fragilitat, perquè qualsevol dislocació de l’estructura cristal·lina confronta ions de la mateixa polaritat, que es repelen i per tant es trencarà els cristall. Conductors de l’electricitat en dissolts o en estat fos, perquè llavors els ions tenen mobilitat i poden conduir el corrent elèctric. Trencament d’un cristall iònic, els ions de la mateixa càrrega queden oposats i el cristall es trenca. Propietats químiques: ◦ Solubles en dissolvents polars, perquè els ions poden envoltar-se de les molècules del dissolvent quedant solvatats. � Malgrat tot hi ha substàncies iòniques insolubles, com el Ag. Cl, el Pb. Cl 2 i el Hg 2 Cl 2 perquè tenen una energia reticular molt alta. ◦ Tenen un punt de fusió molt alt, perquè l’enllaç iònic és molt energètic. Solvatació de l’ió sodi per molècules d’aigua. L’alliberament d’energia en la solvatació dels ions pot compensar l’energia necessària per destruir la xarxa cristal·lina, en aquest cas la substància serà soluble, cas contrari serà insoluble.

Propietats dels sòlids covalents. �Els enllaços covalents són els únics que formen molècules discretes, per tant les propietats dels sòlids covalents venen determinades no tan sols per les propietats de l’enllaç covalent, sinó també per les propietats dels enllaços intermoleculars. �Així podem distingir dos tipus de sòlids formats per enllaços covalents: ◦ Sòlids covalents: Són sòlids formats per una xarxa d’àtoms units per enllaços covalents. ◦ Sòlids moleculars: Són sòlids formats per molècules formades per enllaços covalents i unides per enllaços intermoleculars.

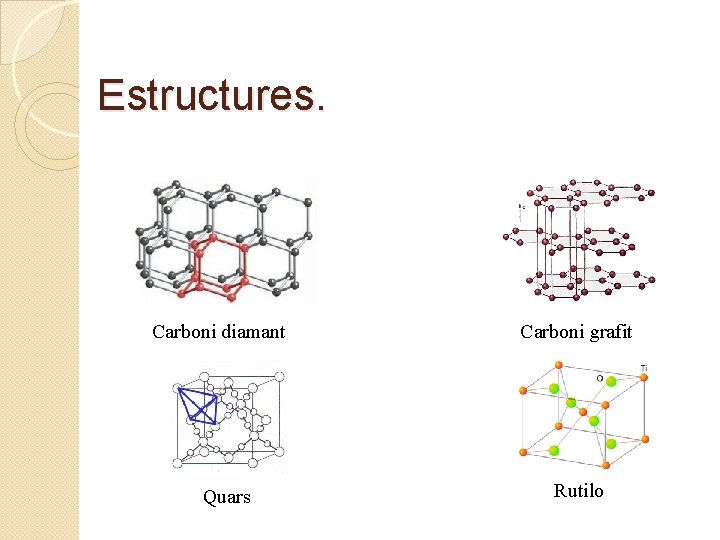
Sòlids covalents. L’enllaç covalent és un enllaç molt energètic i per tant és d’esperar que les substàncies covalents siguin de les més dures que podem trobar. � Però com que l’enllaç covalent és un enllaç direccional és d’esperar que les substàncies covalents tinguin propietats diferents segons la direcció en què apliquem l’esforç. � Així trobem que el diamant (C) i el quars (Si. O 2) són unes de les substàncies més dures que es coneixen, en canvi el grafit (C) i el rutilo (Ti. O 2) són substàncies exfoliables, es poden extreure làmines, la qual cosa vol dir que són molt dures en una direcció però molt toves a la direcció perpendicular. � Així tan el diamant com la sílice són sòlids reticulats amb enllaços covalents a totes direccions. � ◦ ◦ � El diamant està format per carbonis sp 3, que formen enllaços covalents a totes les direccions. El quars està format per àtoms de silici, també amb hibridació sp 3, envoltats per àtoms d’oxigen que fan de pont entre els àtoms de silici. En canvi el grafit i el rutilo encara que també són substàncies formades per enllaç os covalents, estan formades per làmines fortament unides, però amb una dèbil unió entre elles, per això s’exfolien. ◦ ◦ El grafit està format per carbonis sp 2, que formen cicles amb dobles enllaços alternats, per tant al igual que els compostos aromàtics tenen una gran estabilitat. Però les làmines estan dèbilment unides entre elles per l’efecte de dispersió del sistema π, per això s’exfolia amb facilitat. El rutilo és l’òxid de titani en principi forma una estructura tetraèdrica però com que el titani és un d 2 s’estabilitza una estructura quadrada plana enlloc d’una tetraèdrica, la qual cosa fa que l’estructura s’aplani. El resultat és una estructura intermèdia entre l’estructura tetraèdrica i la plana quadrada, que formen làmines que es poden unir entre elles per forces de dispersió igual que el grafit. Les forces de dispersió s’estableixen entre els orbitals dz 2, queden lliures.

Estructures. Carboni diamant Quars Carboni grafit Rutilo

Propietats del sólids covalents. �Propietats físiques: ◦ Duresa, perquè l’enllaç covalent és molt energètic. ◦ Fragilitat, perquè qualsevol dislocació de l’estructura cristal·lina trenca els enllaços, que no es poden reconstruir si no es fon una altra vegada l’estructura. ◦ Dielèctrics donat que els electrons estan confinats al enllaços, malgrat que alguns sòlids covalents, com el grafit poden presentar conducció. �El grafit presenta una banda de conducció perquè els electrons presenten mobilitat pel sistema π. ◦ Insolubles en qualsevol dissolvent, donat que l’enllaç és tan fort que les molècules de dissolvent no poden solvatar els àtoms. ◦ Tenen un punt de fusió molt alt, perquè l’enllaç

Sòlids moleculars. �Les substàncies que estan formades per molècules presenten una diversitat d’estructures molt gran, depenent de la simetria de la molècula que els forma. �Malgrat tot trobem que, depenent de la polaritat de l’enllaç covalent es poden formar diferents tipus d’enllaços intermoleculars. �Aquests enllaços intermoleculars poden ser: ◦ Forces de dispersió. ◦ Enllaços de pont d’hidrogen.

Forces de dispersió. � Les forces de dispersió són les que es donen entre molècules apolars, o dèbilment polars, i poden ser de dos tipus: ◦ ◦ Dipol instantani - dipol induït. Dipol – dipol. � Un dipol elèctric és un sistema format per dues càrregues situades molt properes una de l’altre, per tant des d’una gran distància del dipol no es pot discriminar entre el camp generat per una càrrega i l’altra, i només es pot distingir la suma de tots dos. Les forces de dispersió tenen en general un caràcter dipolar, per tant actuen només a distàncies molt curtes, donat que el camp dipolar s’esmorteeix molt ràpidament. � Com veiem la força elèctrica produïda per un dipol s’esmorteeix en funció inversa al cub de la distància al dipol i no en funció inversa al quadrat de la distància com s’observa al camp creat per una càrrega puntual. � Això explica la debilitat de l’enllaç entre molècules envers l’enllaç entre àtoms. �

Enllaç de pont d’hidrogen. � � � Si la diferència d’electronegativitat és molt alta, el núvol electrònic es desplaça molt cap a l’àtom més electronegatiu. Per altre banda si l’àtom menys electronegatiu és l’hidrogen, aquest es queda gairebé sense electrons, per tant, pot formar enllaços amb qualsevol altre àtom, es converteix en un acceptor d’electrons. L’àtom d’hidrogen es queda en una situació intermèdia entre un àtom i altre, formant un pont. L’enllaç de pont d’hidrogen és el que explica el punt de fusió anòmal de l’aigua i de l’amoníac, i el que explica la complementarietat de les bases nitrogenades de l’ADN i les propietats de molts compostos orgànics. Si comparem el punt de fusió d’ebullició de l’aigua i de l’amoníac amb altres compostos equivalents, trobem que els punts d’ebullició són anormalment alts, i aquesta diferència es deu a l’enllaç de pont d’hidrogen. Electronegativitats Compost Molècula Punt de fusió (K) Punt de fusió (ºC) Punt d'ebullició (K) Aigua H 2 O 273, 15 0, 00 373, 15 Sulfur d'hidrogen H 2 S 187, 00 -86, 15 213, 00 Seleniur d'hidrogen H 2 Se 231, 90 -41, 25 207, 42 Telurur d'hidrogen H 2 Te 224, 15 -49, 00 270, 95 Compost Amoniac Fosfina Arsina Molècula Punt de fusió (K) Punt de fusió (ºC) Punt d'ebullició (K) NH 3 195, 42 -77, 73 239, 81 PH 3 139, 00 -134, 15 185, 00 As. H 3 157, 00 -116, 15 210, 00 Punt d'ebullició (ºC) Hidrogen Element Diferència 100, 00 2, 2 3, 44 1, 24 -60, 15 2, 2 2, 58 0, 38 -65, 73 -2, 20 2, 2 2, 48 2, 10 0, 28 -0, 10 Electronegativitats Punt d'ebullició (ºC) Hidrogen Element Diferència -33, 34 2, 2 3, 04 0, 84 -88, 15 2, 2 2, 19 -0, 01 -63, 15 2, 2 2, 18 -0, 02
 Qumic
Qumic Les propietats dels minerals
Les propietats dels minerals Teodor llorente vora el barranc dels algadins
Teodor llorente vora el barranc dels algadins Vora el barranc dels algadins comentari
Vora el barranc dels algadins comentari Nutricio dels animals
Nutricio dels animals Duresa minerals
Duresa minerals Nom dels vents a catalunya
Nom dels vents a catalunya Desigualtat periòdica dels moviments de la lluna
Desigualtat periòdica dels moviments de la lluna Caracters sexuals primaris
Caracters sexuals primaris El jurament dels horacis
El jurament dels horacis Taula periodica dels elements
Taula periodica dels elements Invertebrats marins
Invertebrats marins Horacis
Horacis Acceleració
Acceleració Mare de deu dels consellers
Mare de deu dels consellers