Tema 1 Enlla qumic Per qu aquest tema



















- Slides: 45

Tema 1 Enllaç químic

Per què aquest tema? • Per què Cl 2 i no Cl? Per què CH 4 i no CH 5? • Per què el nitrogen és tan inert? • Per què la molècula de CO 2 és lineal i no angular? • Per què l’aigua és polar? • Per què l’O 2 és paramagnètic? • Per què els metalls condueixen l’electricitat? Teoria de l’enllaç químic

Teories de l’enllaç químic Teoria de Lewis Teoria de l’enllaç de valència Teoria d’orbitals moleculars

CONTINGUT 1. - Visió general de la teoria de Lewis. 2. - Introducció a l’enllaç covalent. 3. - Enllaços covalents polars. 4. - Com dibuixar estructures de Lewis? 5. - Excepcions a la regla de l’octet. 6. - La forma de les molècules. 7. - Mètode de l’enllaç de valència. 8. - Hibridació d’orbitals atòmics. 9. - Teoria d’orbitals moleculars. 10. - L’enllaç dels metalls.

1 VISIÓ GENERAL DE LA TEORIA DE LEWIS. Claus: • Els gasos nobles presenten una inèrcia química notable. • Tots (excepte l’He) tenen 8 electrons de valència. • Els àtoms tracten d’assolir configuracions electròniques de gasos nobles. estabilitat Símbols de Lewis Þ F Gilbert Newton Lewis (1875 -1946)

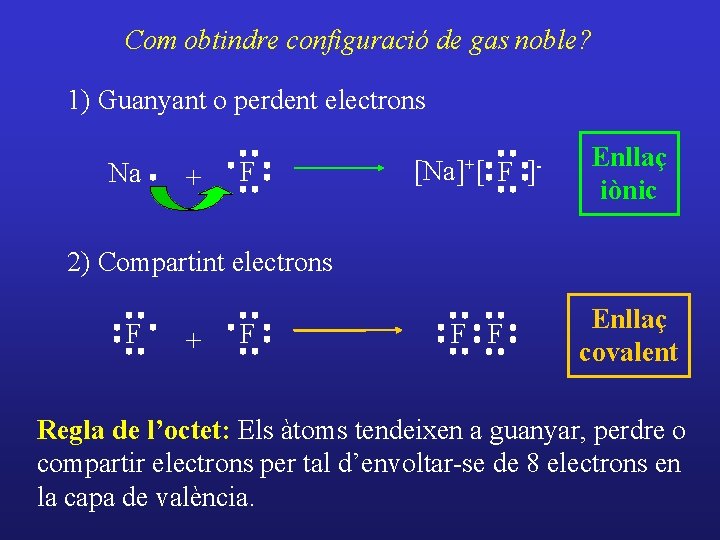
Com obtindre configuració de gas noble? 1) Guanyant o perdent electrons Na + F [Na]+[ F ]- Enllaç iònic F F Enllaç covalent 2) Compartint electrons F + F Regla de l’octet: Els àtoms tendeixen a guanyar, perdre o compartir electrons per tal d’envoltar-se de 8 electrons en la capa de valència.

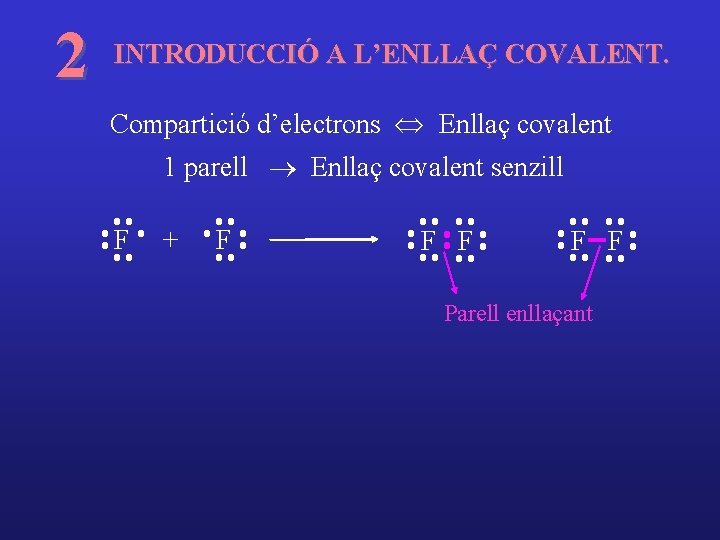
2 INTRODUCCIÓ A L’ENLLAÇ COVALENT. Compartició d’electrons Û Enllaç covalent 1 parell ® Enllaç covalent senzill F + F F F

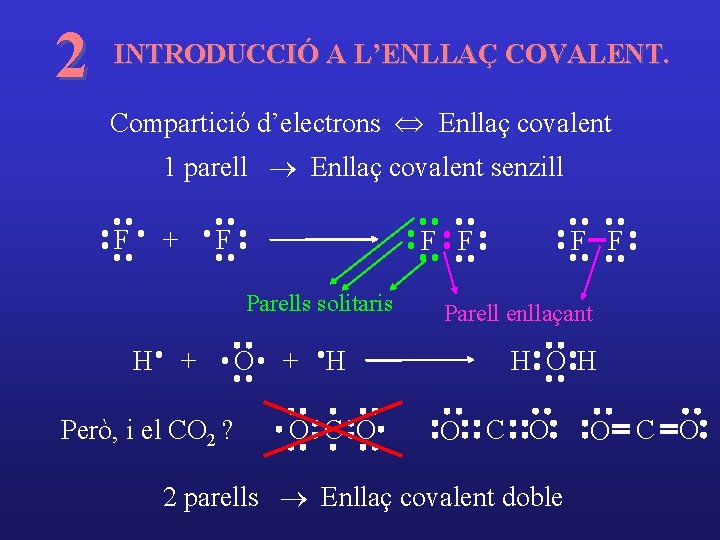
2 INTRODUCCIÓ A L’ENLLAÇ COVALENT. Compartició d’electrons Û Enllaç covalent 1 parell ® Enllaç covalent senzill F + F F F Parell enllaçant

2 INTRODUCCIÓ A L’ENLLAÇ COVALENT. Compartició d’electrons Û Enllaç covalent 1 parell ® Enllaç covalent senzill F + F F F Parells solitaris H + Però, i el CO 2 ? O + H O C O F F Parell enllaçant H OH O C O 2 parells ® Enllaç covalent doble O C O

N + N N N 3 parells ® Enllaç covalent triple Propietats del N 2 : congruents amb l’estructura de Lewis ß Distància d’enllaç molt curta Reactivitat excepcionalment baixa

3 ENLLAÇOS COVALENTS POLARS. Enllaç covalent no polar: aquell en què els dos àtoms comparteixen per igual els electrons. P. ex. : F 2 Enllaç covalent polar: aquell en què els dos àtoms no comparteixen per igual els electrons. P. ex. : HF Un dels àtoms atrau mès als electrons d’enllaç que l’altre. d+ H-F d- més electronegatiu

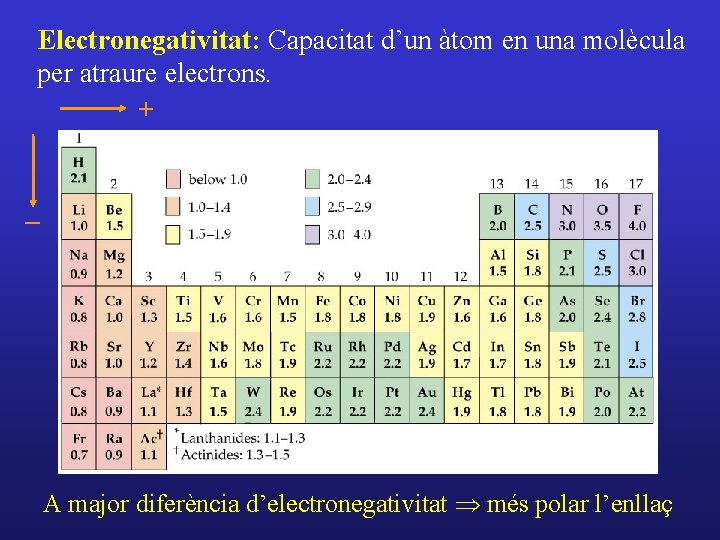
Electronegativitat: Capacitat d’un àtom en una molècula per atraure electrons. + - A major diferència d’electronegativitat Þ més polar l’enllaç

4 COM DIBUIXAR ESTRUCTURES DE LEWIS? 1) Determina el nombre total d’electrons de valència 2) Escriu l’esquelet estructural de la molècula, unint els àtoms mitjançant enllaços senzills. 3) Completa els octets dels àtoms terminals amb els electrons restants. 4) Col·loca els electrons que sobren en els àtoms centrals. 5) Si falta un octet a un àtom central, desplaça parells d’electrons solitaris dels àtoms terminals i forma enllaços múltiples.

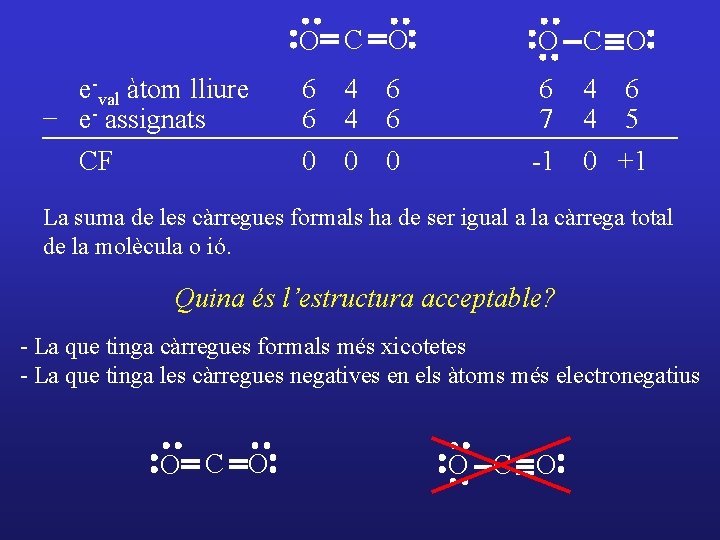
I si tenim diverses estructures de Lewis? ? O C O Càrrega formal d’un àtom: nombre d’electrons de l’àtom lliure menys el nombre d’electrons assignats a eixe àtom en l’estructura de Lewis. CF = e-val àtom lliure – e- p. solitaris – ½ e- p. enllaçants e-val àtom lliure - e- assignats CF O C O 6 6 0 6 4 6 7 4 5 -1 0 +1 4 4 0 6 6 0

e-val àtom lliure - e- assignats CF O C O 6 6 4 4 6 6 6 7 0 0 0 -1 0 +1 4 4 6 5 La suma de les càrregues formals ha de ser igual a la càrrega total de la molècula o ió. Quina és l’estructura acceptable? - La que tinga càrregues formals més xicotetes - La que tinga les càrregues negatives en els àtoms més electronegatius O C O

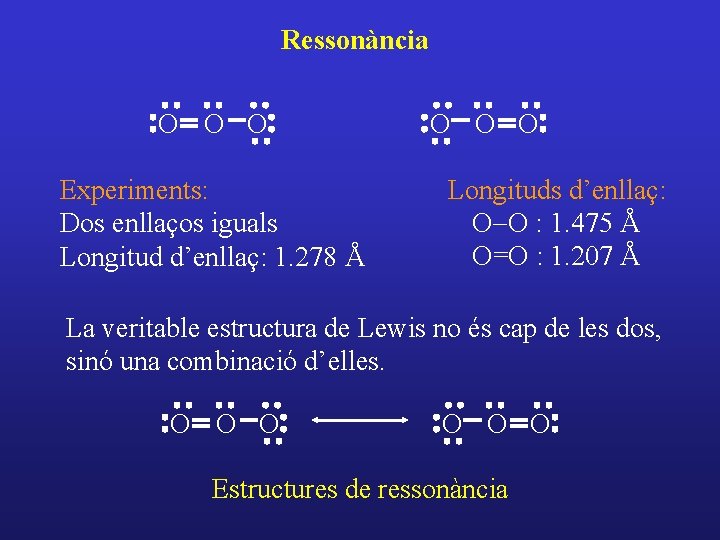
Ressonància O O O Experiments: Dos enllaços iguals Longitud d’enllaç: 1. 278 Å O O O Longituds d’enllaç: O-O : 1. 475 Å O=O : 1. 207 Å La veritable estructura de Lewis no és cap de les dos, sinó una combinació d’elles. O O O Estructures de ressonància

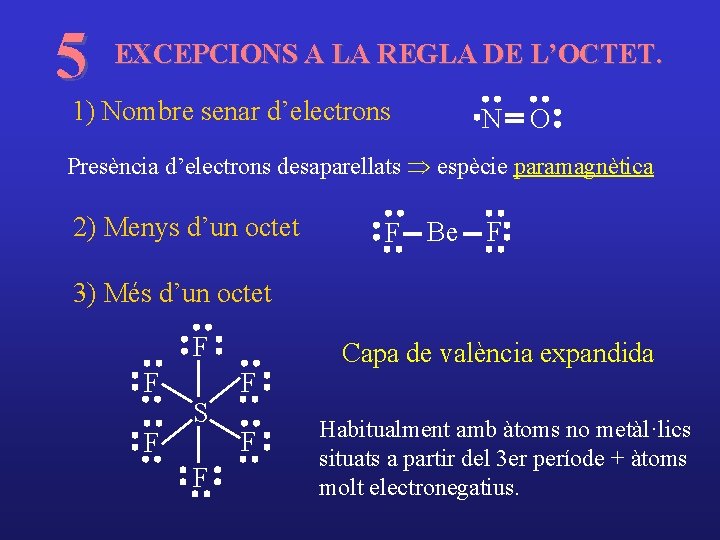
5 EXCEPCIONS A LA REGLA DE L’OCTET. 1) Nombre senar d’electrons N O Presència d’electrons desaparellats Þ espècie paramagnètica 2) Menys d’un octet F Be F 3) Més d’un octet F F F S F F F Capa de valència expandida Habitualment amb àtoms no metàl·lics situats a partir del 3 er període + àtoms molt electronegatius.

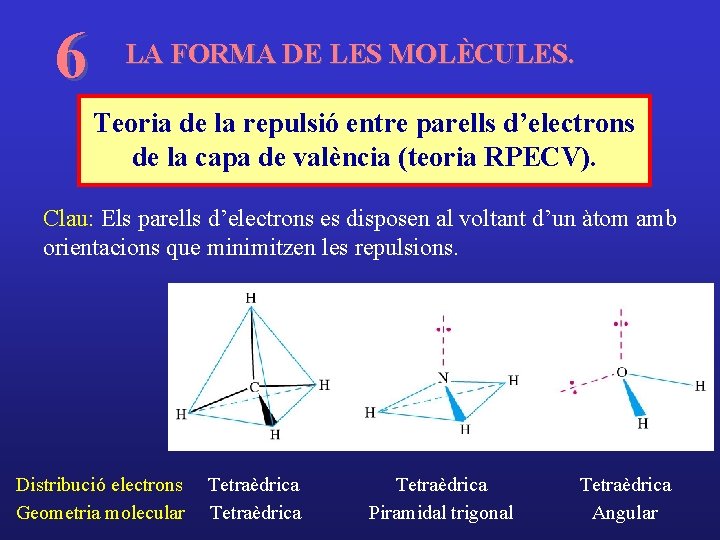
6 LA FORMA DE LES MOLÈCULES. Teoria de la repulsió entre parells d’electrons de la capa de valència (teoria RPECV). Clau: Els parells d’electrons es disposen al voltant d’un àtom amb orientacions que minimitzen les repulsions. Distribució electrons Geometria molecular Tetraèdrica Piramidal trigonal Tetraèdrica Angular

Distribucions dels electrons: Brown, taula 9. 1, pg. 298 Geometries moleculars: Brown, taules 9. 2 -9. 3, pg. 301 -302 Estratègia per tal de predir geometries moleculars: 1) Dibuixar l’estructura de Lewis. 2) Determinar la distribució dels electrons al voltant de l’àtom central que minimitza les repulsions. (Un enllaç múltiple es considera com un parell enllaçant) 3) Descriure la geometria molecular, tenint en compte si les posicions estan ocupades o no per nuclis atòmics.

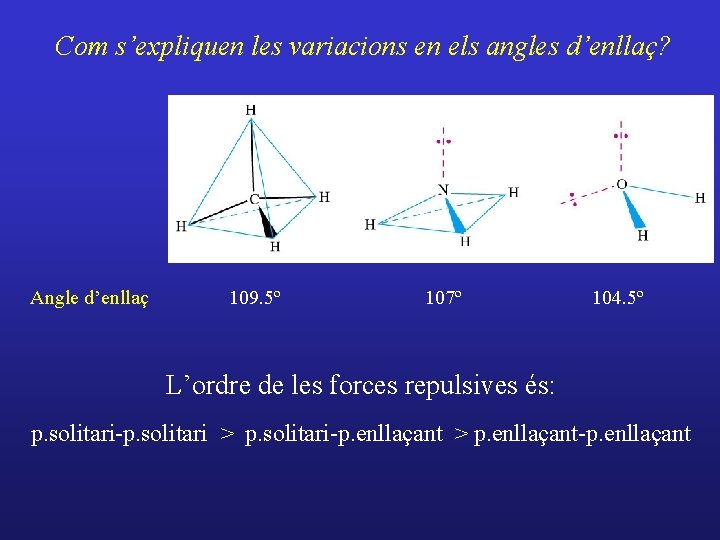
Com s’expliquen les variacions en els angles d’enllaç? Angle d’enllaç 109. 5º 107º 104. 5º L’ordre de les forces repulsives és: p. solitari-p. solitari > p. solitari-p. enllaçant > p. enllaçant-p. enllaçant

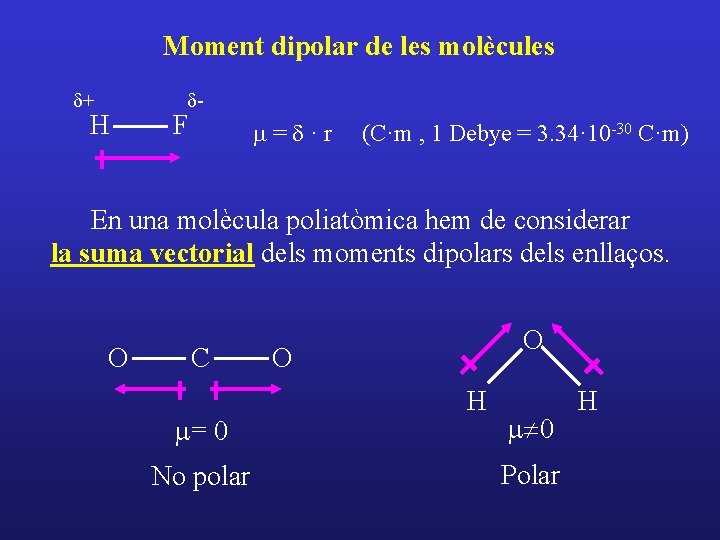
Moment dipolar de les molècules d+ H d- F m=d·r (C·m , 1 Debye = 3. 34· 10 -30 C·m) En una molècula poliatòmica hem de considerar la suma vectorial dels moments dipolars dels enllaços. O C m= 0 No polar O O H m¹ 0 Polar H

7 MÈTODE DE L’ENLLAÇ DE VALÈNCIA. Per què un altre model? La teoria de Lewis: - Presenta diverses excepcions. - No proporciona informació cuantitativa. - No explica les variacions en les energies d’enllaç. Mètode de l’enllaç de valència: descripció de la formació de l’enllaç covalent pel recobriment d’orbitals atòmics. H H 1 s 1 s recobriment La densitat de càrrega dels electrons d’enllaç es concentra en la regió del recobriment d’orbitals.

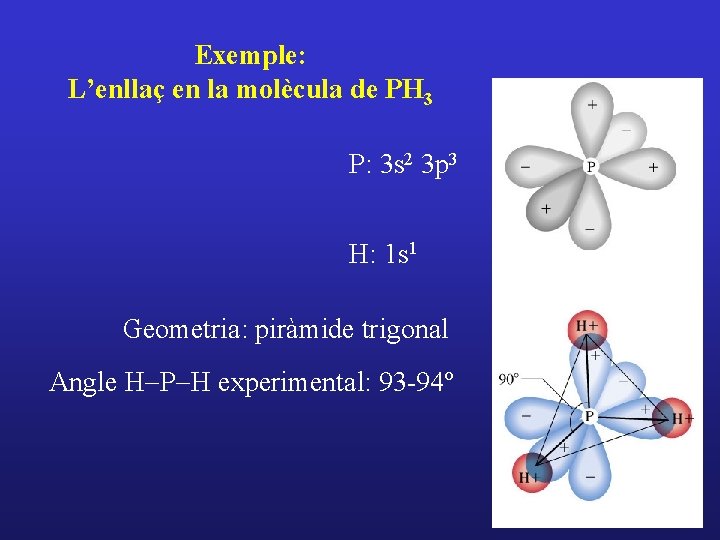
Exemple: L’enllaç en la molècula de PH 3 P: 3 s 2 3 p 3 H: 1 s 1 Geometria: piràmide trigonal Angle H-P-H experimental: 93 -94º

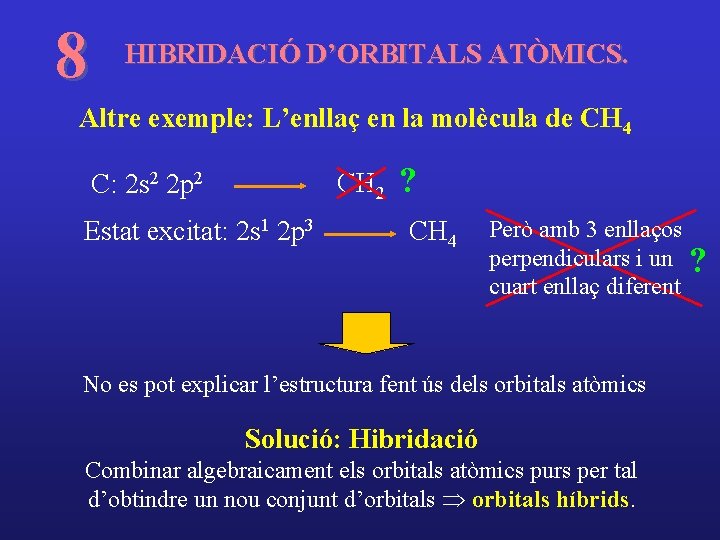
8 HIBRIDACIÓ D’ORBITALS ATÒMICS. Altre exemple: L’enllaç en la molècula de CH 4 CH 2 C: 2 s 2 2 p 2 Estat excitat: 2 s 1 2 p 3 ? CH 4 Però amb 3 enllaços perpendiculars i un ? cuart enllaç diferent No es pot explicar l’estructura fent ús dels orbitals atòmics Solució: Hibridació Combinar algebraicament els orbitals atòmics purs per tal d’obtindre un nou conjunt d’orbitals Þ orbitals híbrids.

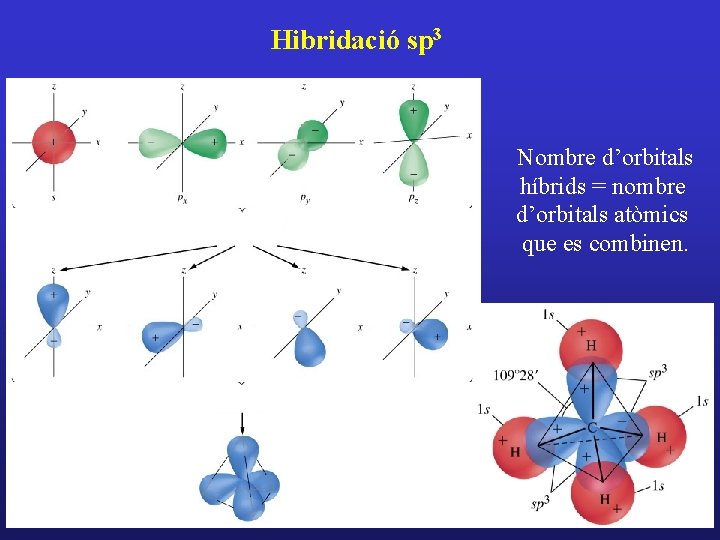
Hibridació sp 3 Nombre d’orbitals híbrids = nombre d’orbitals atòmics que es combinen.

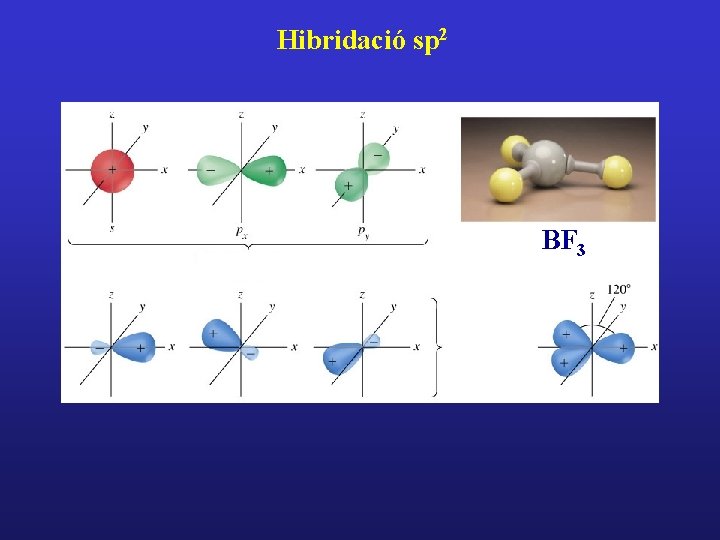
Hibridació sp 2 BF 3

Hibridació sp Be. Cl 2

Distribució geomètrica dels orbitals híbrids Orbitals híbrids Distribució geomètrica Exemple sp sp 2 sp 3 d 2 Lineal Trigonal plana Tetraèdrica Bipiràmide trigonal Octaèdrica Be. Cl 2 BF 3 CH 4 PCl 5 SF 6 Idees sobre la hibridació • Un esquema d’hibridació permet una racionalització a posteriori de la forma observada experimentalment. • La hibridació no és un fenòmen físic real. És un procediment matemàtic que fa possible explicar propietats moleculars.

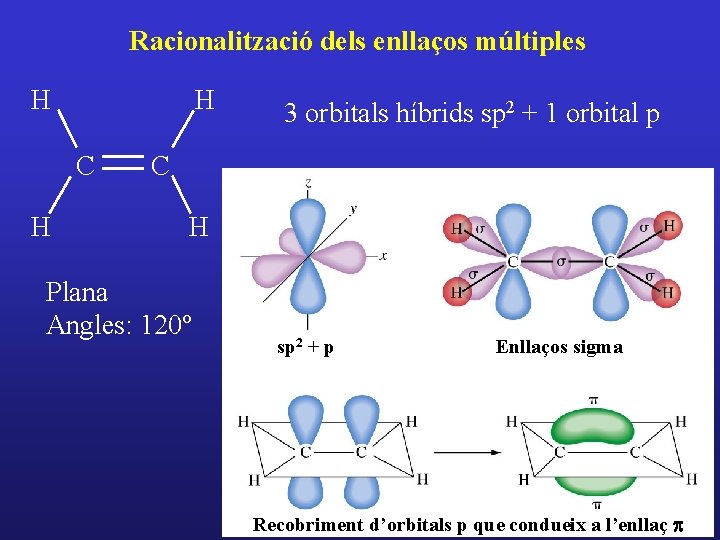
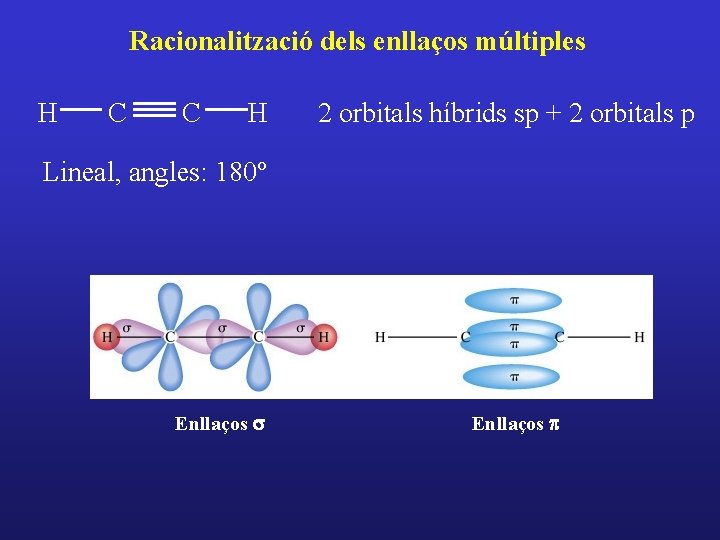
Racionalització dels enllaços múltiples H H C H 3 orbitals híbrids sp 2 + 1 orbital p C H Plana Angles: 120º sp 2 + p Enllaços sigma Recobriment d’orbitals p que condueix a l’enllaç p

Racionalització dels enllaços múltiples H C C H 2 orbitals híbrids sp + 2 orbitals p Lineal, angles: 180º Enllaços s Enllaços p

9 TEORIA D’ORBITALS MOLECULARS. Per què un altre model? Com s’explica que l’O 2 siga paramagnètic? O O Espècie paramagnètica ß Presència d’electrons desaparellats ? Teoria d’orbitals moleculars: assigna els electrons d’una molècula a una sèrie d’orbitals que pertanyen a tota la molècula.

Com podem obtindre els orbitals moleculars? Aproximació senzilla: Combinació lineal d’orbitals atòmics (CLOA) H 2 Antienllaçant + Enllaçant H+H Orbitals atòmics H 2 Orbitals moleculars Densitat electrònica Diagrama d’energia

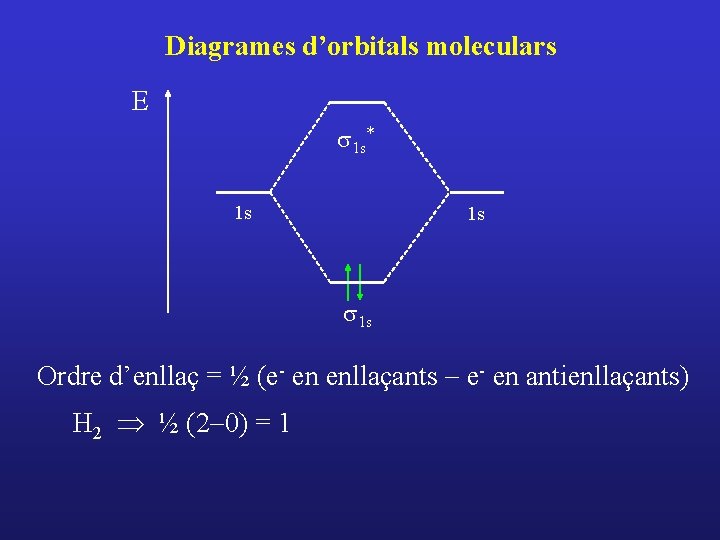
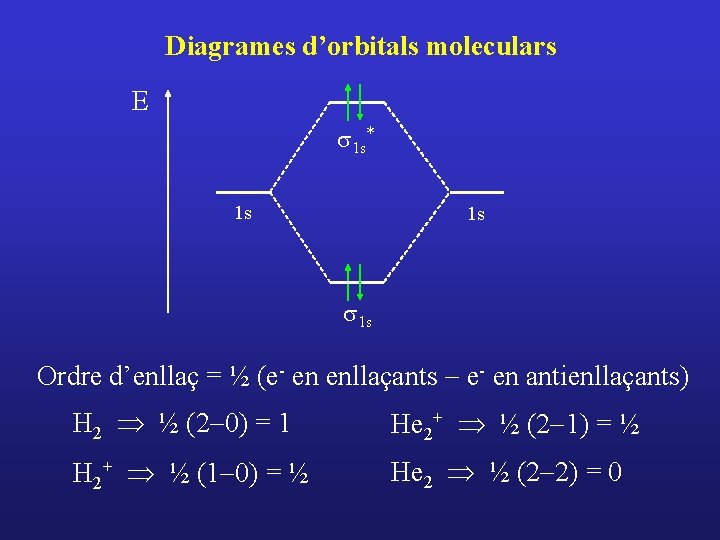
Diagrames d’orbitals moleculars E s 1 s* 1 s 1 s Ordre d’enllaç = ½ (e- en enllaçants - e- en antienllaçants) H 2 Þ ½ (2 -0) = 1

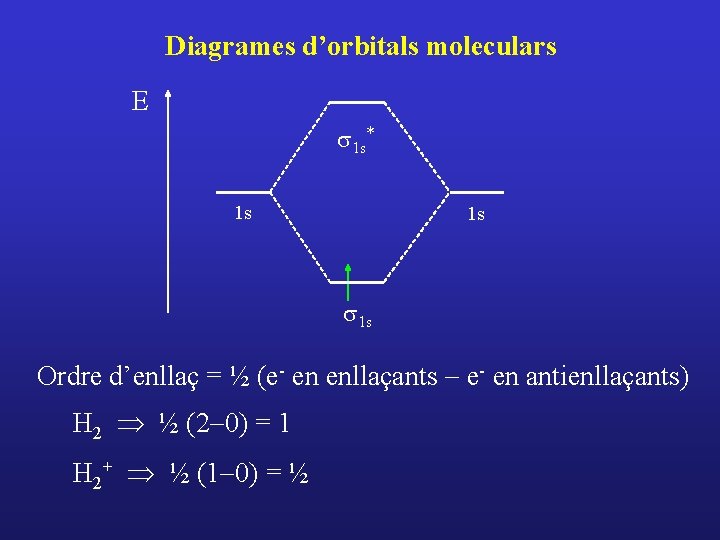
Diagrames d’orbitals moleculars E s 1 s* 1 s 1 s Ordre d’enllaç = ½ (e- en enllaçants - e- en antienllaçants) H 2 Þ ½ (2 -0) = 1 H 2+ Þ ½ (1 -0) = ½

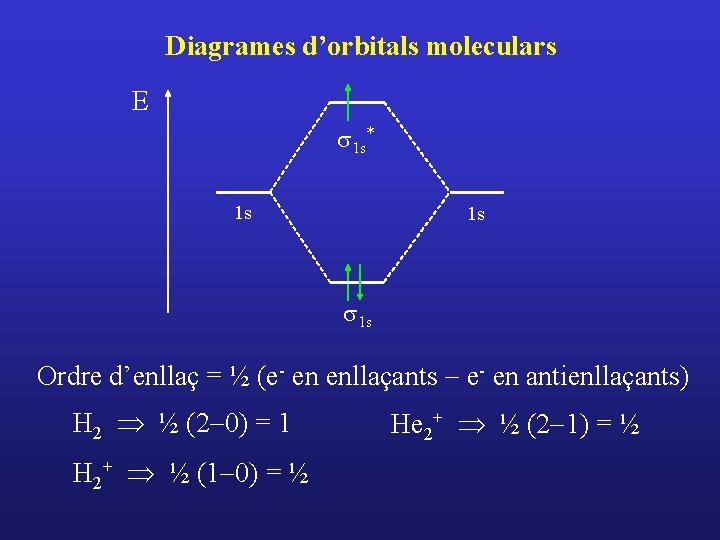
Diagrames d’orbitals moleculars E s 1 s* 1 s 1 s Ordre d’enllaç = ½ (e- en enllaçants - e- en antienllaçants) H 2 Þ ½ (2 -0) = 1 H 2+ Þ ½ (1 -0) = ½ He 2+ Þ ½ (2 -1) = ½

Diagrames d’orbitals moleculars E s 1 s* 1 s 1 s Ordre d’enllaç = ½ (e- en enllaçants - e- en antienllaçants) H 2 Þ ½ (2 -0) = 1 He 2+ Þ ½ (2 -1) = ½ H 2+ Þ ½ (1 -0) = ½ He 2 Þ ½ (2 -2) = 0

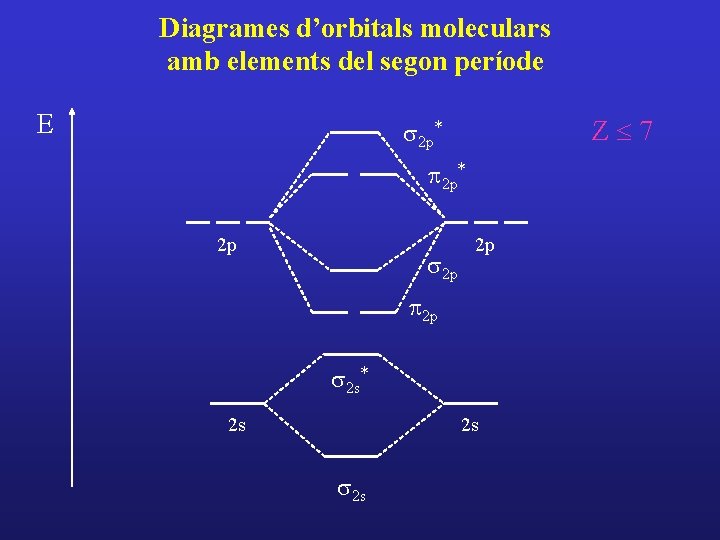
Diagrames d’orbitals moleculars amb elements del segon període Combinacions d’orbitals atòmics 2 p

Diagrames d’orbitals moleculars amb elements del segon període E Z£ 7 s 2 p* p 2 p* 2 p s 2 p 2 p s 2 s* 2 s 2 s

Diagrames d’orbitals moleculars amb elements del segon període E Z>7 s 2 p* Paramagnètica p 2 p* 2 p p 2 p 2 p s 2 p p. ej. : O 2 s 2 s* 2 s 2 s o. enllaç : 2

Electrons deslocalitzats L’enllaç en el benzè: Teoria de Lewis

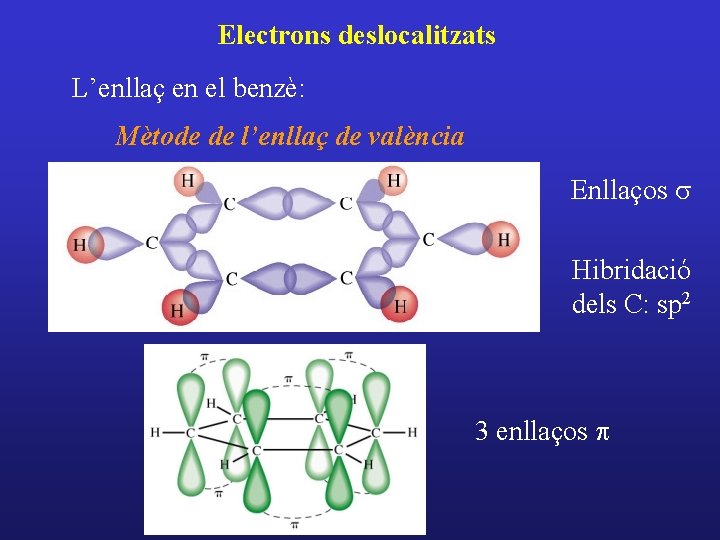
Electrons deslocalitzats L’enllaç en el benzè: Mètode de l’enllaç de valència Enllaços s Hibridació dels C: sp 2 3 enllaços p

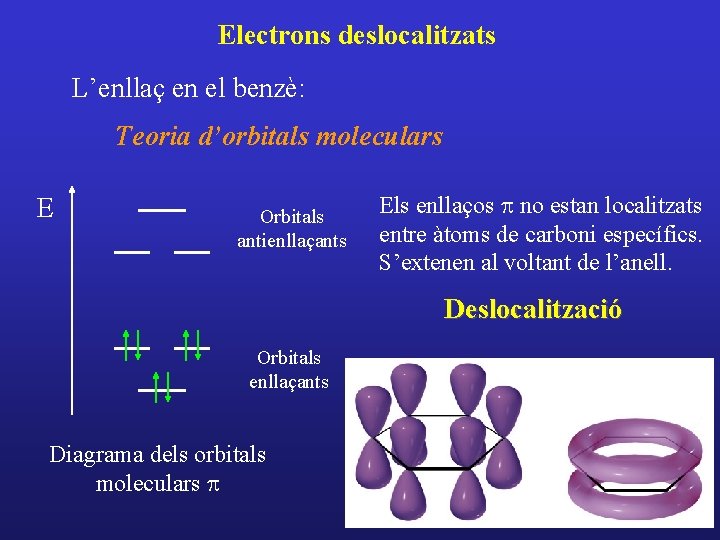
Electrons deslocalitzats L’enllaç en el benzè: Teoria d’orbitals moleculars E Orbitals antienllaçants Els enllaços p no estan localitzats entre àtoms de carboni específics. S’extenen al voltant de l’anell. Deslocalització Orbitals enllaçants Diagrama dels orbitals moleculars p

10 L’ENLLAÇ DELS METALLS. Propietats típiques dels metalls: - Condueixen l’electricitat - Facilitat de deformació (làmines, fils. . . ) Com explicar-les? Model mar d’electrons Metall sòlid: xarxa d’ions positius immersa en un mar d’electrons essencialment lliures o itinerants. Explica la conductivitat i la facilitat de deformació.

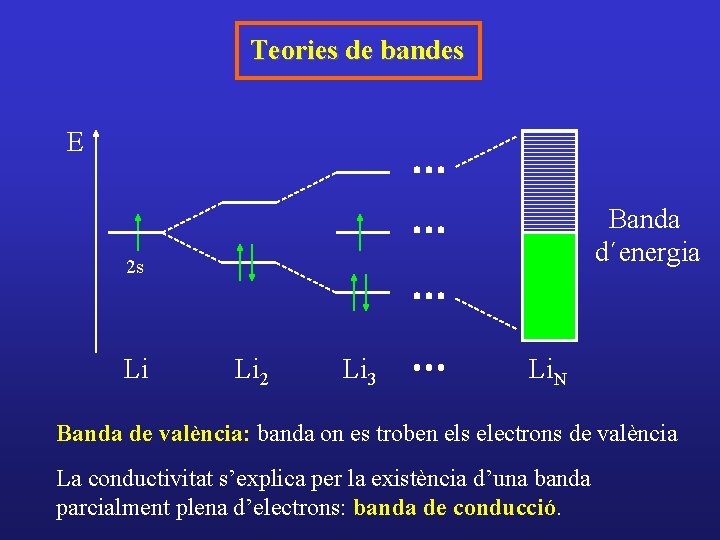
Teories de bandes E Banda d´energia 2 s Li Li 2 Li 3 Li. N Banda de valència: banda on es troben els electrons de valència La conductivitat s’explica per la existència d’una banda parcialment plena d’electrons: banda de conducció.

Metall (Li) Metall (Be) Semiconductor (Si, intrínsec) Aïllant (diamant) Semiconductor extrínsec: La conductivitat es controla mitjançant l’addició d’impureses (dopatge). Semiconductor tipus-n Semiconductor tipus-p (Si®P) (Si®Ga)