PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las protenas son















- Slides: 34

PROTEINAS AMINOACIDOS 1

2

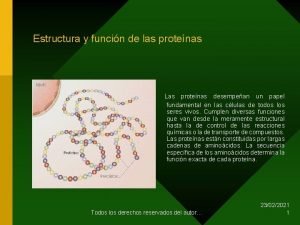
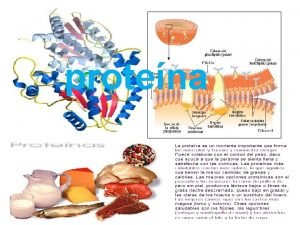
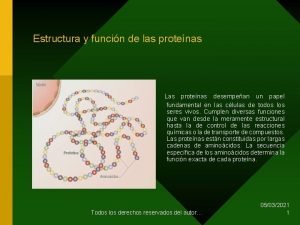
PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones que desempeñan: Enzimas Hormonas Transporte de sustancias en la sangre: hemoglobina, albumina, LDL y HDL Anticuerpos Receptores de la célula Contracción muscular: actina, miosina y dineina Tejido conectivo y aponeurosis: colágeno, etc. 3

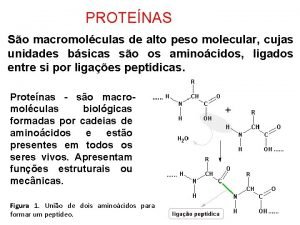
Son biopolímeros naturales, heteropoliamidas, constituidos por α-L-aminoácidos unidos entre sí, mediante uniones peptídicas y con ordenamiento genético, que adoptan diferentes disposiciones espaciales que llamamos estructuras. Las proteínas son macromoléculas de elevado peso molecular, razón por la cual, puestas en agua forman soluciones coloidales. Su elevado PM oscila desde 5700 (insulina) a varios millones (virus del mosaico del tabaco). 4

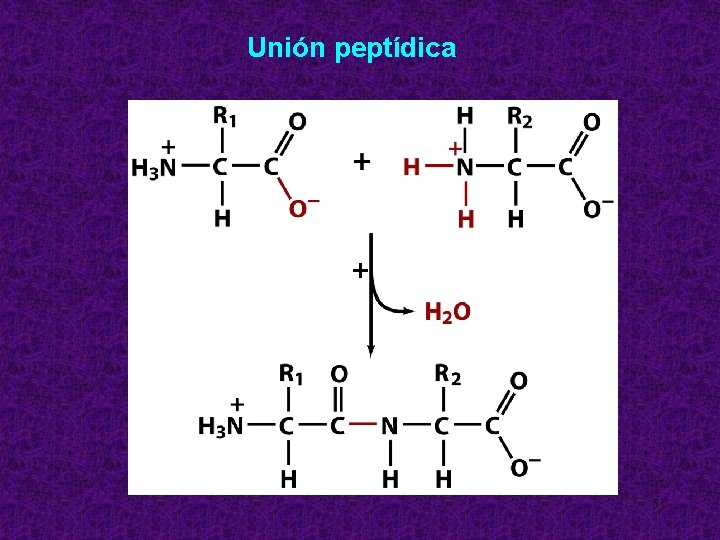
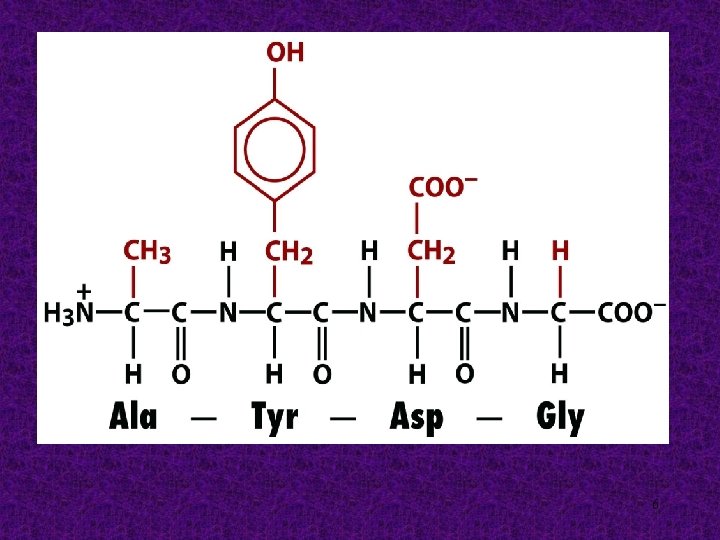
Unión peptídica + 5

AMINOACIDOS: PROPIEDADES GENERALES REACCIONES QUIMICAS 6

AMINOÁCIDOS Son un grupo heterogéneo de moléculas que poseen características funcionales y estructurales comunes. Existen 20 Aa diferentes especificados en el código genético. En las células estos 20 Aa se unen mediante enlaces covalentes formando largas cadenas de combinaciones específicas que producen un gran numero de proteínas diferentes. Se caracterizan por poseer al menos un grupo carboxilo (ácido) y un grupo amino (básico). Además de ser unidades estructurales de proteínas, algunos son intermediarios de rutas metabólicas (citrulina, ornitina en el ciclo de la urea), precursores de sustancias biológicas que contienen nitrógeno (hemo, nucleósidos, coenzimas, hormonas, neurotransmisores) 7

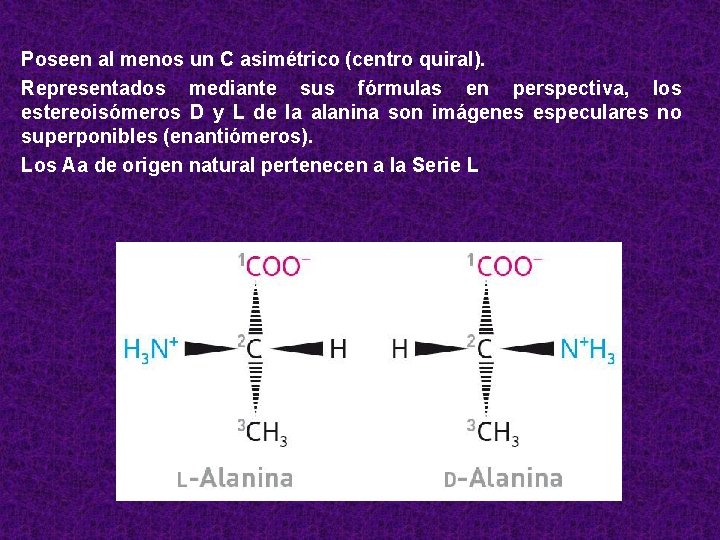
Poseen al menos un C asimétrico (centro quiral). Representados mediante sus fórmulas en perspectiva, los estereoisómeros D y L de la alanina son imágenes especulares no superponibles (enantiómeros). Los Aa de origen natural pertenecen a la Serie L

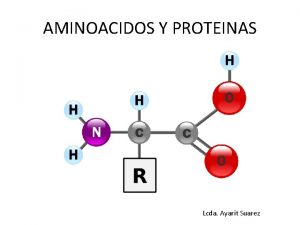
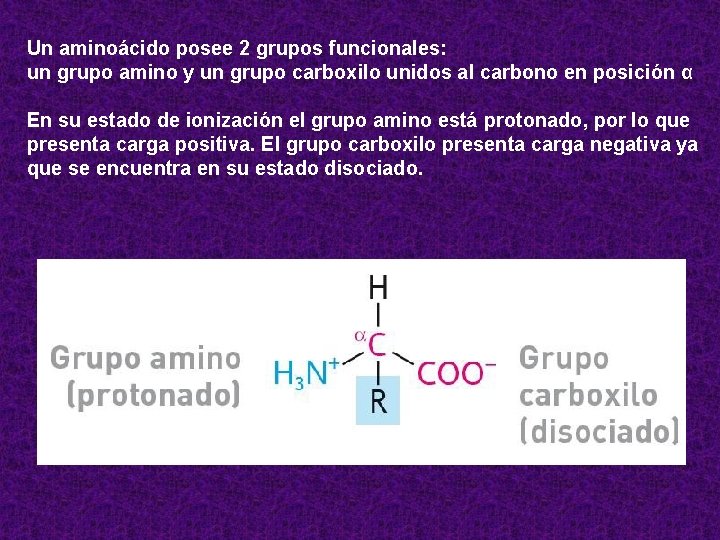
Un aminoácido posee 2 grupos funcionales: un grupo amino y un grupo carboxilo unidos al carbono en posición α En su estado de ionización el grupo amino está protonado, por lo que presenta carga positiva. El grupo carboxilo presenta carga negativa ya que se encuentra en su estado disociado.

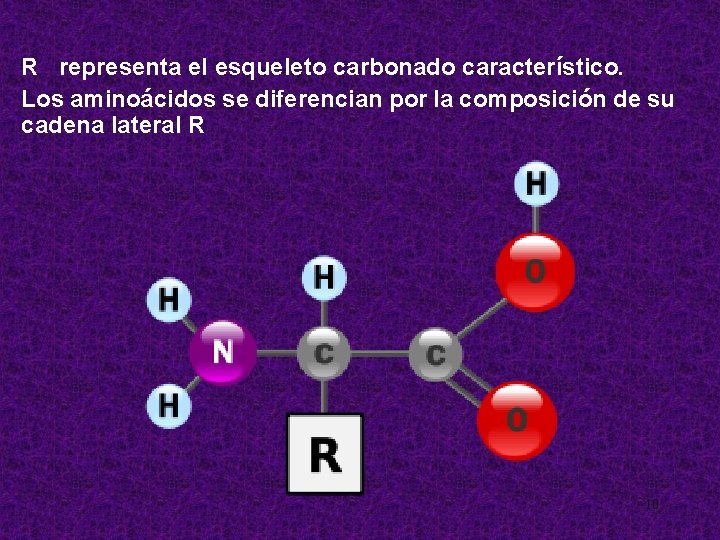
R representa el esqueleto carbonado característico. Los aminoácidos se diferencian por la composición de su cadena lateral R 10

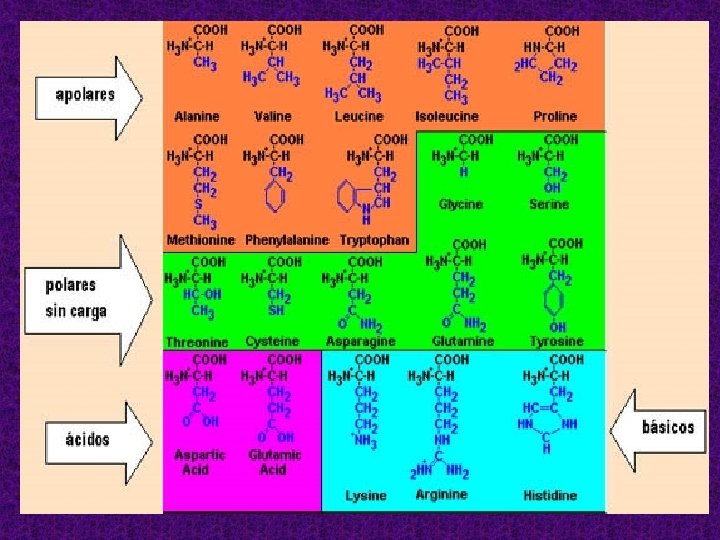
Clasificación de los aminoácidos según la naturaleza de su cadena lateral. Los distintos aminoácidos se representan en el estado de ionización que domina a p. H 7. Se han destacado las cadenas laterales mediante un sombreado y los carbonos asimétricos aparecen en rojo. Debajo de cada aminoácido figuran: su nombre completo, el código de tres letras y el código de una letra. Se clasifica la Cys como aminoácido apolar debido a su débil capacidad de formar puentes de hidrógeno.




En base a la polaridad de sus grupos R: • Apolares • Polares sin carga • Polares Con grupo R cargado negativamente (ácidos) • Polares Con grupo R cargado positivamente (básicos) 15

16

Con grupo R apolar Alanina Valina Leucina Isoleucina Prolina Fenilalanina Triptofano Metionina Con grupo R polar sin carga: Glicina Serina Treonina Tirosina Glutamina Asparragina Cisteína 17

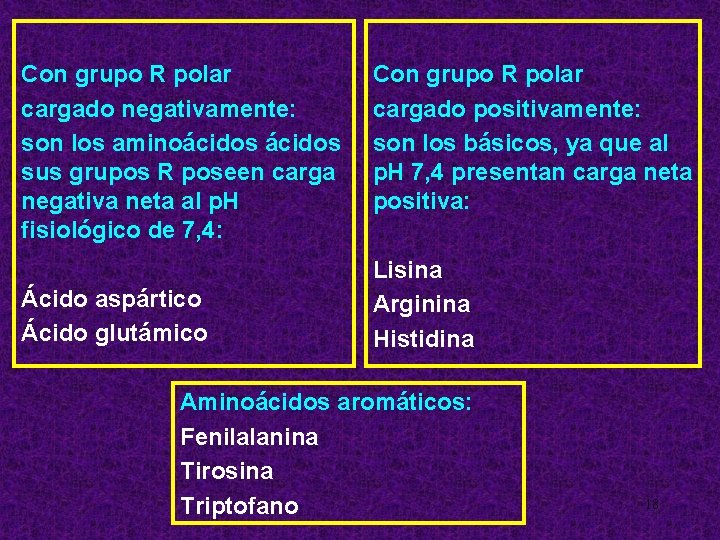
Con grupo R polar cargado negativamente: son los aminoácidos sus grupos R poseen carga negativa neta al p. H fisiológico de 7, 4: Ácido aspártico Ácido glutámico Con grupo R polar cargado positivamente: son los básicos, ya que al p. H 7, 4 presentan carga neta positiva: Lisina Arginina Histidina Aminoácidos aromáticos: Fenilalanina Tirosina Triptofano 18

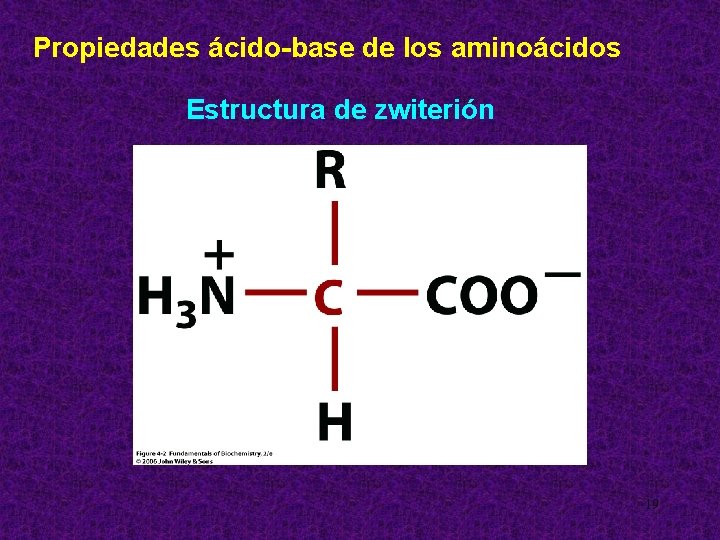
Propiedades ácido-base de los aminoácidos Estructura de zwiterión 19

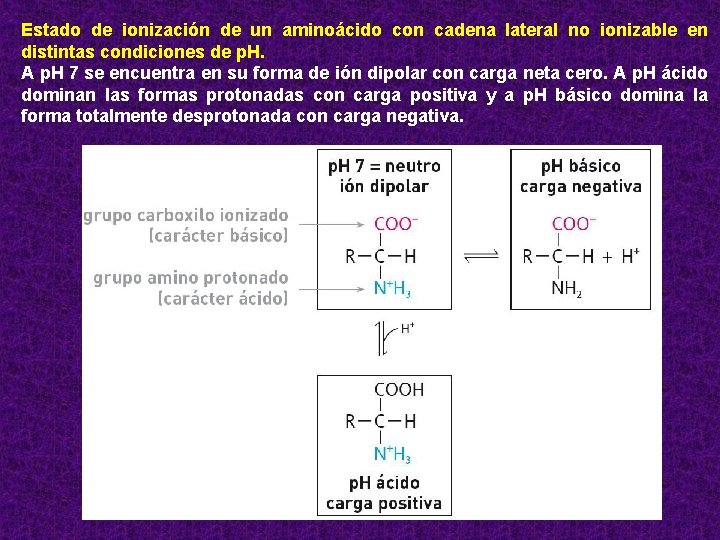
Estado de ionización de un aminoácido con cadena lateral no ionizable en distintas condiciones de p. H. A p. H 7 se encuentra en su forma de ión dipolar con carga neta cero. A p. H ácido dominan las formas protonadas con carga positiva y a p. H básico domina la forma totalmente desprotonada con carga negativa.

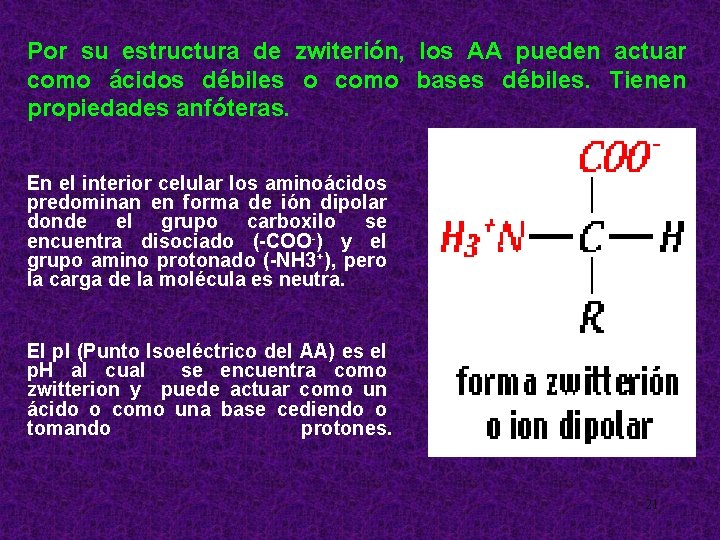
Por su estructura de zwiterión, los AA pueden actuar como ácidos débiles o como bases débiles. Tienen propiedades anfóteras. En el interior celular los aminoácidos predominan en forma de ión dipolar donde el grupo carboxilo se encuentra disociado (-COO-) y el grupo amino protonado (-NH 3+), pero la carga de la molécula es neutra. EI p. I (Punto Isoeléctrico del AA) es el p. H al cual se encuentra como zwitterion y puede actuar como un ácido o como una base cediendo o tomando protones. 21

22

Forma catiónica Forma dipolar Forma aniónica PUNTO ISOELECTRICO p. I de un aminoácido: aquel valor de p. H para el cual las cargas positivas (forma catiónica) son igual a las cargas negativas (forma aniónica) y su carga neta es nula. No se desplazaría al aplicar corriente. 23

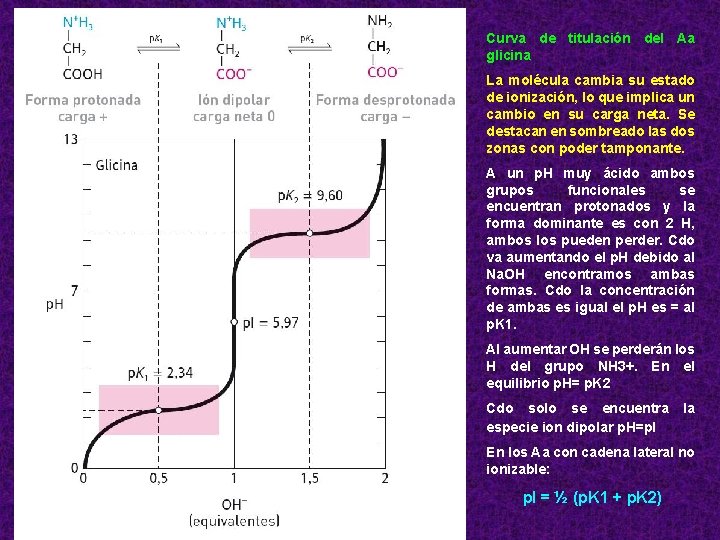
Curva de titulación del Aa glicina La molécula cambia su estado de ionización, lo que implica un cambio en su carga neta. Se destacan en sombreado las dos zonas con poder tamponante. A un p. H muy ácido ambos grupos funcionales se encuentran protonados y la forma dominante es con 2 H, ambos los pueden perder. Cdo va aumentando el p. H debido al Na. OH encontramos ambas formas. Cdo la concentración de ambas es igual el p. H es = al p. K 1. Al aumentar OH se perderán los H del grupo NH 3+. En el equilibrio p. H= p. K 2 Cdo solo se encuentra especie ion dipolar p. H=p. I la En los Aa con cadena lateral no ionizable: p. I = ½ (p. K 1 + p. K 2)

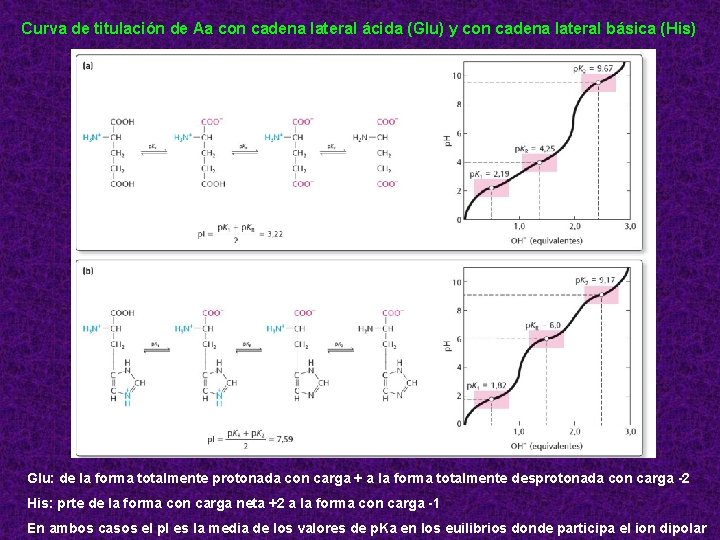
Curva de titulación de Aa con cadena lateral ácida (Glu) y con cadena lateral básica (His) Glu: de la forma totalmente protonada con carga + a la forma totalmente desprotonada con carga -2 His: prte de la forma con carga neta +2 a la forma con carga -1 En ambos casos el p. I es la media de los valores de p. Ka en los euilibrios donde participa el ion dipolar


Reacciones químicas de los aminoácidos Propiedades del grupo carboxilo • formación de ésteres • formación de amidas • formación de aminas por descarboxilación Propiedades del grupo amino • Desaminación no oxidativa: formación hidroxiácido • desaminación oxidativa: formación cetoácido • Reacción de Sanger (DNFB) • Reacción de Edman (PITC) • Reacción de Ninhidrina 27

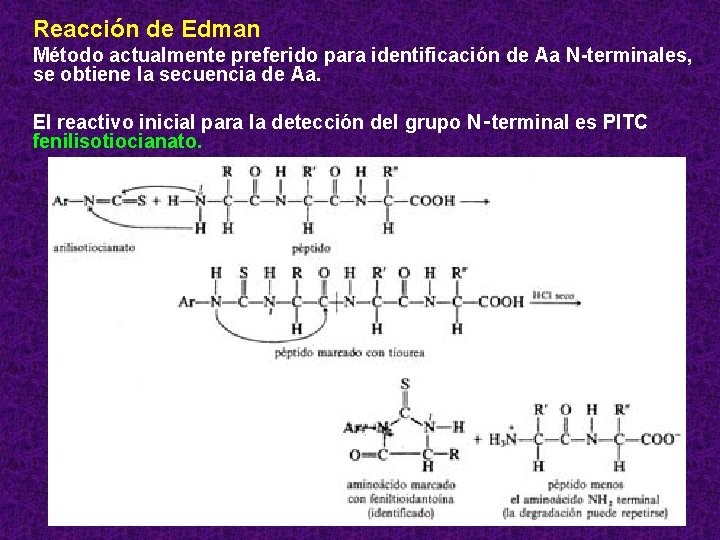
Reacción de Edman Método actualmente preferido para identificación de Aa N-terminales, se obtiene la secuencia de Aa. El reactivo inicial para la detección del grupo N‑terminal es PITC fenilisotiocianato. 28

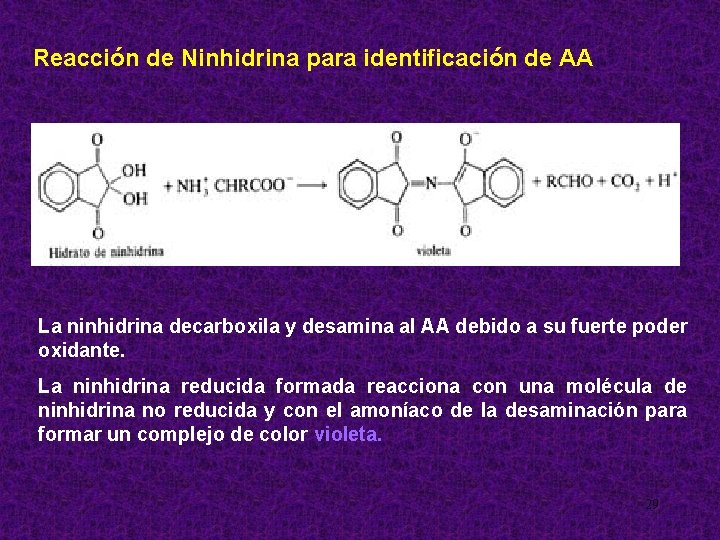
Reacción de Ninhidrina para identificación de AA La ninhidrina decarboxila y desamina al AA debido a su fuerte poder oxidante. La ninhidrina reducida formada reacciona con una molécula de ninhidrina no reducida y con el amoníaco de la desaminación para formar un complejo de color violeta. 29

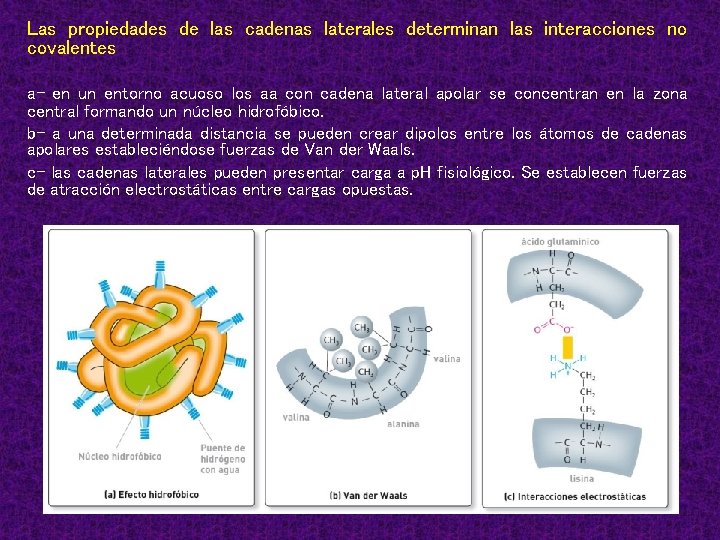
Las propiedades de las cadenas laterales determinan las interacciones no covalentes a- en un entorno acuoso los aa con cadena lateral apolar se concentran en la zona central formando un núcleo hidrofóbico. b- a una determinada distancia se pueden crear dipolos entre los átomos de cadenas apolares estableciéndose fuerzas de Van der Waals. c- las cadenas laterales pueden presentar carga a p. H fisiológico. Se establecen fuerzas de atracción electrostáticas entre cargas opuestas.

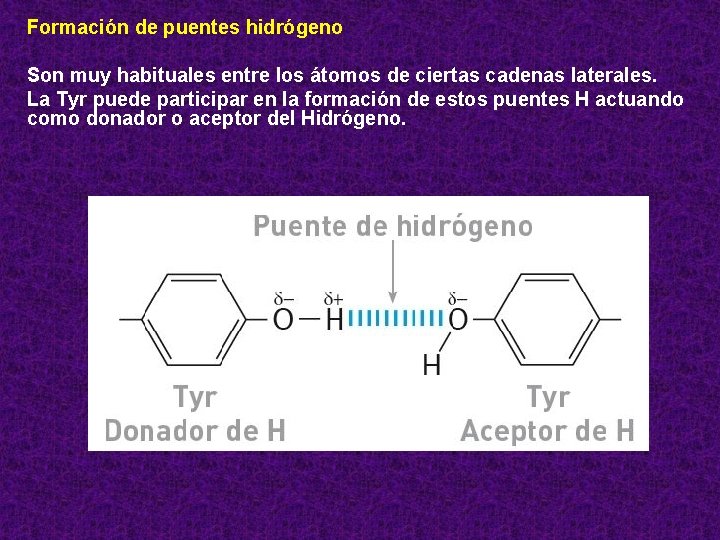
Formación de puentes hidrógeno Son muy habituales entre los átomos de ciertas cadenas laterales. La Tyr puede participar en la formación de estos puentes H actuando como donador o aceptor del Hidrógeno.

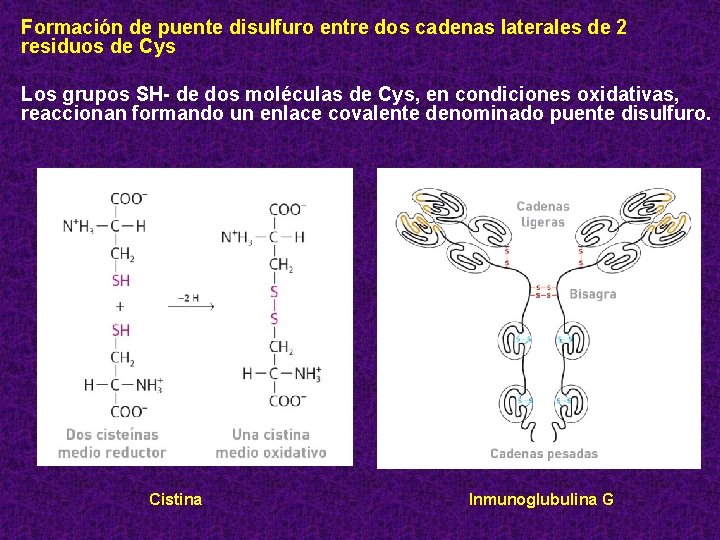
Formación de puente disulfuro entre dos cadenas laterales de 2 residuos de Cys Los grupos SH- de dos moléculas de Cys, en condiciones oxidativas, reaccionan formando un enlace covalente denominado puente disulfuro. Cistina Inmunoglubulina G

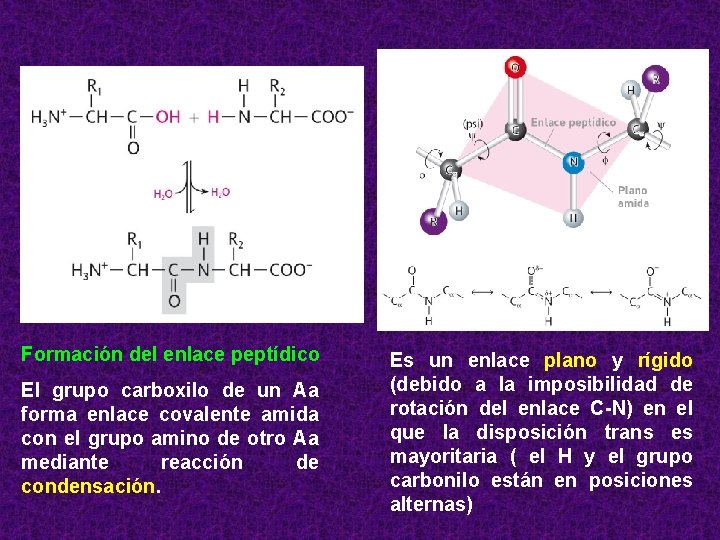
Formación del enlace peptídico El grupo carboxilo de un Aa forma enlace covalente amida con el grupo amino de otro Aa mediante reacción de condensación. Es un enlace plano y rígido (debido a la imposibilidad de rotación del enlace C-N) en el que la disposición trans es mayoritaria ( el H y el grupo carbonilo están en posiciones alternas)

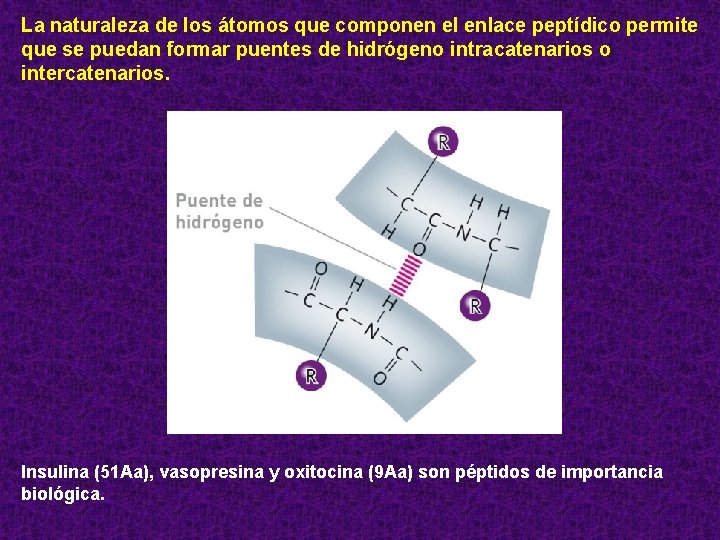
La naturaleza de los átomos que componen el enlace peptídico permite que se puedan formar puentes de hidrógeno intracatenarios o intercatenarios. Insulina (51 Aa), vasopresina y oxitocina (9 Aa) son péptidos de importancia biológica.
 La clasificación de las proteínas
La clasificación de las proteínas Que son las proteinas
Que son las proteinas Protenas
Protenas Proteinas monomericas
Proteinas monomericas Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Heteroproteinas definicion
Heteroproteinas definicion Protenas
Protenas Protenas
Protenas Proteinas primarias secundarias terciarias y cuaternarias
Proteinas primarias secundarias terciarias y cuaternarias Protenas
Protenas Fosfoglicoproteina
Fosfoglicoproteina Plamatico
Plamatico Función de las proteínas estructurales
Función de las proteínas estructurales Ventajas y desventajas de las proteinas
Ventajas y desventajas de las proteinas Estructuras de las proteinas primarias
Estructuras de las proteinas primarias Funcion de las proteinas
Funcion de las proteinas Catalasa
Catalasa Solubilidad en proteinas
Solubilidad en proteinas Proteinas de defensa
Proteinas de defensa Clasificación de las proteínas
Clasificación de las proteínas Generalidades de las proteinas
Generalidades de las proteinas Ventajas y desventajas de las proteinas
Ventajas y desventajas de las proteinas Generalidades de las proteinas
Generalidades de las proteinas Taquifilaxia
Taquifilaxia Aminoacidos
Aminoacidos Funcion catalizadora de las proteinas
Funcion catalizadora de las proteinas Las proteinas y sus funciones
Las proteinas y sus funciones Catabolismo de los aminoácidos
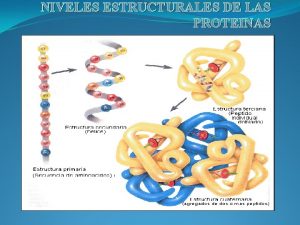
Catabolismo de los aminoácidos Niveles de estructura de las proteinas
Niveles de estructura de las proteinas Estructura primaria
Estructura primaria Proteínas simples ejemplos
Proteínas simples ejemplos