Universidad Central de Venezuela Facultad de Medicina Escuela




















- Slides: 75

Universidad Central de Venezuela Facultad de Medicina Escuela de Medicina José María Vargas Cátedra de Bioquímica Estructura y Propiedades de Aminoácidos y Proteínas Br. Fabián Rodríguez Caracas, Julio 2011

1. Aminoácidos 2. Péptidos 3. Proteínas 4. • • • Estructura de un aminoácido Clasificación de los aminoácidos Aminoácidos modificados Estereoquímica de los aminoácidos Zwitterion Curvas de titulación de aminoácidos • • Enlace peptídico Estructura del enlace peptídico • • Propiedades de las proteínas Clasificación de las proteínas Estructura Primaria Estructura Secundaria • Estructura terciaria • • Estructura Cuaternaria Proteínas de Importancia Fisiológica • • α-Hélice. Conformación β Giros β Estructuras Suprasecuendarias • • • Dominios Reglas de Plegado Termodinámica del Plegado Factores que afectan el plegado Chaperonas moleculares • • • Queratinas Colágeno Proteínas plasmáticas Contenido Métodos de estudio de las Proteínas

AMINOÁCIDOS

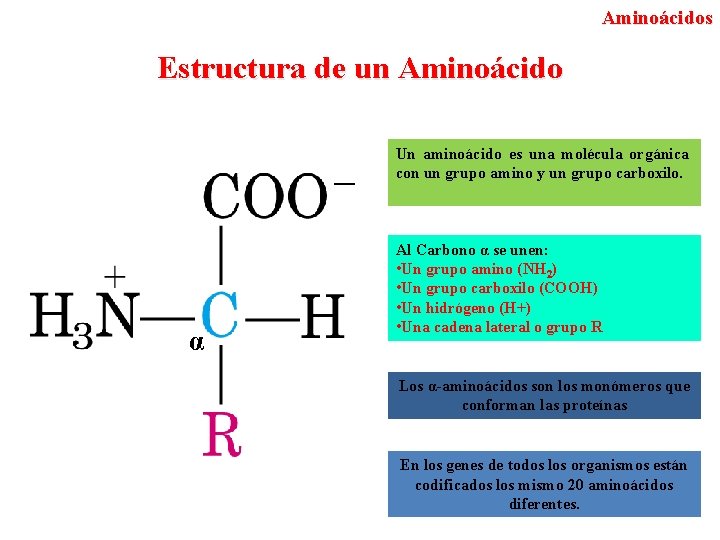
Aminoácidos Estructura de un Aminoácido Un aminoácido es una molécula orgánica con un grupo amino y un grupo carboxilo. α Al Carbono α se unen: • Un grupo amino (NH 2) • Un grupo carboxilo (COOH) • Un hidrógeno (H+) • Una cadena lateral o grupo R Los α-aminoácidos son los monómeros que conforman las proteínas En los genes de todos los organismos están codificados los mismo 20 aminoácidos diferentes.

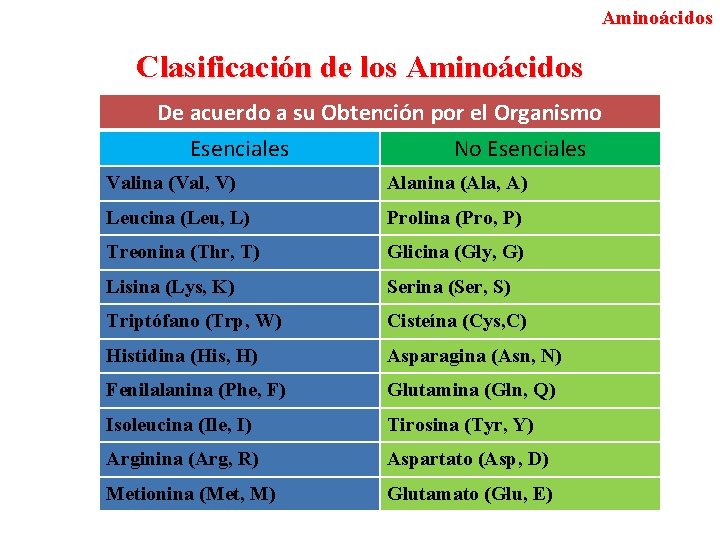
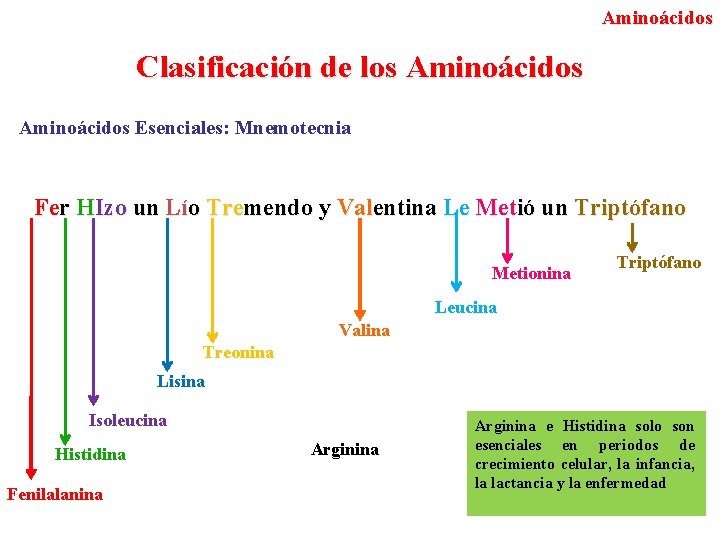
Aminoácidos Clasificación de los Aminoácidos De acuerdo a su Obtención por el Organismo Esenciales No Esenciales Valina (Val, V) Alanina (Ala, A) Leucina (Leu, L) Prolina (Pro, P) Treonina (Thr, T) Glicina (Gly, G) Lisina (Lys, K) Serina (Ser, S) Triptófano (Trp, W) Cisteína (Cys, C) Histidina (His, H) Asparagina (Asn, N) Fenilalanina (Phe, F) Glutamina (Gln, Q) Isoleucina (Ile, I) Tirosina (Tyr, Y) Arginina (Arg, R) Aspartato (Asp, D) Metionina (Met, M) Glutamato (Glu, E)

Aminoácidos Clasificación de los Aminoácidos Esenciales: Mnemotecnia Fer HIzo un Lío Tremendo y Valentina Le Metió un Triptófano Metionina Triptófano Leucina Valina Treonina Lisina Isoleucina Histidina Fenilalanina Arginina e Histidina solo son esenciales en periodos de crecimiento celular, la infancia, la lactancia y la enfermedad

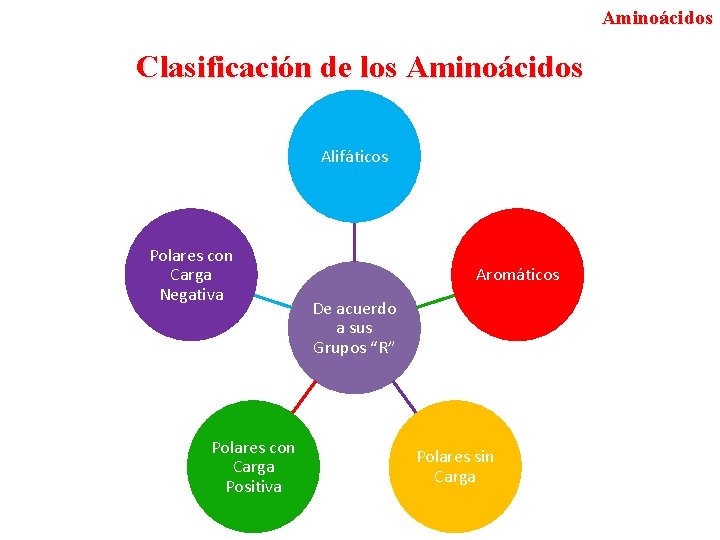
Aminoácidos Clasificación de los Aminoácidos Alifáticos Polares con Carga Negativa Polares con Carga Positiva Aromáticos De acuerdo a sus Grupos “R” Polares sin Carga

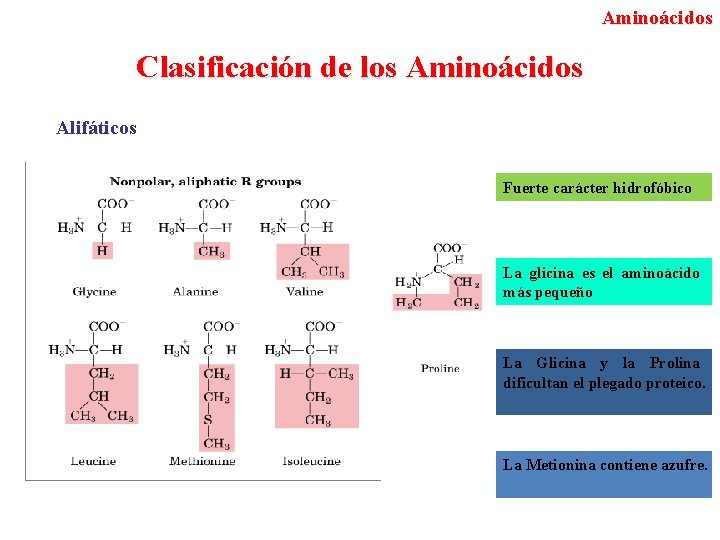
Aminoácidos Clasificación de los Aminoácidos Alifáticos Fuerte carácter hidrofóbico La glicina es el aminoácido más pequeño La Glicina y la Prolina dificultan el plegado proteico. La Metionina contiene azufre.

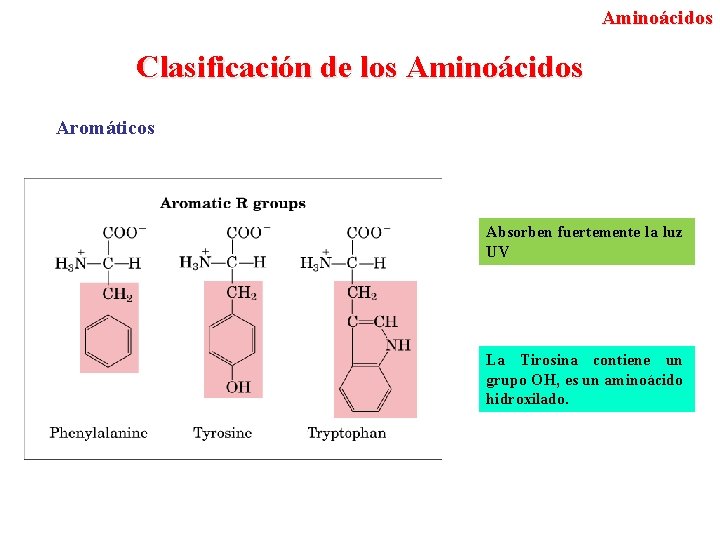
Aminoácidos Clasificación de los Aminoácidos Aromáticos Absorben fuertemente la luz UV La Tirosina contiene un grupo OH, es un aminoácido hidroxilado.

Aminoácidos Clasificación de los Aminoácidos Polares sin carga La Serina y la Treonina aminoácidos hidroxilados son La Asparagina y la Glutamina son las amidas del Aspartato y el Glutamato. La Cisteína contiene azufre. Dos Cisteínas pueden oxidarse y formar un enlace disulfuro o el “nuevo” aminoácido Cistina.

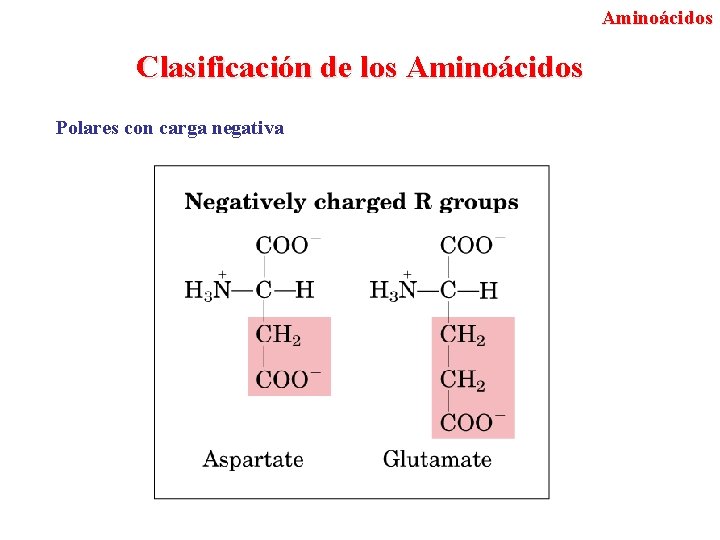
Aminoácidos Clasificación de los Aminoácidos Polares con carga positiva La cadena lateral de la Histidina puede estar protonada (carga positiva) o desprotonarse (carga 0) a p. H fisiológico, por lo que puede participar en la catálisis enzimática

Aminoácidos Clasificación de los Aminoácidos Polares con carga negativa

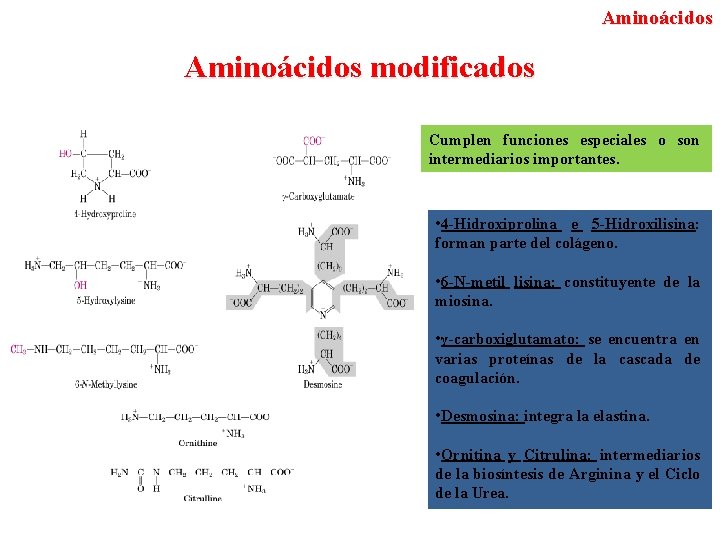
Aminoácidos modificados Cumplen funciones especiales o son intermediarios importantes. • 4 -Hidroxiprolina e 5 -Hidroxilisina: forman parte del colágeno. • 6 -N-metil lisina: constituyente de la miosina. • γ-carboxiglutamato: se encuentra en varias proteínas de la cascada de coagulación. • Desmosina: integra la elastina. • Ornitina y Citrulina: intermediarios de la biosíntesis de Arginina y el Ciclo de la Urea.

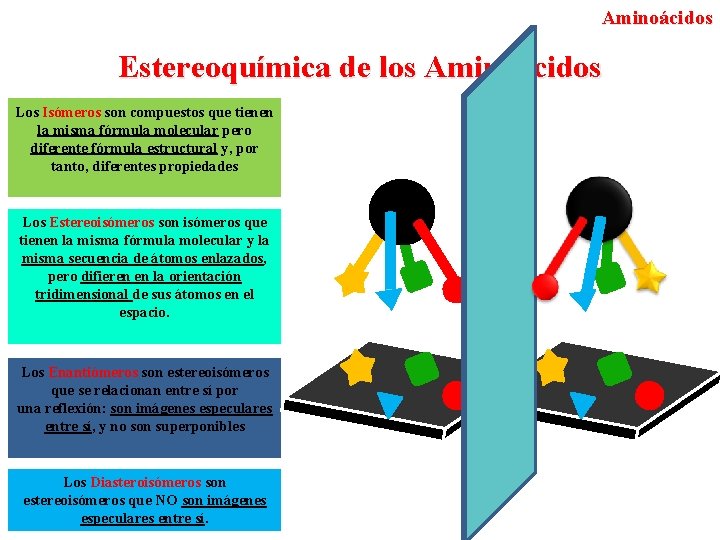
Aminoácidos Estereoquímica de los Aminoácidos Los Isómeros son compuestos que tienen la misma fórmula molecular pero diferente fórmula estructural y, por tanto, diferentes propiedades Los Estereoisómeros son isómeros que tienen la misma fórmula molecular y la misma secuencia de átomos enlazados, pero difieren en la orientación tridimensional de sus átomos en el espacio. Los Enantiómeros son estereoisómeros que se relacionan entre sí por una reflexión: son imágenes especulares entre sí, y no son superponibles Los Diasteroisómeros son estereoisómeros que NO son imágenes especulares entre sí.

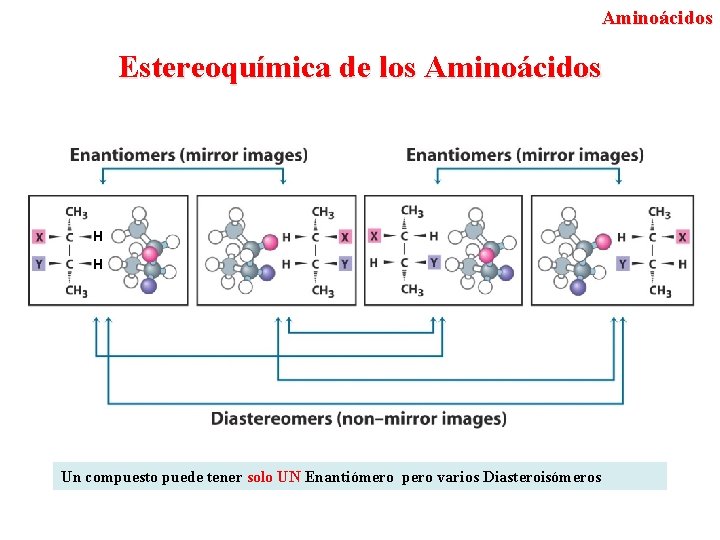
Aminoácidos Estereoquímica de los Aminoácidos H H Un compuesto puede tener solo UN Enantiómero pero varios Diasteroisómeros

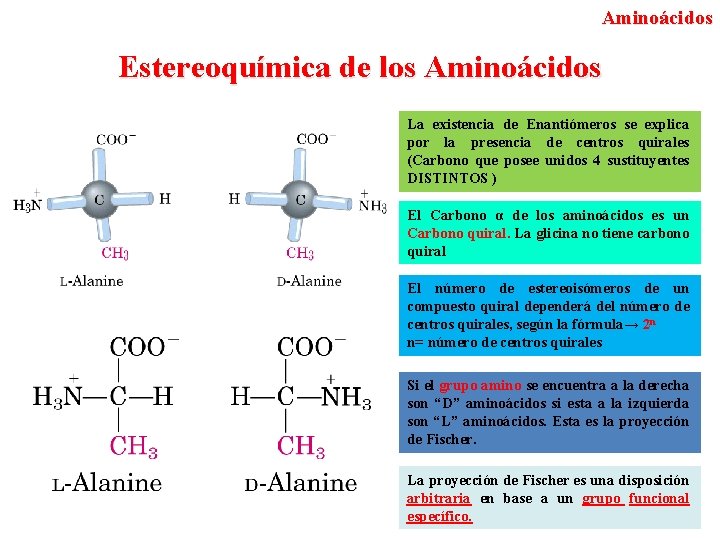
Aminoácidos Estereoquímica de los Aminoácidos La existencia de Enantiómeros se explica por la presencia de centros quirales (Carbono que posee unidos 4 sustituyentes DISTINTOS ) El Carbono α de los aminoácidos es un Carbono quiral. La glicina no tiene carbono quiral El número de estereoisómeros de un compuesto quiral dependerá del número de centros quirales, según la fórmula→ 2 n n= número de centros quirales Si el grupo amino se encuentra a la derecha son “D” aminoácidos si esta a la izquierda son “L” aminoácidos. Esta es la proyección de Fischer. La proyección de Fischer es una disposición arbitraria en base a un grupo funcional específico.

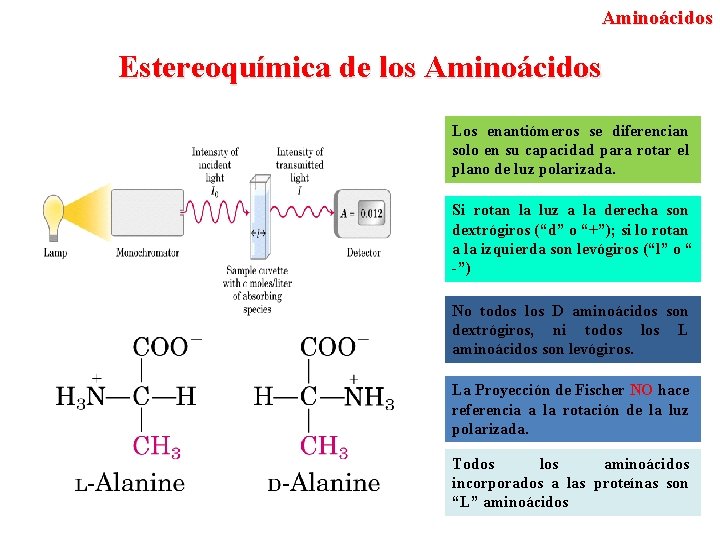
Aminoácidos Estereoquímica de los Aminoácidos Los enantiómeros se diferencian solo en su capacidad para rotar el plano de luz polarizada. Si rotan la luz a la derecha son dextrógiros (“d” o “+”); si lo rotan a la izquierda son levógiros (“l” o “ -”) No todos los D aminoácidos son dextrógiros, ni todos los L aminoácidos son levógiros. La Proyección de Fischer NO hace referencia a la rotación de la luz polarizada. Todos los aminoácidos incorporados a las proteínas son “L” aminoácidos

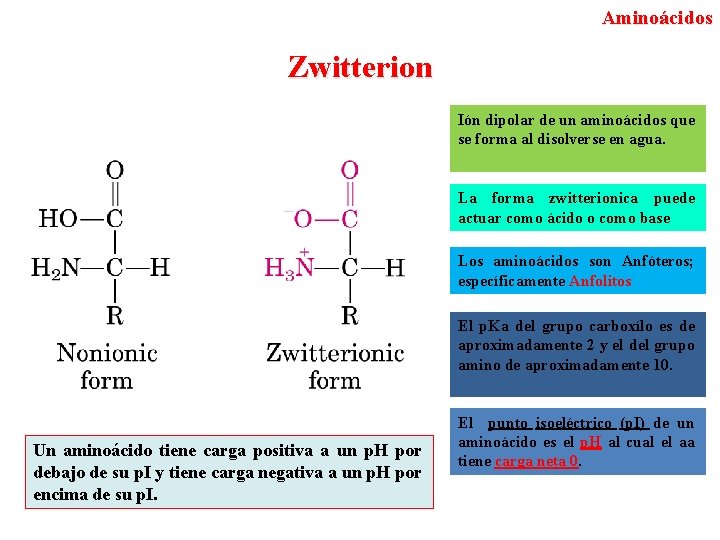
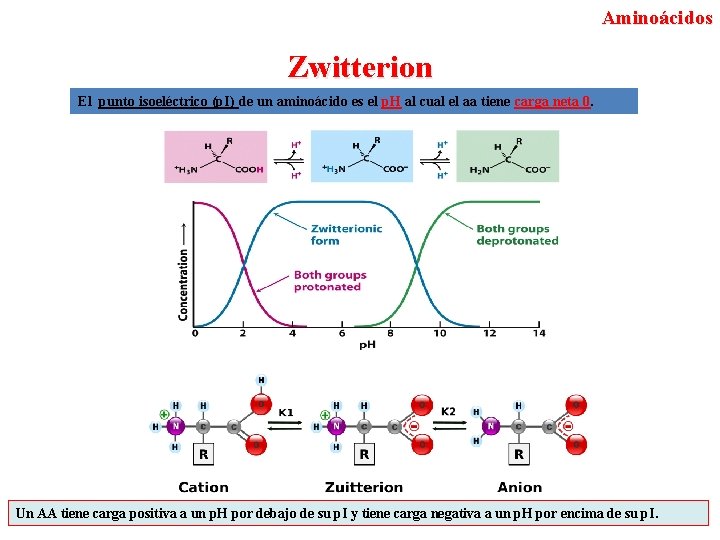
Aminoácidos Zwitterion Ión dipolar de un aminoácidos que se forma al disolverse en agua. La forma zwitterionica puede actuar como ácido o como base Los aminoácidos son Anfóteros; específicamente Anfolitos El p. Ka del grupo carboxílo es de aproximadamente 2 y el del grupo amino de aproximadamente 10. Un aminoácido tiene carga positiva a un p. H por debajo de su p. I y tiene carga negativa a un p. H por encima de su p. I. El punto isoeléctrico (p. I) de un aminoácido es el p. H al cual el aa tiene carga neta 0.

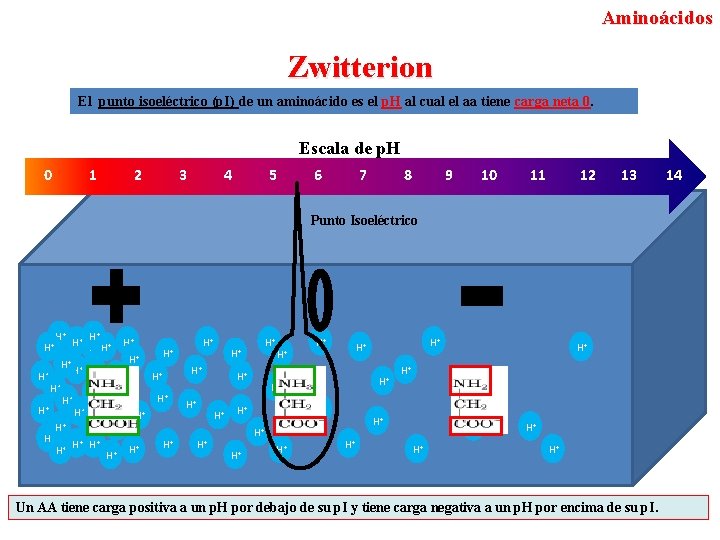
Aminoácidos Zwitterion El punto isoeléctrico (p. I) de un aminoácido es el p. H al cual el aa tiene carga neta 0. Escala de p. H 0 1 2 3 4 5 6 7 8 9 10 11 12 13 Punto Isoeléctrico H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ Un AA tiene carga positiva a un p. H por debajo de su p. I y tiene carga negativa a un p. H por encima de su p. I. 14

Aminoácidos Zwitterion El punto isoeléctrico (p. I) de un aminoácido es el p. H al cual el aa tiene carga neta 0. Un AA tiene carga positiva a un p. H por debajo de su p. I y tiene carga negativa a un p. H por encima de su p. I.

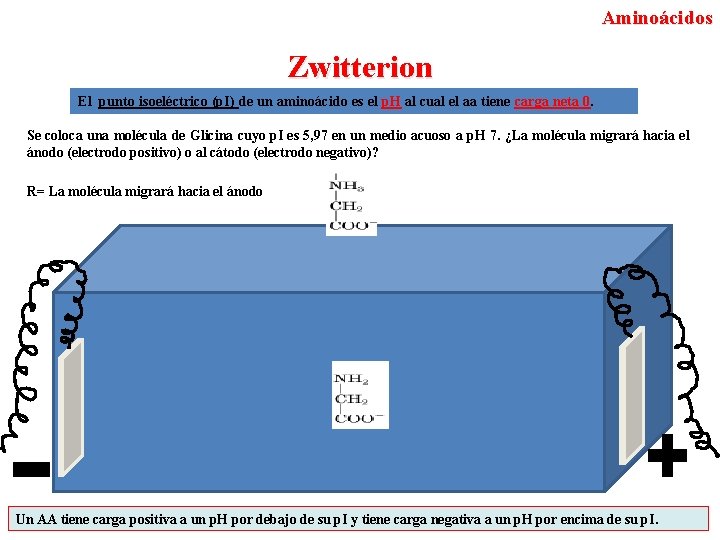
Aminoácidos Zwitterion El punto isoeléctrico (p. I) de un aminoácido es el p. H al cual el aa tiene carga neta 0. Se coloca una molécula de Glicina cuyo p. I es 5, 97 en un medio acuoso a p. H 7. ¿La molécula migrará hacia el ánodo (electrodo positivo) o al cátodo (electrodo negativo)? R= La molécula migrará hacia el ánodo Un AA tiene carga positiva a un p. H por debajo de su p. I y tiene carga negativa a un p. H por encima de su p. I.

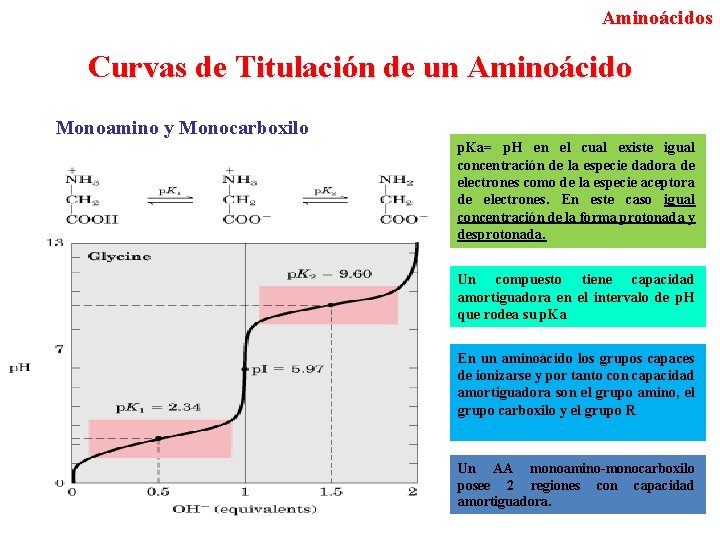
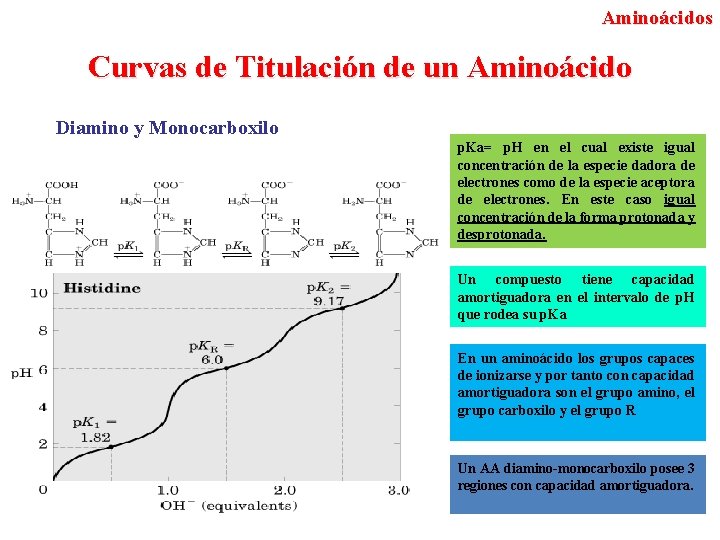
Aminoácidos Curvas de Titulación de un Aminoácido Monoamino y Monocarboxilo p. Ka= p. H en el cual existe igual concentración de la especie dadora de electrones como de la especie aceptora de electrones. En este caso igual concentración de la forma protonada y desprotonada. Un compuesto tiene capacidad amortiguadora en el intervalo de p. H que rodea su p. Ka En un aminoácido los grupos capaces de ionizarse y por tanto con capacidad amortiguadora son el grupo amino, el grupo carboxilo y el grupo R Un AA monoamino-monocarboxilo posee 2 regiones con capacidad amortiguadora.

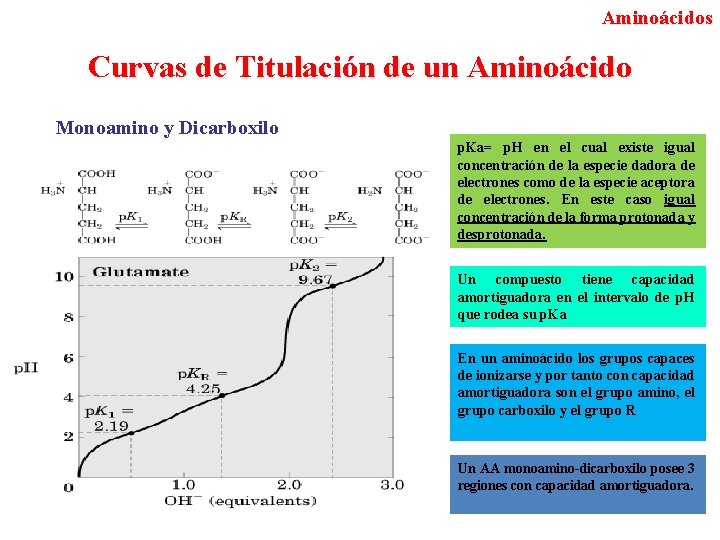
Aminoácidos Curvas de Titulación de un Aminoácido Monoamino y Dicarboxilo p. Ka= p. H en el cual existe igual concentración de la especie dadora de electrones como de la especie aceptora de electrones. En este caso igual concentración de la forma protonada y desprotonada. Un compuesto tiene capacidad amortiguadora en el intervalo de p. H que rodea su p. Ka En un aminoácido los grupos capaces de ionizarse y por tanto con capacidad amortiguadora son el grupo amino, el grupo carboxilo y el grupo R Un AA monoamino-dicarboxilo posee 3 regiones con capacidad amortiguadora.

Aminoácidos Curvas de Titulación de un Aminoácido Diamino y Monocarboxilo p. Ka= p. H en el cual existe igual concentración de la especie dadora de electrones como de la especie aceptora de electrones. En este caso igual concentración de la forma protonada y desprotonada. Un compuesto tiene capacidad amortiguadora en el intervalo de p. H que rodea su p. Ka En un aminoácido los grupos capaces de ionizarse y por tanto con capacidad amortiguadora son el grupo amino, el grupo carboxilo y el grupo R Un AA diamino-monocarboxilo posee 3 regiones con capacidad amortiguadora.

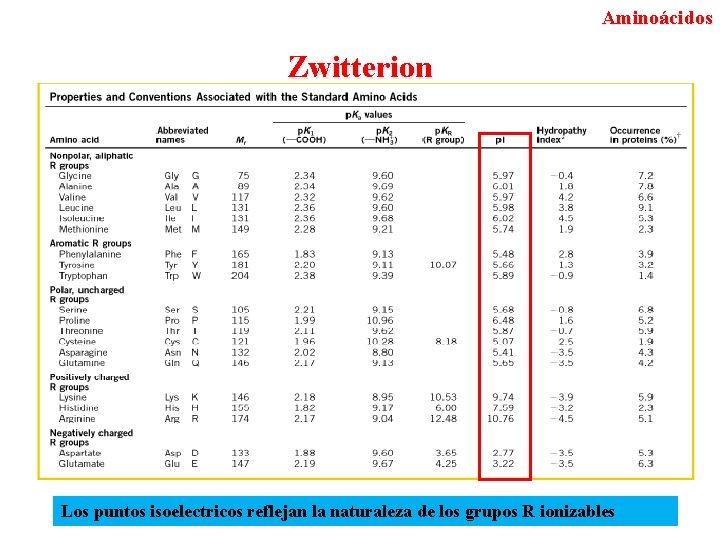
Aminoácidos Zwitterion Los puntos isoelectricos reflejan la naturaleza de los grupos R ionizables

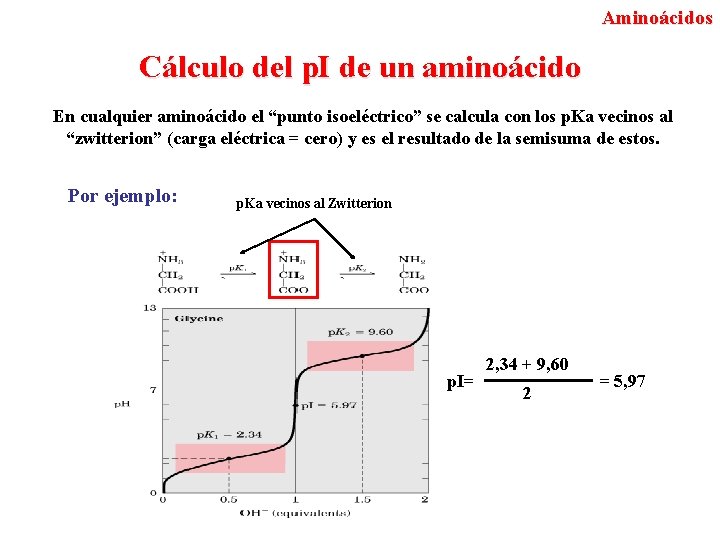
Aminoácidos Cálculo del p. I de un aminoácido En cualquier aminoácido el “punto isoeléctrico” se calcula con los p. Ka vecinos al “zwitterion” (carga eléctrica = cero) y es el resultado de la semisuma de estos. Por ejemplo: p. Ka vecinos al Zwitterion p. I= 2, 34 + 9, 60 2 = 5, 97

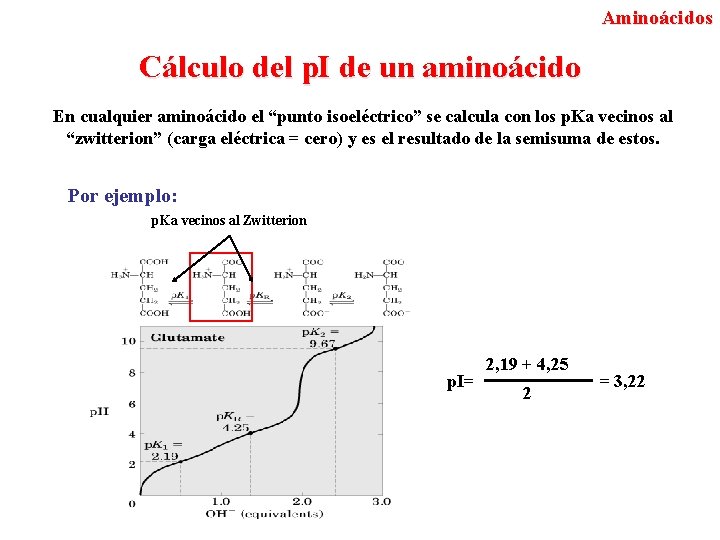
Aminoácidos Cálculo del p. I de un aminoácido En cualquier aminoácido el “punto isoeléctrico” se calcula con los p. Ka vecinos al “zwitterion” (carga eléctrica = cero) y es el resultado de la semisuma de estos. Por ejemplo: p. Ka vecinos al Zwitterion p. I= 2, 19 + 4, 25 2 = 3, 22

PÉPTIDOS

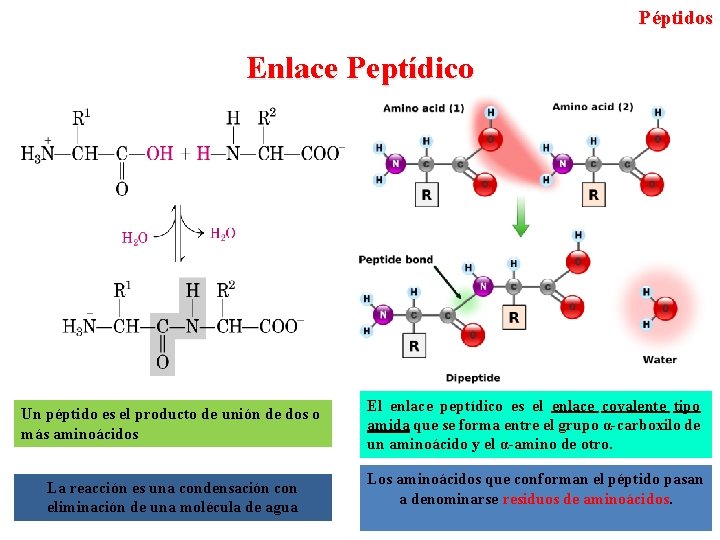
Péptidos Enlace Peptídico Un péptido es el producto de unión de dos o más aminoácidos La reacción es una condensación con eliminación de una molécula de agua El enlace peptídico es el enlace covalente tipo amida que se forma entre el grupo α-carboxilo de un aminoácido y el α-amino de otro. Los aminoácidos que conforman el péptido pasan a denominarse residuos de aminoácidos.

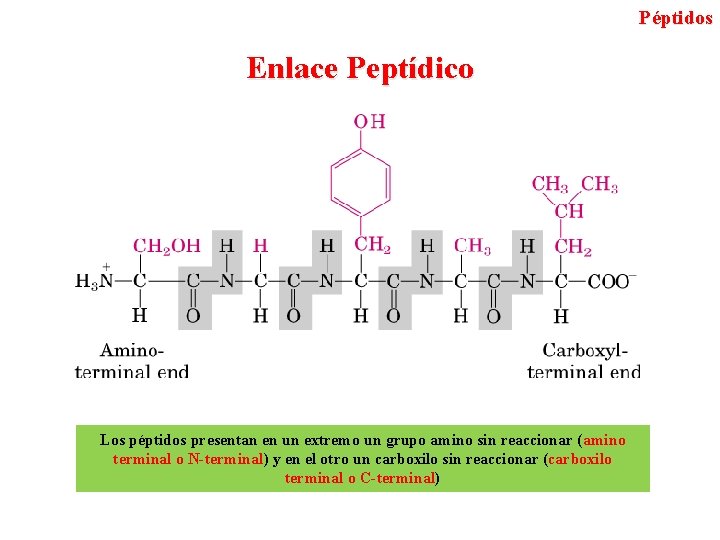
Péptidos Enlace Peptídico Los péptidos presentan en un extremo un grupo amino sin reaccionar (amino terminal o N-terminal) y en el otro un carboxilo sin reaccionar (carboxilo terminal o C-terminal)

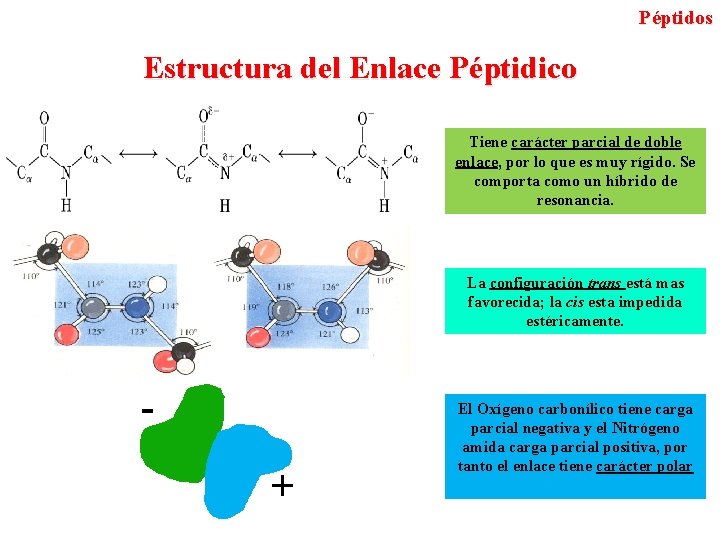
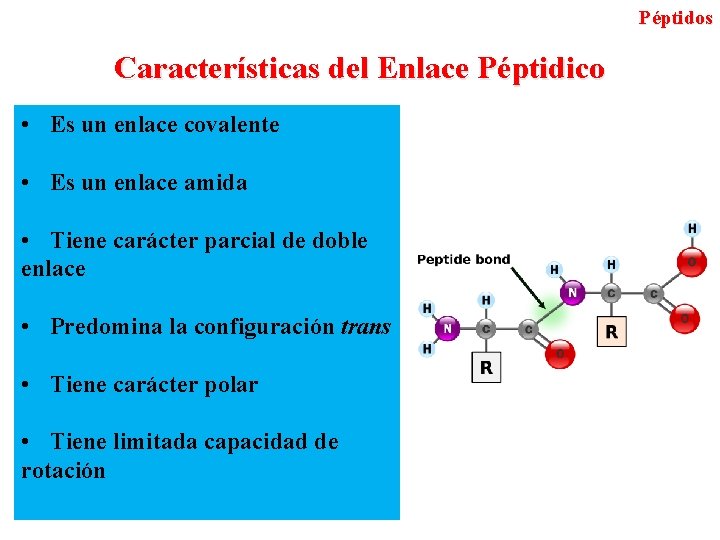
Péptidos Estructura del Enlace Péptidico Tiene carácter parcial de doble enlace, por lo que es muy rígido. Se comporta como un híbrido de resonancia. La configuración trans está mas favorecida; la cis esta impedida estéricamente. + El Oxígeno carbonílico tiene carga parcial negativa y el Nitrógeno amida carga parcial positiva, por tanto el enlace tiene carácter polar

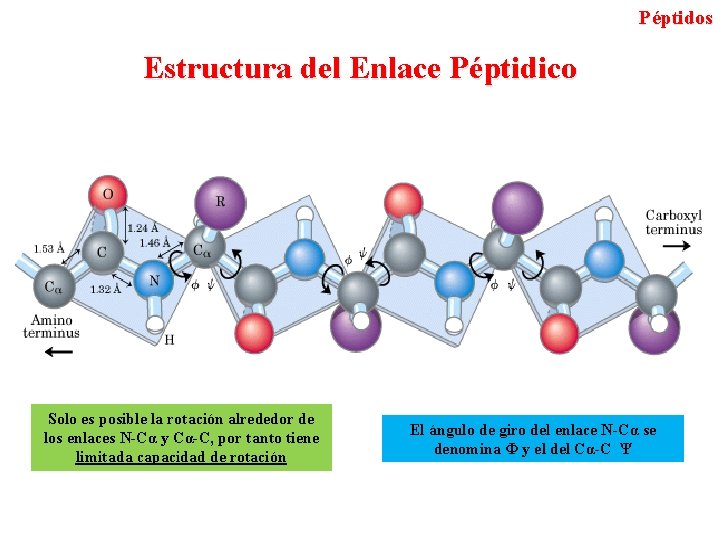
Péptidos Estructura del Enlace Péptidico Solo es posible la rotación alrededor de los enlaces N-Cα y Cα-C, por tanto tiene limitada capacidad de rotación El ángulo de giro del enlace N-Cα se denomina Φ y el del Cα-C Ψ

Péptidos Características del Enlace Péptidico • Es un enlace covalente • Es un enlace amida • Tiene carácter parcial de doble enlace • Predomina la configuración trans • Tiene carácter polar • Tiene limitada capacidad de rotación

PROTEÍNAS

PROPIEDADES DE LAS PROTEÍNAS

Propiedades de las Proteínas • Macromoléculas más abundantes • Presentes en todas las células • Polímeros compuestos por monómeros (aminoácidos) • Estructuras y Funciones diversas • Organización jerárquica

CLASIFICACIÓN DE LAS PROTEÍNAS

Clasificación de las Proteínas • Según su Composición química: • Simples → Albúmina • Conjugadas • Nucleoproteínas → Ribosomas • Lipoproteínas → HDL • Hemoproteínas → Hemoglobina • Flavoproteínas → Succinato Deshidrogenasa • Glicoproteínas → Inmunoglobulinas • Metaloproteínas → Ceruloplasmina • Fosfoproteínas → Caseina

Clasificación de las Proteínas • Según su Forma: • Fibrosas → Colágeno • Globulares→ Enzimas → Quimotripsina

Clasificación de las Proteínas • Según el Número de subunidades: • Monoméricas → Mioglobina • Oligoméricas→ Hemoglobina

Clasificación de las Proteínas • Según su Función: • Estructural→ Queratina, Elastina • Enzimática→ DNA polimerasa III • Defensa→ Inmunoglobulinas • Hormonal→ Insulina • Transporte→ Transferrina • Reserva→ Ferritina

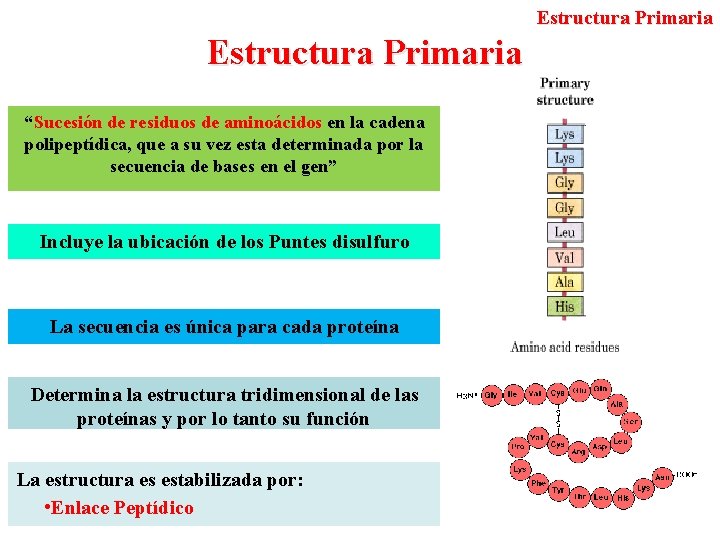
Estructura Primaria “Sucesión de residuos de aminoácidos en la cadena polipeptídica, que a su vez esta determinada por la secuencia de bases en el gen” Incluye la ubicación de los Puntes disulfuro La secuencia es única para cada proteína Determina la estructura tridimensional de las proteínas y por lo tanto su función La estructura es estabilizada por: • Enlace Peptídico

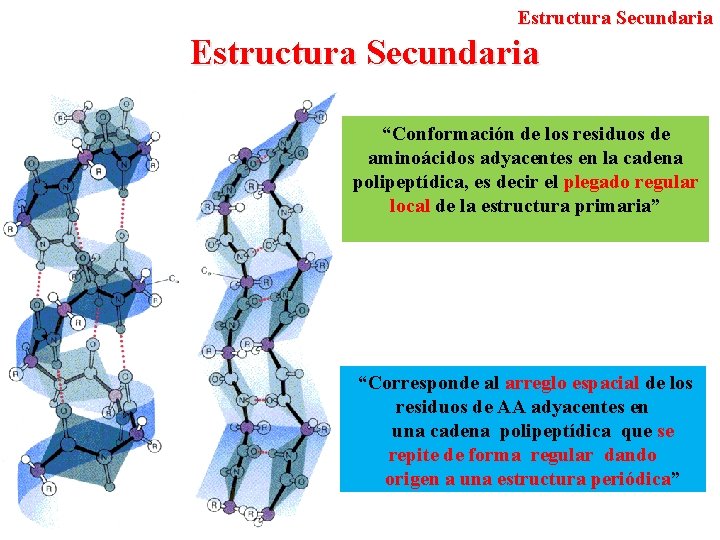
Estructura Secundaria “Conformación de los residuos de aminoácidos adyacentes en la cadena polipeptídica, es decir el plegado regular local de la estructura primaria” “Corresponde al arreglo espacial de los residuos de AA adyacentes en una cadena polipeptídica que se repite de forma regular dando origen a una estructura periódica”

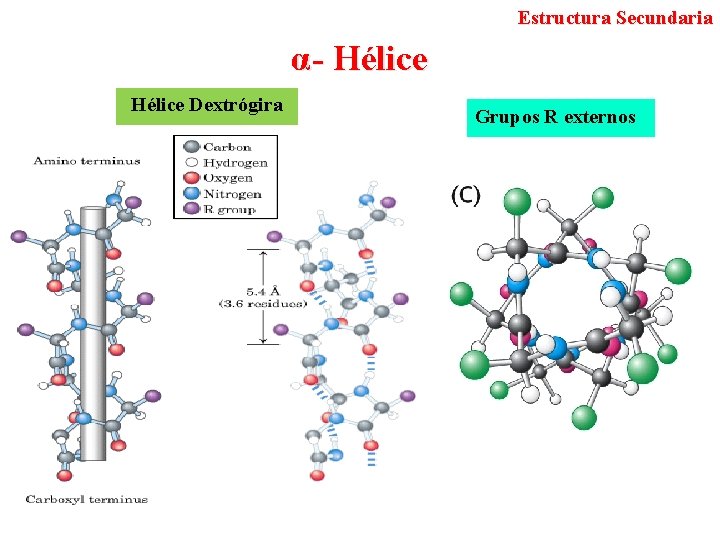
Estructura Secundaria α- Hélice Dextrógira Grupos R externos

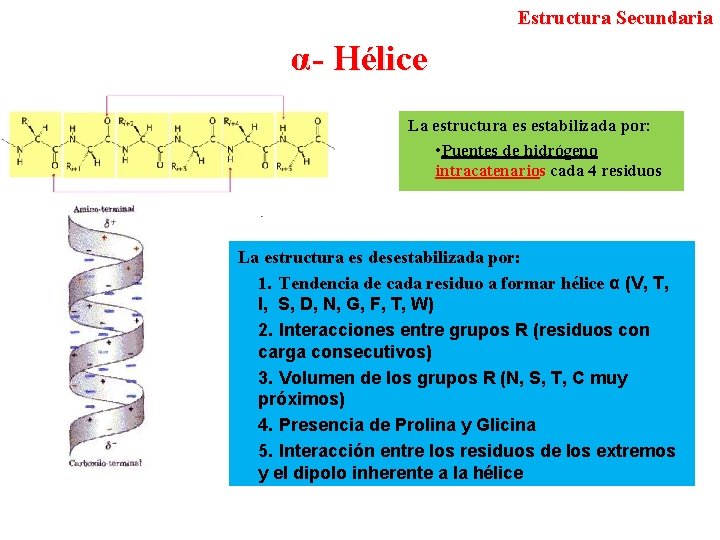
Estructura Secundaria α- Hélice La estructura es estabilizada por: • Puentes de hidrógeno intracatenarios cada 4 residuos La estructura es desestabilizada por: 1. Tendencia de cada residuo a formar hélice α (V, T, I, S, D, N, G, F, T, W) 2. Interacciones entre grupos R (residuos con carga consecutivos) 3. Volumen de los grupos R (N, S, T, C muy próximos) 4. Presencia de Prolina y Glicina 5. Interacción entre los residuos de los extremos y el dipolo inherente a la hélice

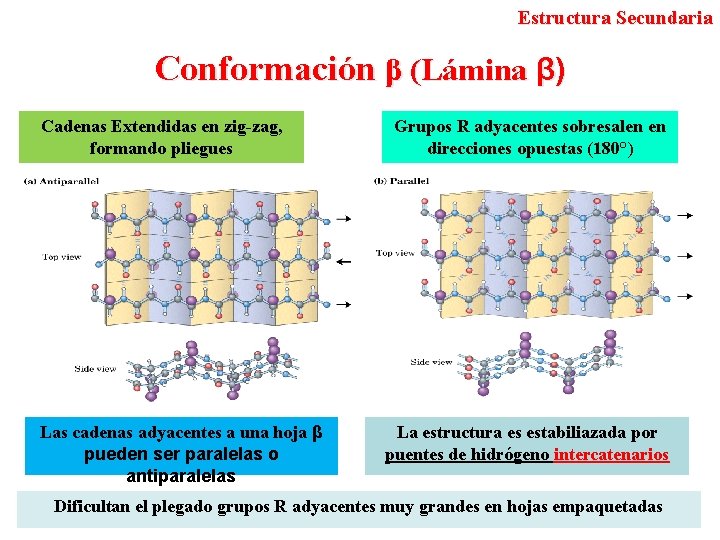
Estructura Secundaria Conformación β (Lámina β) Cadenas Extendidas en zig-zag, formando pliegues Las cadenas adyacentes a una hoja β pueden ser paralelas o antiparalelas Grupos R adyacentes sobresalen en direcciones opuestas (180°) La estructura es estabiliazada por puentes de hidrógeno intercatenarios Dificultan el plegado grupos R adyacentes muy grandes en hojas empaquetadas

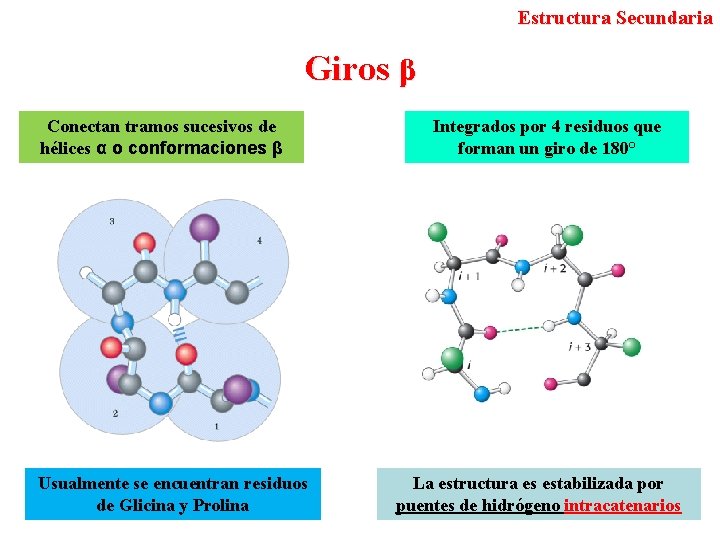
Estructura Secundaria Giros β Conectan tramos sucesivos de hélices α o conformaciones β Usualmente se encuentran residuos de Glicina y Prolina Integrados por 4 residuos que forman un giro de 180° La estructura es estabilizada por puentes de hidrógeno intracatenarios

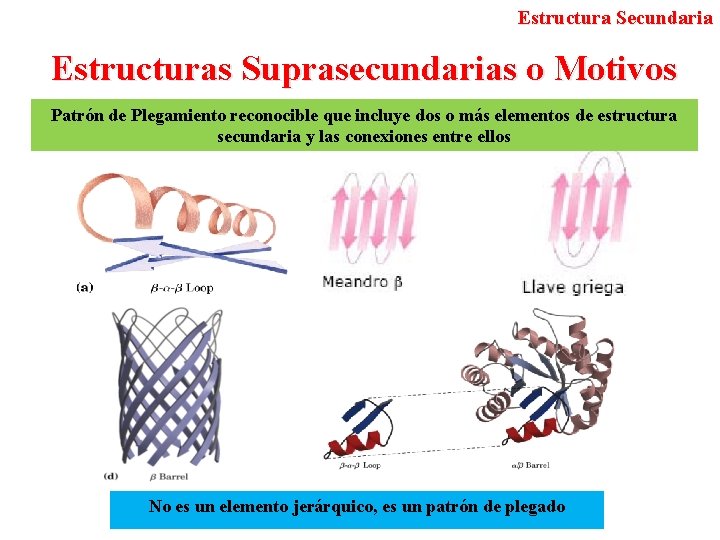
Estructura Secundaria Estructuras Suprasecundarias o Motivos Patrón de Plegamiento reconocible que incluye dos o más elementos de estructura secundaria y las conexiones entre ellos No es un elemento jerárquico, es un patrón de plegado

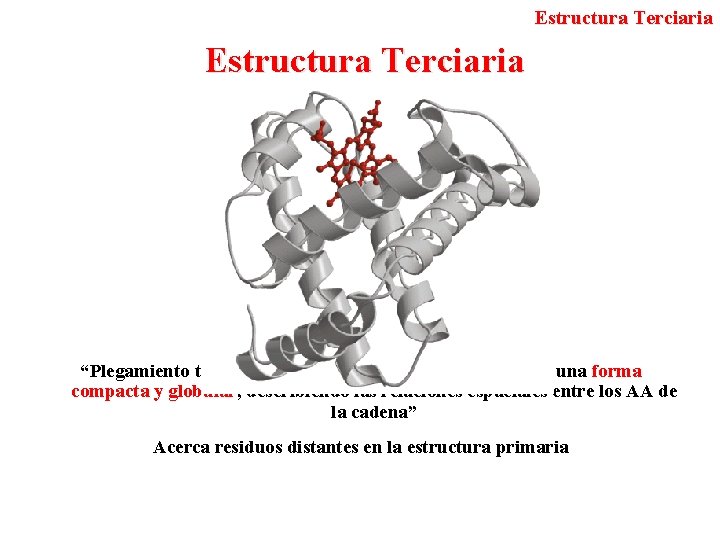
Estructura Terciaria “Plegamiento tridimensional de la cadena polipeptídica en una forma compacta y globular, describiendo las relaciones espaciales entre los AA de la cadena” Acerca residuos distantes en la estructura primaria

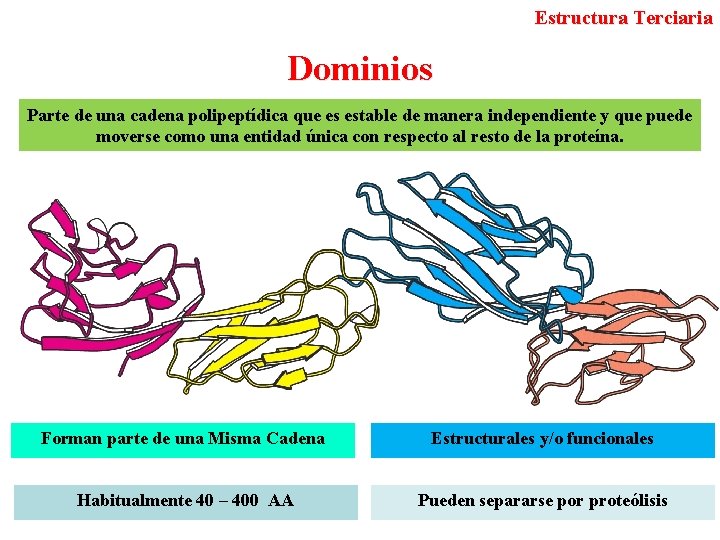
Estructura Terciaria Dominios Parte de una cadena polipeptídica que es estable de manera independiente y que puede moverse como una entidad única con respecto al resto de la proteína. Forman parte de una Misma Cadena Estructurales y/o funcionales Habitualmente 40 – 400 AA Pueden separarse por proteólisis

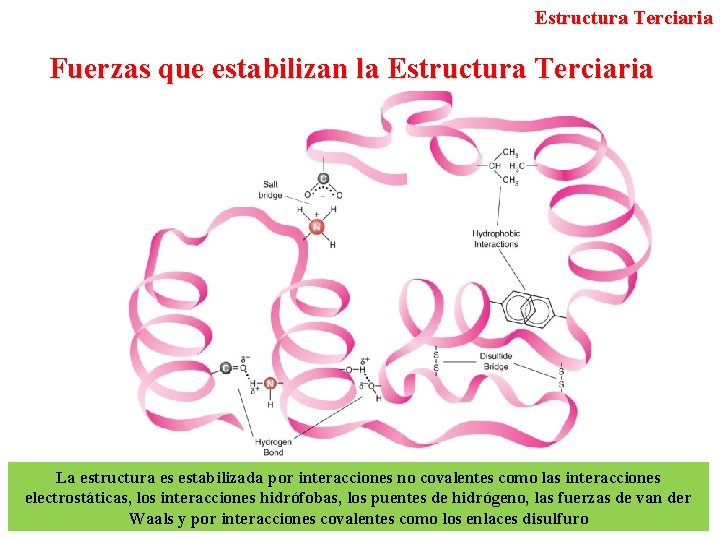
Estructura Terciaria Fuerzas que estabilizan la Estructura Terciaria La estructura es estabilizada por interacciones no covalentes como las interacciones electrostáticas, los interacciones hidrófobas, los puentes de hidrógeno, las fuerzas de van der Waals y por interacciones covalentes como los enlaces disulfuro

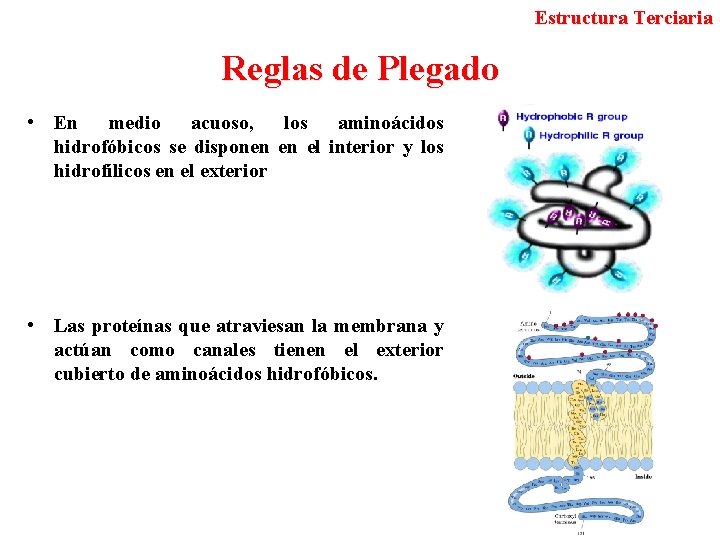
Estructura Terciaria Reglas de Plegado • En medio acuoso, los aminoácidos hidrofóbicos se disponen en el interior y los hidrofílicos en el exterior • Las proteínas que atraviesan la membrana y actúan como canales tienen el exterior cubierto de aminoácidos hidrofóbicos.

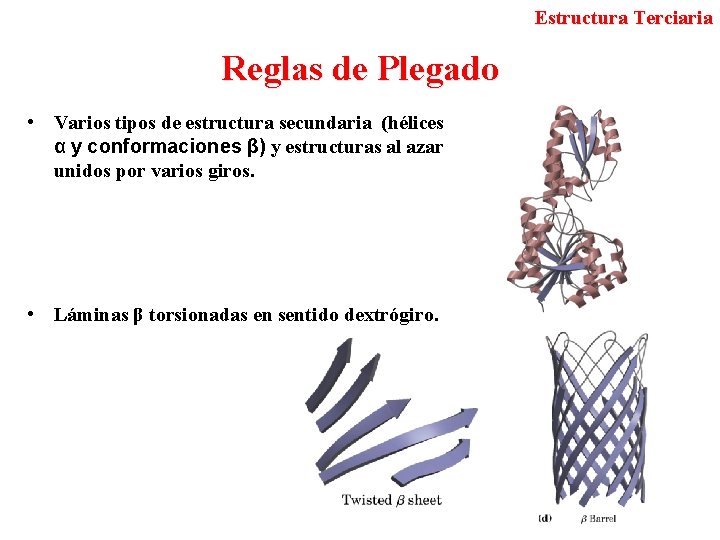
Estructura Terciaria Reglas de Plegado • Varios tipos de estructura secundaria (hélices α y conformaciones β) y estructuras al azar unidos por varios giros. • Láminas β torsionadas en sentido dextrógiro.

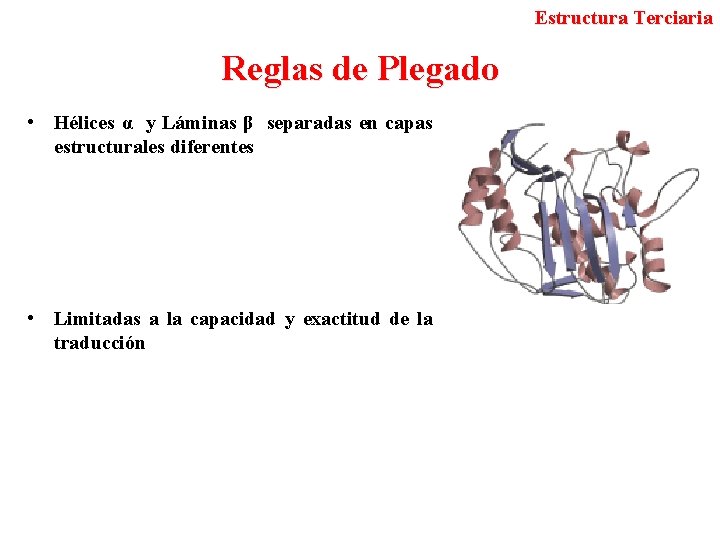
Estructura Terciaria Reglas de Plegado • Hélices α y Láminas β separadas en capas estructurales diferentes • Limitadas a la capacidad y exactitud de la traducción

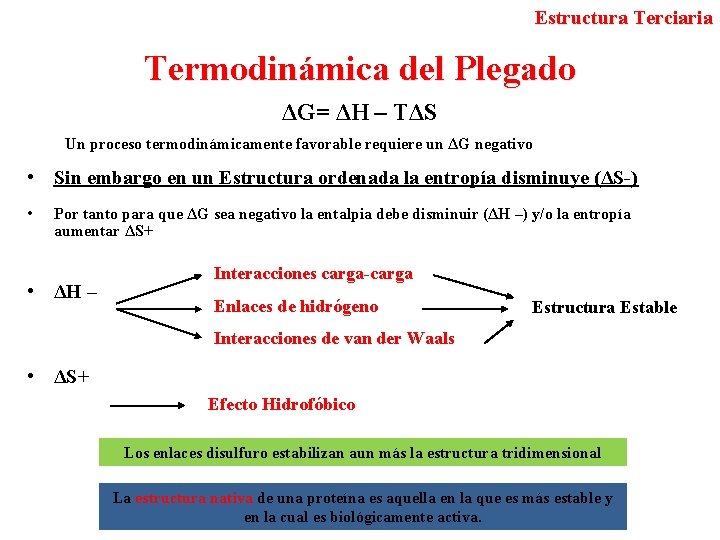
Estructura Terciaria Termodinámica del Plegado ΔG= ΔH – TΔS Un proceso termodinámicamente favorable requiere un ΔG negativo • Sin embargo en un Estructura ordenada la entropía disminuye (ΔS-) • Por tanto para que ΔG sea negativo la entalpia debe disminuir (ΔH –) y/o la entropía aumentar ΔS+ Interacciones carga-carga • ΔH – Enlaces de hidrógeno Estructura Estable Interacciones de van der Waals • ΔS+ Efecto Hidrofóbico Los enlaces disulfuro estabilizan aun más la estructura tridimensional La estructura nativa de una proteína es aquella en la que es más estable y en la cual es biológicamente activa.

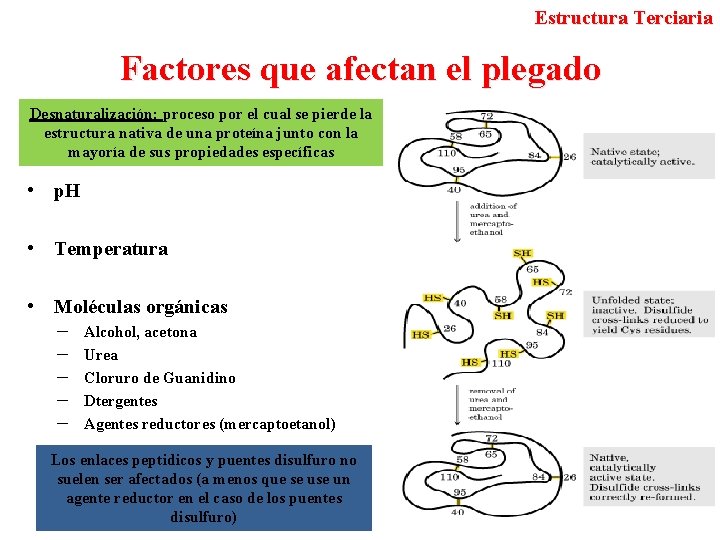
Estructura Terciaria Factores que afectan el plegado Desnaturalización: proceso por el cual se pierde la estructura nativa de una proteína junto con la mayoría de sus propiedades específicas • p. H • Temperatura • Moléculas orgánicas ─ ─ ─ Alcohol, acetona Urea Cloruro de Guanidino Dtergentes Agentes reductores (mercaptoetanol) Los enlaces peptidicos y puentes disulfuro no suelen ser afectados (a menos que se un agente reductor en el caso de los puentes disulfuro)

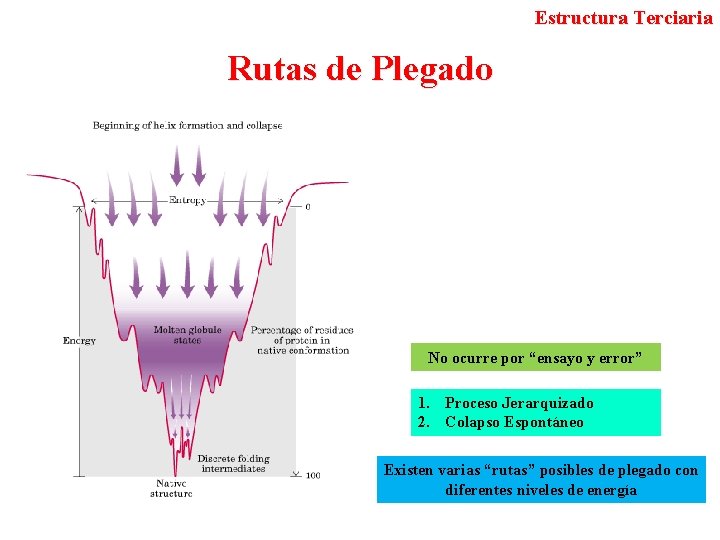
Estructura Terciaria Rutas de Plegado No ocurre por “ensayo y error” 1. Proceso Jerarquizado 2. Colapso Espontáneo Existen varias “rutas” posibles de plegado con diferentes niveles de energía

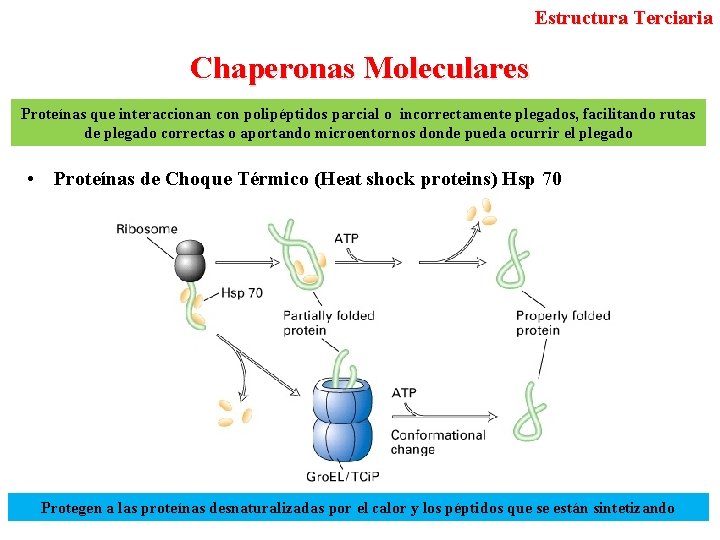
Estructura Terciaria Chaperonas Moleculares Proteínas que interaccionan con polipéptidos parcial o incorrectamente plegados, facilitando rutas de plegado correctas o aportando microentornos donde pueda ocurrir el plegado • Proteínas de Choque Térmico (Heat shock proteins) Hsp 70 Protegen a las proteínas desnaturalizadas por el calor y los péptidos que se están sintetizando

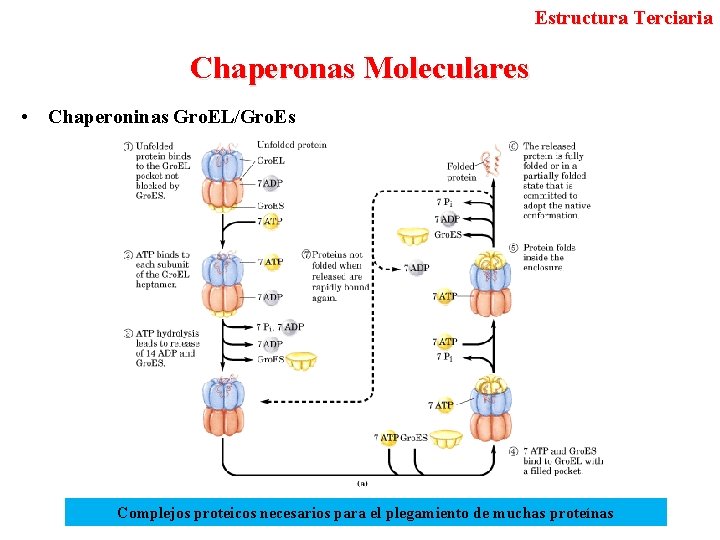
Estructura Terciaria Chaperonas Moleculares • Chaperoninas Gro. EL/Gro. Es Complejos proteicos necesarios para el plegamiento de muchas proteínas

ESTRUCTURA CUATERNARIA

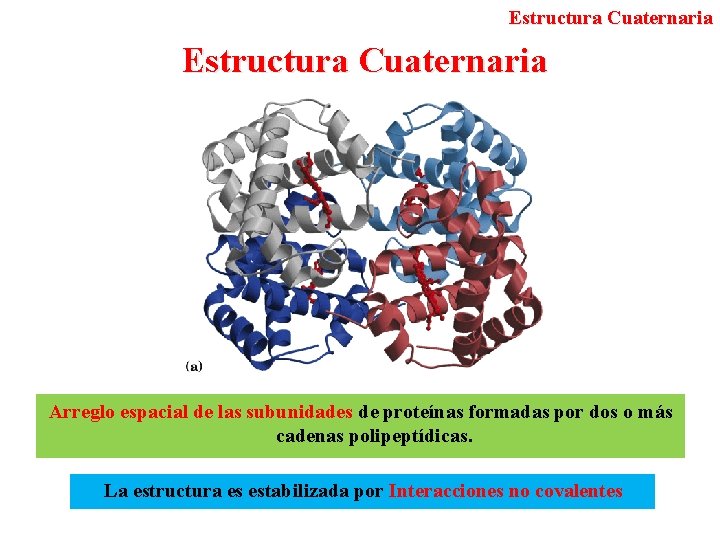
Estructura Cuaternaria Arreglo espacial de las subunidades de proteínas formadas por dos o más cadenas polipeptídicas. La estructura es estabilizada por Interacciones no covalentes

ALGUNAS PROTEÍNAS DE IMPORTANCIA FISIOLÓGICA

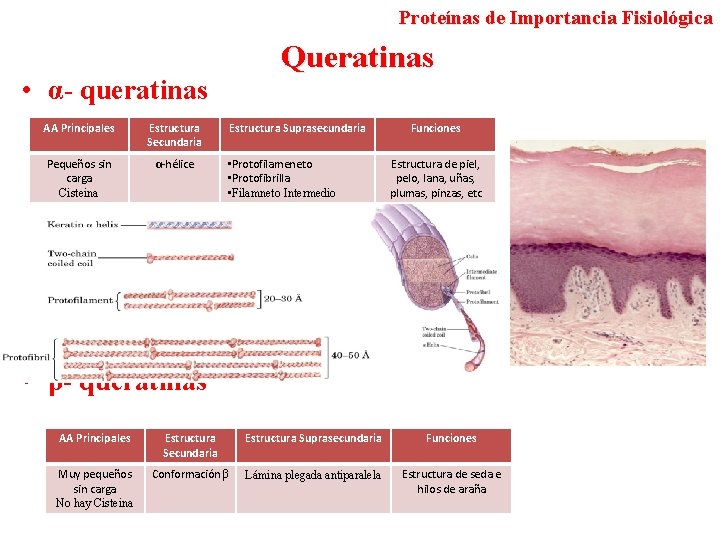
Proteínas de Importancia Fisiológica Queratinas • α- queratinas AA Principales Estructura Secundaria Pequeños sin carga Cisteina α-hélice Estructura Suprasecundaria • Protofilameneto • Protofibrilla • Filamneto Intermedio Funciones Estructura de piel, pelo, lana, uñas, plumas, pinzas, etc • β- queratinas AA Principales Estructura Secundaria Estructura Suprasecundaria Funciones Muy pequeños sin carga No hay Cisteina Conformación β Lámina plegada antiparalela Estructura de seda e hilos de araña

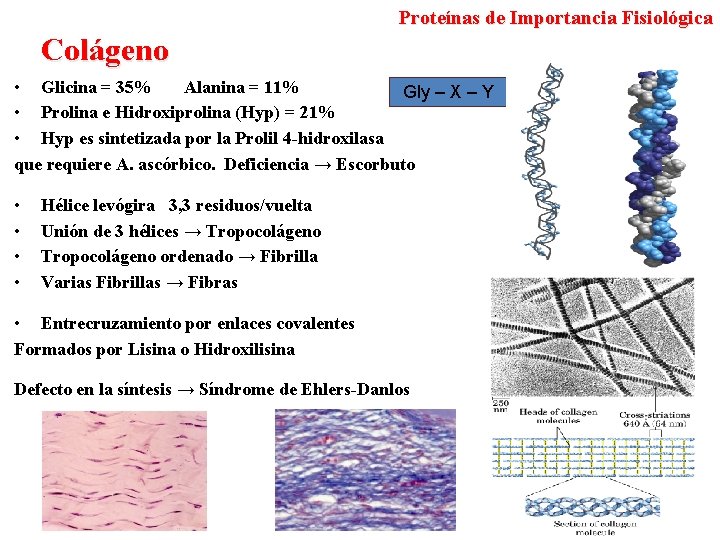
Proteínas de Importancia Fisiológica Colágeno • Glicina = 35% Alanina = 11% Gly – X – Y • Prolina e Hidroxiprolina (Hyp) = 21% • Hyp es sintetizada por la Prolil 4 -hidroxilasa que requiere A. ascórbico. Deficiencia → Escorbuto • • Hélice levógira 3, 3 residuos/vuelta Unión de 3 hélices → Tropocolágeno ordenado → Fibrilla Varias Fibrillas → Fibras • Entrecruzamiento por enlaces covalentes Formados por Lisina o Hidroxilisina Defecto en la síntesis → Síndrome de Ehlers-Danlos

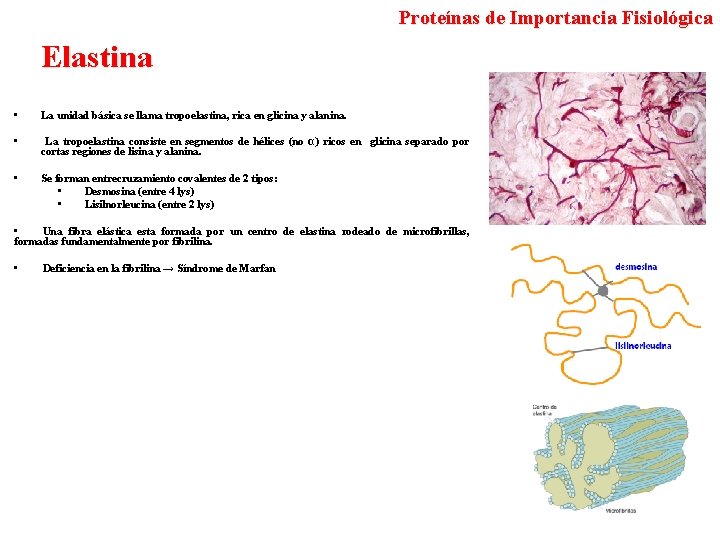
Proteínas de Importancia Fisiológica Elastina • La unidad básica se llama tropoelastina, rica en glicina y alanina. • La tropoelastina consiste en segmentos de hélices (no α) ricos en glicina separado por cortas regiones de lisina y alanina. • Se forman entrecruzamiento covalentes de 2 tipos: • Desmosina (entre 4 lys) • Lisilnorleucina (entre 2 lys) • Una fibra elástica esta formada por un centro de elastina rodeado de microfibrillas, formadas fundamentalmente por fibrilina. • Deficiencia en la fibrilina → Síndrome de Marfan

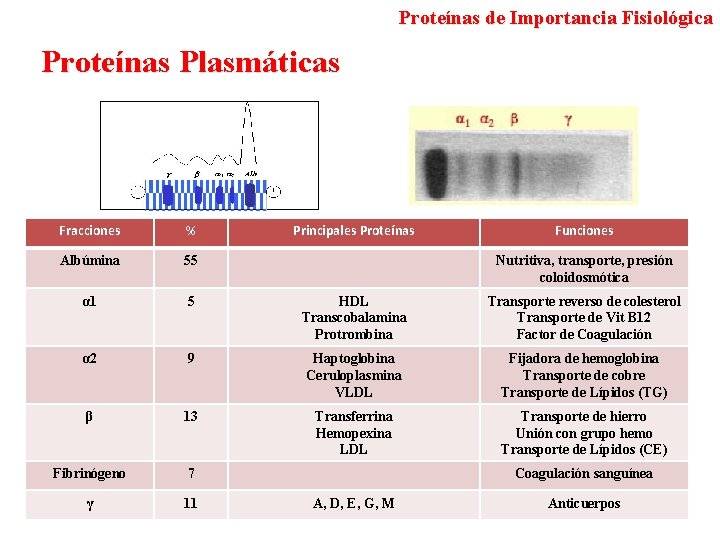
Proteínas de Importancia Fisiológica Proteínas Plasmáticas Fracciones % Principales Proteínas Funciones Albúmina 55 α 1 5 HDL Transcobalamina Protrombina Transporte reverso de colesterol Transporte de Vit B 12 Factor de Coagulación α 2 9 Haptoglobina Ceruloplasmina VLDL Fijadora de hemoglobina Transporte de cobre Transporte de Lípidos (TG) β 13 Transferrina Hemopexina LDL Transporte de hierro Unión con grupo hemo Transporte de Lípidos (CE) Fibrinógeno 7 γ 11 Nutritiva, transporte, presión coloidosmótica Coagulación sanguínea A, D, E, G, M Anticuerpos

Proteínas de Importancia Fisiológica Otras Proteínas • Mioglobina → Hemoproteína fijadora de oxígeno en los músculos • Hemoglobina → Hemoproteína transportadora de oxígeno • Citocromo C → Hemoproteína de la cadena transportadora de electrones • Lisozima → Enzima presente en la clara de huevo y las lagrimas capaz de hidrolizar polisacáridos de las paredes bacterianas • Ribonucleasa → enzima digestiva secretada por el páncreas que hidroliza ácidos nucleicos

MÉTODOS DE ESTUDIO DE LAS PROTEÍNAS

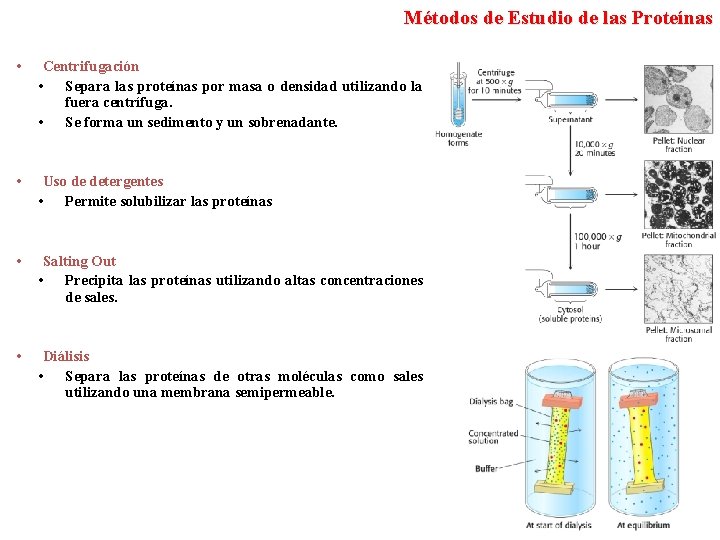
Métodos de Estudio de las Proteínas • Centrifugación • Separa las proteínas por masa o densidad utilizando la fuera centrífuga. • Se forma un sedimento y un sobrenadante. • Uso de detergentes • Permite solubilizar las proteínas • Salting Out • Precipita las proteínas utilizando altas concentraciones de sales. • Diálisis • Separa las proteínas de otras moléculas como sales utilizando una membrana semipermeable.

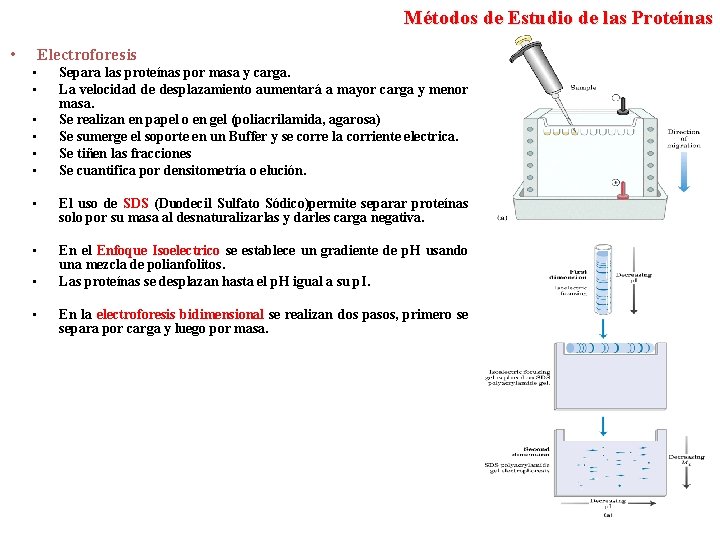
Métodos de Estudio de las Proteínas • Electroforesis • • • Separa las proteínas por masa y carga. La velocidad de desplazamiento aumentará a mayor carga y menor masa. Se realizan en papel o en gel (poliacrilamida, agarosa) Se sumerge el soporte en un Buffer y se corre la corriente electrica. Se tiñen las fracciones Se cuantifica por densitometría o elución. • El uso de SDS (Duodecil Sulfato Sódico)permite separar proteínas solo por su masa al desnaturalizarlas y darles carga negativa. • En el Enfoque Isoelectrico se establece un gradiente de p. H usando una mezcla de polianfolitos. Las proteínas se desplazan hasta el p. H igual a su p. I. • • En la electroforesis bidimensional se realizan dos pasos, primero se separa por carga y luego por masa.

Métodos de Estudio de las Proteínas • Cromatografía • • Utiliza una fase sólida (fase estacionaria o lecho), con la cual interactuan las proteínas. Entre más interactuen con el lecho más tardarán en moverse. • • Cromatografía de filtración en gel Separa las proteínas por masa Utiliza un lecho poroso (poliacrilamida, agarosa) Las proteínas pequeñas tardan mas en salir. • • • Cromatografía de intercambio iónico Separa las proteínas por carga Utiliza un lecho cubierto con grupos amino o carboxilo • • • Cromatografía de afinidad Separa proteínas por su unión selectiva Utiliza lechos especiales como sustratos, enzimas, etc. • • • Cromatografía líquida de alta presión (HPLC) Utiliza material más fino y altas presiones. Alta resolución y rápida separación.

Bibliografía • Alemán, I (2010). Estructura de las Proteínas. Presentación en Power Point. Cátedra de Bioquímica, Escuela de Medicina José María Vargas – UCV • Campos, Y (2007). Proteínas. Presentación en Power Point. Cátedra de Bioquímica, Escuela de Medicina José María Vargas – UCV • Ciarletta, E (2004). Las Proteínas. Guía de Estudio Cátedra de Bioquímica, Escuela de Medicina José María Vargas – UCV pp 5 - 48 • Mathews, C; van Holde, K y Ahern, K (2003). Bioquímica, 3 a Edición, Pearson Educación; Madrid, España • Murray, R; Granner, D; Mayes, P y Rodwell, V (1997). Harper: Bioquímica ilustrada 14ª Edición, Manual Moderno; Ciudad de México; pp 29– 38 • Nelson, D y Cox, M (2009). Lehninger Principios de Bioquímica, 5 a Edición, Ediciones Omega; Barcelona, España; pp 71 – 117

“Puesto que las proteínas participan de un modo u otro en todos los procesos químicos de un organismo vivo, se podría esperar que la elucidación de sus estructuras y de sus transformaciones permitiera obtener información altamente significativa para el ámbito de la química biológica” Emil Fischer, 1906

“Estudiar los fenómenos patológicos sin libros es como navegar por el mar sin cartas de navegación…” Sir William Osler

Gracias
 Puño percusion positiva
Puño percusion positiva Universidad austral medicina
Universidad austral medicina Universidad javeriana - facultad de medicina
Universidad javeriana - facultad de medicina Facultad de medicina universidad de la sabana
Facultad de medicina universidad de la sabana Universidad austral de chile facultad de medicina
Universidad austral de chile facultad de medicina Universidad veracruzana campus minatitlán
Universidad veracruzana campus minatitlán Universidad de campeche medicina
Universidad de campeche medicina Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad de carabobo facultad de derecho
Universidad de carabobo facultad de derecho Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad san martin de porres facultad de derecho
Universidad san martin de porres facultad de derecho Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor Facultad de arquitectura universidad de panama
Facultad de arquitectura universidad de panama Universidad de carabobo facultad de odontologia
Universidad de carabobo facultad de odontologia Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Facultad de informatica universidad de panama
Facultad de informatica universidad de panama Universidad bolivariana de venezuela ciudad bolivar
Universidad bolivariana de venezuela ciudad bolivar Universidad bolivariana de venezuela
Universidad bolivariana de venezuela Universidad mayor de san simon medicina
Universidad mayor de san simon medicina Universidad austral medicina
Universidad austral medicina Medicina universidad pedro de valdivia
Medicina universidad pedro de valdivia Bpmv en acp significado
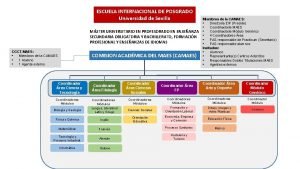
Bpmv en acp significado Escuela internacional posgrado sevilla
Escuela internacional posgrado sevilla Escuela internacional de posgrado
Escuela internacional de posgrado Escuela de postgrado universidad andina del cusco
Escuela de postgrado universidad andina del cusco Principal centrales hidroelectricas de venezuela
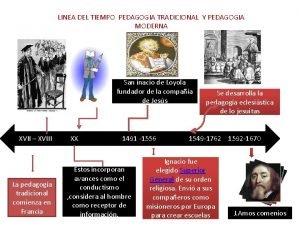
Principal centrales hidroelectricas de venezuela Linea del tiempo escuela tradicional
Linea del tiempo escuela tradicional Hacer de una escuela una buena escuela
Hacer de una escuela una buena escuela Escuela nueva y escuela tradicional
Escuela nueva y escuela tradicional Didactica tradicional
Didactica tradicional Central university of las villas
Central university of las villas Universidad central del ecuador
Universidad central del ecuador Universidad central de bayamon direccion
Universidad central de bayamon direccion Universidad central de las villas
Universidad central de las villas Facultad natural
Facultad natural Bioanalisis xalapa
Bioanalisis xalapa Facultad miguel enriquez
Facultad miguel enriquez Organigrama de la facultad de ingeniería.
Organigrama de la facultad de ingeniería. Facultad de ciencias quimicas unach
Facultad de ciencias quimicas unach Facultad de auditoria
Facultad de auditoria Psicologia uab assignatures
Psicologia uab assignatures Escolares arq unam
Escolares arq unam Facultad de economia oruro
Facultad de economia oruro Uedic
Uedic Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Facultad de turismo en san marcos
Facultad de turismo en san marcos Derecho subjetivo o derecho facultad
Derecho subjetivo o derecho facultad Facultad de arquitectura servicio social
Facultad de arquitectura servicio social Facultad de ciencias físicas ucm
Facultad de ciencias físicas ucm Facultad de psicologia
Facultad de psicologia Reglamento de admision docente uto
Reglamento de admision docente uto Facultad de bioanalisis
Facultad de bioanalisis Aulica don bosco san luis
Aulica don bosco san luis Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Facultad de odontologia usac
Facultad de odontologia usac Facultad farmacia ull
Facultad farmacia ull Facultad de voluntad
Facultad de voluntad Facultad de derecho ufm
Facultad de derecho ufm Bangolou
Bangolou Www.facultaddelenguas/ccia-registro
Www.facultaddelenguas/ccia-registro Facultad de ciencias médicas y biológicas umsnh
Facultad de ciencias médicas y biológicas umsnh Ecologia marina carrera
Ecologia marina carrera Facultad de ciencias agricolas uce
Facultad de ciencias agricolas uce Facultad derecho ugr
Facultad derecho ugr Portada facultad de derecho
Portada facultad de derecho Universidad veracruzana campus xalapa
Universidad veracruzana campus xalapa University of pecs faculty of health sciences
University of pecs faculty of health sciences Ims health
Ims health Vpi vci venezuela
Vpi vci venezuela Promocion banco de venezuela
Promocion banco de venezuela Sisvan venezuela
Sisvan venezuela Veintenal
Veintenal Vasto lago del venezuela
Vasto lago del venezuela Bestos de venezuela
Bestos de venezuela Tipos de sociedades mercantiles en venezuela
Tipos de sociedades mercantiles en venezuela