Protenas Aminocidos Frmula estructural Enlace peptdico Estructuras primarias













- Slides: 19

Proteínas Aminoácidos. Fórmula estructural. Enlace peptídico. Estructuras primarias, secundarias, terciarias, cuaternarias. Propiedades de las proteínas: Especificidad y Desnaturalización.

Proteínas La palabra proteína viene del griego protos que significa "lo más antiguo, lo primero”. Las proteínas son biopolímeros (macromoléculas orgánicas) de elevado peso molecular; compuestos químicos muy complejos que se encuentran en todas las células vivas. Hay ciertos elementos químicos que todas ellas poseen, pero los diversos tipos de proteínas los contienen en diferentes cantidades. Están constituidas básicamente por carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); aunque pueden contener también azufre (S) y fósforo (P) y, en menor proporción, hierro (Fe), cobre (Cu), magnesio (Mg), yodo (Y).

Conformación de las proteínas Las proteínas son las moléculas orgánicas más abundantes en las células; constituyen alrededor del 50 % de su peso seco o más que eso en algunos casos. Una bacteria puede tener cerca de 1000 proteínas diferentes, pero en una célula humana puede haber 10. 000 clases de proteínas distintas. Químicamente, las proteínas están formadas por la unión de muchas moléculas relativamente sencillas y no hidrolizables, denominadas Aminoácidos (Aa). Los aminoácidos se unen entre sí originando péptidos. Según su tamaño molecular, pueden ser oligopéptidos, formados por no más de 10 Aa y polipéptidos, constituidos por más de 10 Aa. Cuando el número de Aa supera los 50 y el polipéptido tiene una estructura tridimensional específica, entonces se habla propiamente de proteínas.

Aminoácidos Los aminoácidos (Aa) son moléculas orgánicas pequeñas con un grupo amino (NH 2) y un grupo carboxilo (COOH) en su estructura. La gran cantidad de proteínas que se conocen están formadas únicamente por 20 Aa diferentes. Se conocen otros 150 que no forman parte de las proteínas. Fórmula General de los Aa:

Tabla de los Aminoácidos

Aminoácidos Esenciales Son aquellos que los organismos deben tomar de su dieta ya que no pueden sintetizarlos en su cuerpo. Las rutas metabólicas para su obtención suelen ser largas y energéticamente costosas, por lo que los vertebrados las han ido perdiendo a lo largo de la evolución (resulta menos costoso obtener estos Aa. E en los alimentos). EN ADULTOS: 8 Fenilalanina Isoleucina Lisina Metionina Treonina Triptófano Valina EN NIÑOS los anteriores y: Arginina Histidina

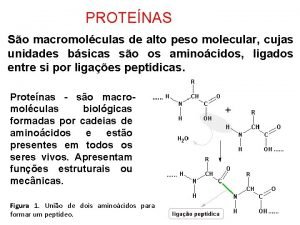
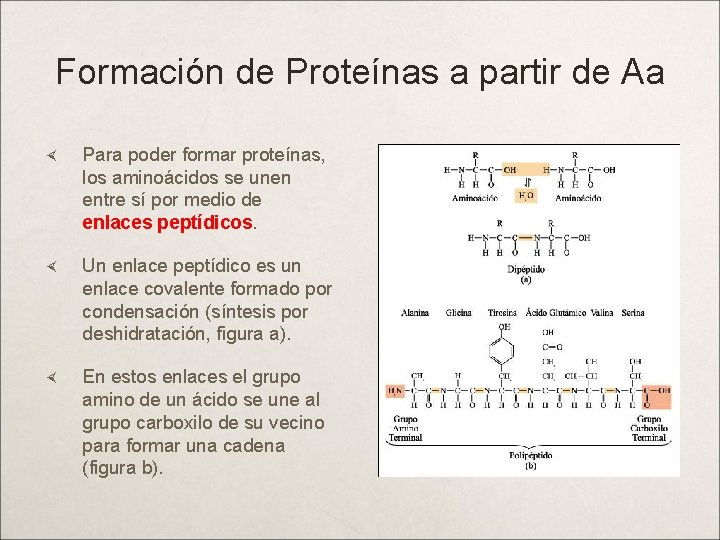
Formación de Proteínas a partir de Aa Para poder formar proteínas, los aminoácidos se unen entre sí por medio de enlaces peptídicos. Un enlace peptídico es un enlace covalente formado por condensación (síntesis por deshidratación, figura a). En estos enlaces el grupo amino de un ácido se une al grupo carboxilo de su vecino para formar una cadena (figura b).

Recordar! El enlace C-N tiene cierto carácter de doble enlace, por lo cual le confiere rigidez a la molécula. La rotación de la molécula formada queda restringida a los carbonos alfa.

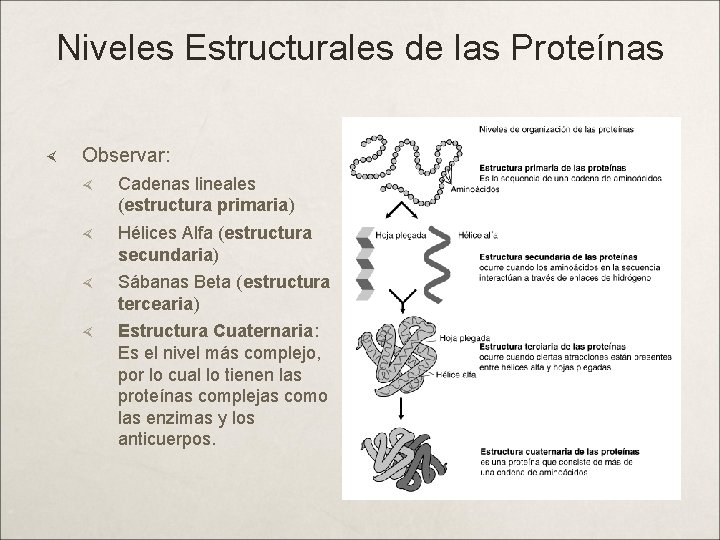
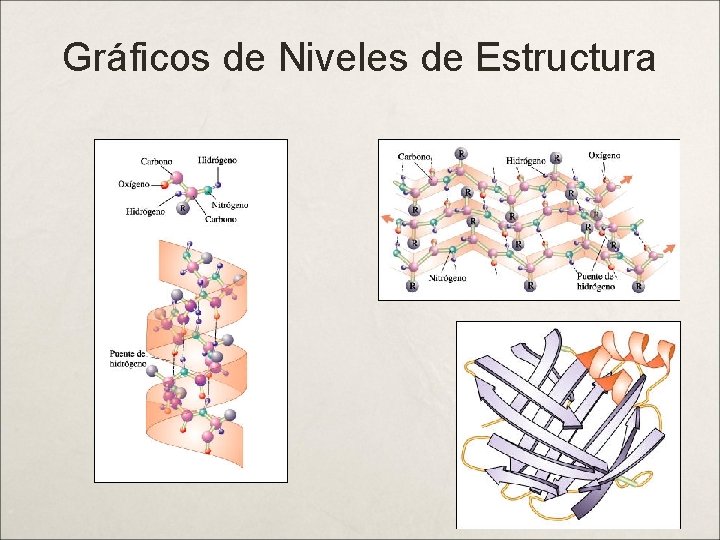
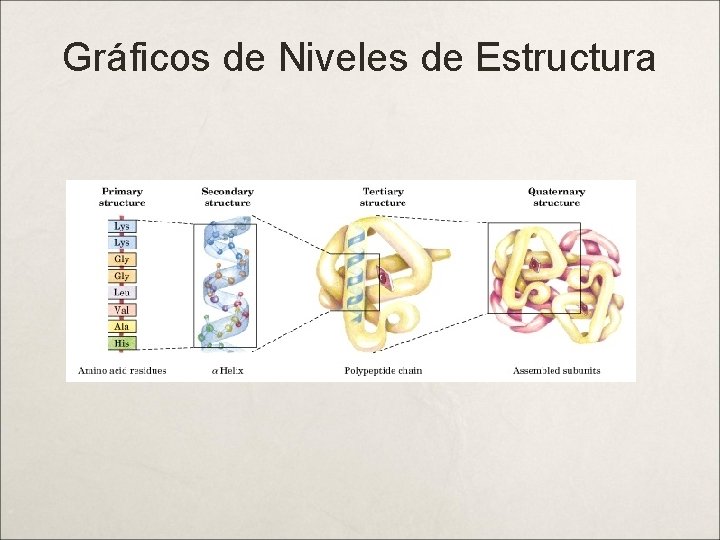
Niveles Estructurales de las Proteínas Estructura Primaria : Es el esqueleto covalente de la cadena polipeptídica, y establece la secuencia de aminoácidos. Enlace Peptídico (EP). Estructura Secundaria : Ordenación regular y periódica de la cadena polopeptídica en el espacio (Hélice-a). Puentes H entre los EP. Estructura Terciaria : Forma en la cual la cadena polipeptídica se curva o se pliega para formar estructuras estrechamente plegadas y compactas como la de las proteínas globulares (sábanas Beta); participan las atracciones intermoleculares: puentes de hidrógeno entre cadenas laterales, puentes 2 S, interacción hidrofóbica, interacción electrostática. Estructura Cuaternaria : Es el arreglo espacial de las subunidades de una proteínas, para conformar la estructura global; hay acompañamiento paralelo de las cadenas polipeptídicas, responsable de las funciones de las proteínas. Las fuerzas anteriores más las Fuerzas de Van der Walls.

Niveles Estructurales de las Proteínas Observar: Cadenas lineales (estructura primaria) Hélices Alfa (estructura secundaria) Sábanas Beta (estructura tercearia) Estructura Cuaternaria: Es el nivel más complejo, por lo cual lo tienen las proteínas complejas como las enzimas y los anticuerpos.

Gráficos de Niveles de Estructura

Gráficos de Niveles de Estructura

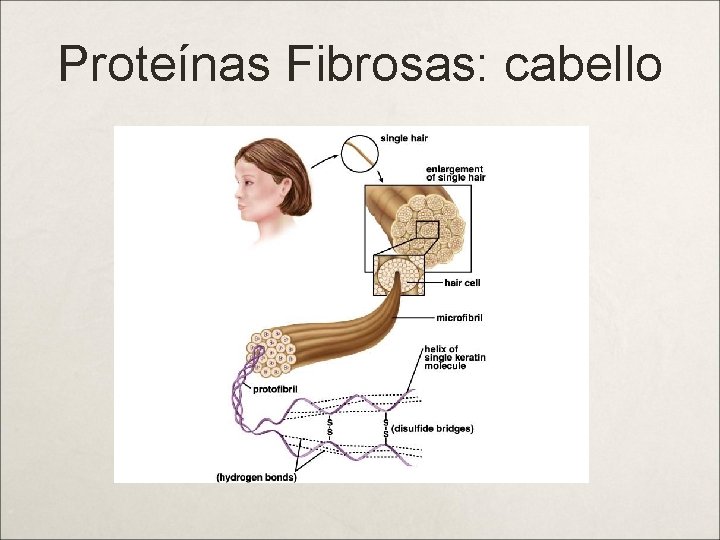
Clasificación de Proteínas Según la COMPOSICIÓN: PROTEÍNAS SIMPLES U HOLOPROTEÍNAS: son aquellas que al hidrolizarse producen únicamente aminoácidos. PROTEÍNAS CONJUGADAS O HETEROPROTEÍNAS: son proteínas que al hidrolizarse producen además de los aminoácidos, otros componentes orgánicos o inorgánicos. La porción no protéica de una proteína conjugada se denomina "grupo prostético". Las proteínas cojugadas se subclasifican de acuerdo con la naturaleza de sus grupos prostéticos. Según su CONFORMACIÓN: Conformación = orientación tridimensional que adquieren los grupos característicos de una molécula en el espacio. PROTEÍNAS FIBROSAS: se constituyen por cadenas polipeptídicas alineadas en forma paralela; esto puede producir fibras que se trenzan sobre si mismas formando una "macrofibra", como en el caso del colágeno de los tendones o la aqueratina del cabello; o produce la formación de láminas como en el caso de las b-queratinas de las sedas naturales. PROTEÍNAS GLOBULARES: cadenas polipeptídicas que se enrollan sobre si mismas en formas intrincadas como un "nudillo de hilo enredado”, como una macro-estructura de tipo esférico.

Recordar! Las proteínas fibrosas poseen alta resistencia al corte por lo que son los principales soportes estructurales de los tejidos; son insolubles en agua y en soluciones salinas diliudas y en general más resistentes a los factores que las desnaturalizan. La mayoría las proteínas globulares son solubles en agua y por lo general desempeñan funciones de transporte en el organismo. Las enzimas, cuyo papel es la catálisis de las reacciones bioquímicas, son proteínas globulares.

Proteínas Fibrosas: cabello

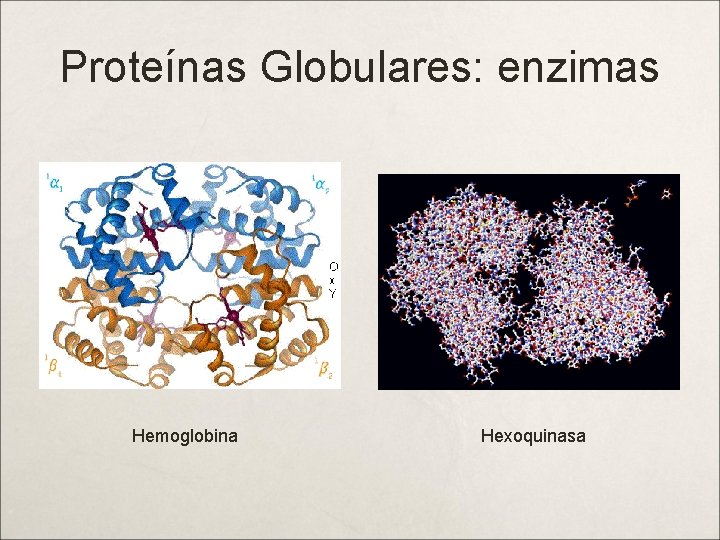
Proteínas Globulares: enzimas Hemoglobina Hexoquinasa

Funciones de las Proteínas Estructurales: algunas proteínas pueden contribuir a la conformación de órganos debido a su estructura fibrosa (ejemplo, la queratina en pelo, uñas, cutículas, cuernos, cascos). Movimiento: como el caso de las proteínas Actina y Miosina en los músculos, permiten movimiento de contracción y relajación. Transporte: se pueden unir a moléculas de menor tamaño y llevarlas por medio de la sangre, como por ejemplo la Hemoglobina o el oxígeno. Defensa: por ejemplo los anticuerpos en el torrente sanguíneo. Almacenamiento de sustancias nutritivas, como el caso de la albúmina de la clara de huevo, que se guarda en el hígado. Señales químicas: ejemplo, la hormona del crecimiento en el torrente sanguíneo o la transmisión del impulso nervioso. Catálisis: como por ejemplo las enzimas que catalizan casi todas las reacciones químicas en las células: amilasa, ATP sintetasa. Reguladores: regulan la expresión del ADN; tienen un papel importante en el crecimiento y diferenciación de las células.

Propiedades de las Proteínas ESPECIFICIDAD Referente a su función; cada una lleva a cabo una determinada función y lo realiza porque posee una determinada estructura primaria y una conformación espacial propia; por lo que un cambio en la estructura de la proteína puede significar una pérdida de la función. Además, no todas las proteinas son iguales en todos los organismos, cada individuo posee proteínas específicas suyas que se ponen de manifiesto en los procesos de rechazo de órganos transplantados. La semejanza entre proteínas son un grado de parentesco entre individuos, por lo que sirve para la construcción de "árboles filogenéticos”.

Propiedades de las Proteínas DESNATURALIZACIÓN Consiste en la pérdida de la estructura terciaria, por romperse los puentes que forman dicha estructura. Todas las proteínas desnaturalizadas tienen la misma conformación, muy abierta y con una interacción máxima con el disolvente, por lo que una proteína soluble en agua cuando se desnaturaliza se hace insoluble en agua y precipita. Se produce por cambios de factores como temperatura (el ejemplo del huevo cocido o frito ), variaciones del p. H. En algunos casos, si las condiciones se restablecen, una proteína desnaturalizada puede volver a su anterior plegamiento o conformación, proceso que se denomina renaturalización.
 Estructura primaria de las proteinas
Estructura primaria de las proteinas Estructuras de las proteinas primarias
Estructuras de las proteinas primarias Orbital sigma
Orbital sigma Protenas
Protenas La unión peptídica
La unión peptídica Cromoproteínas función
Cromoproteínas función So
So Protenas
Protenas Protenas
Protenas Proteinas monomericas
Proteinas monomericas Protenas
Protenas Protenas
Protenas Proteinas funcion en el organismo
Proteinas funcion en el organismo Protenas
Protenas Caracteristicas sexuales secundarias del hombre y mujer
Caracteristicas sexuales secundarias del hombre y mujer Superficies secundarias de control de vuelo
Superficies secundarias de control de vuelo Desinencias primarias griego
Desinencias primarias griego Direcciones primarias del diseño tridimensional
Direcciones primarias del diseño tridimensional Arte visual ponto
Arte visual ponto Ejemplos de fuentes primarias y secundarias
Ejemplos de fuentes primarias y secundarias