NIVELES ESTRUCTURALES DE LAS PROTEINAS Las protenas son









- Slides: 19

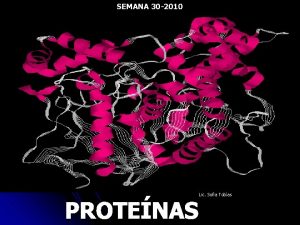
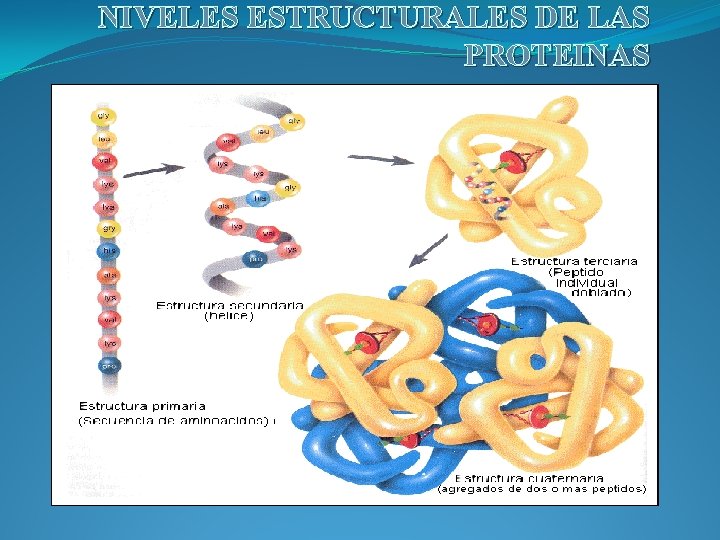
NIVELES ESTRUCTURALES DE LAS PROTEINAS

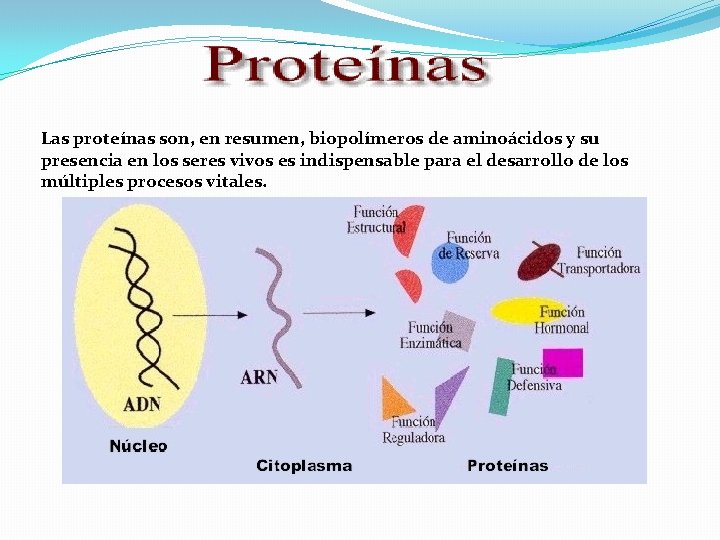
Las proteínas son, en resumen, biopolímeros de aminoácidos y su presencia en los seres vivos es indispensable para el desarrollo de los múltiples procesos vitales.

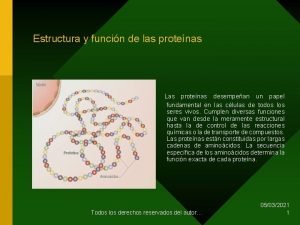
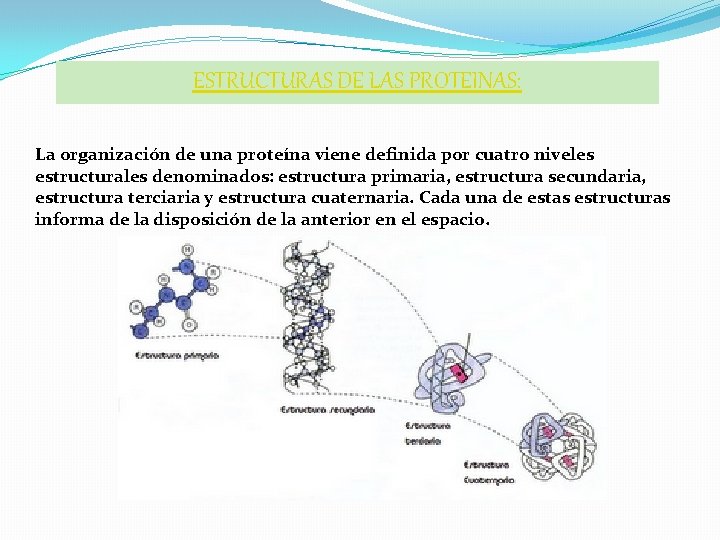
ESTRUCTURAS DE LAS PROTEINAS: La organización de una proteína viene definida por cuatro niveles estructurales denominados: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria. Cada una de estas estructuras informa de la disposición de la anterior en el espacio.

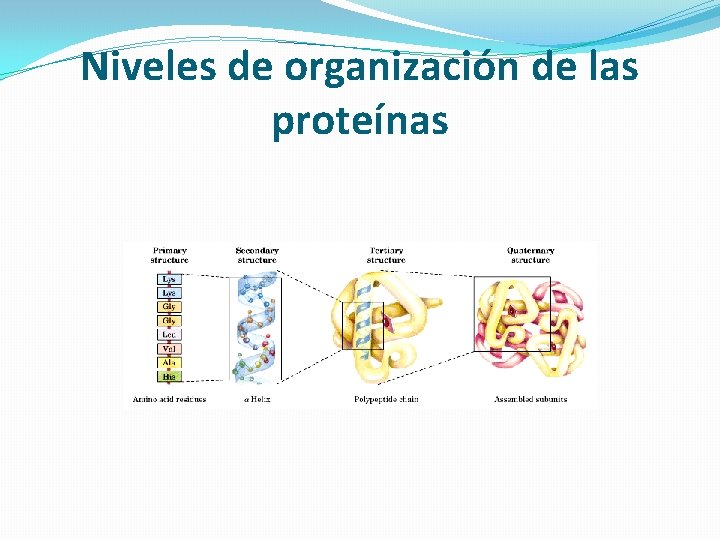
Niveles de organización de las proteínas

1 -Estructura Primaria: La estructura primaria es la secuencia de aminoácidos de la proteína. Nos indica qué aminoácidos componen la cadena polipeptídica y el orden en que dichos aminoácidos se encuentran. La función de una proteína depende de su secuencia y de la forma que ésta adopte.

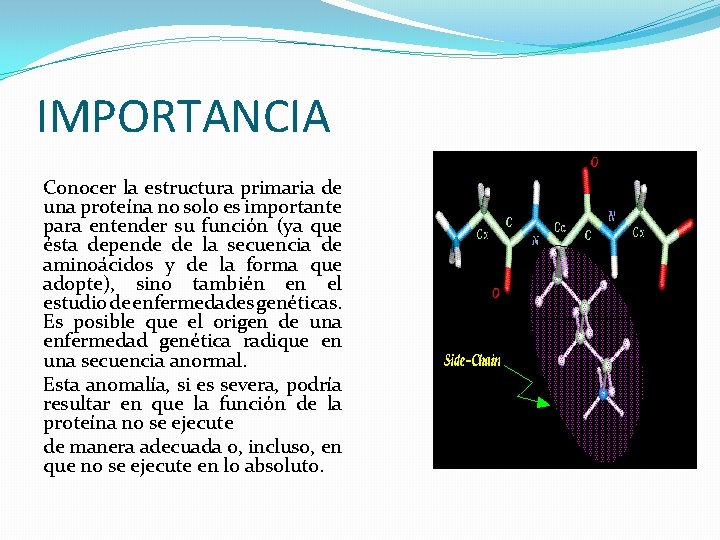
IMPORTANCIA Conocer la estructura primaria de una proteína no solo es importante para entender su función (ya que ésta depende de la secuencia de aminoácidos y de la forma que adopte), sino también en el estudio de enfermedades genéticas. Es posible que el origen de una enfermedad genética radique en una secuencia anormal. Esta anomalía, si es severa, podría resultar en que la función de la proteína no se ejecute de manera adecuada o, incluso, en que no se ejecute en lo absoluto.

Estructura secundaria La estructura secundaria de las proteínas es el plegamiento que la cadena polipeptídica adopta gracias a la formación de puentes de hidrógeno entre los átomos que forman el enlace peptídico. Los puentes de hidrógeno se establecen entre los grupos -CO- y -NH- del enlace peptídico(el primero como aceptor de H, y el segundo como donador de H). De esta forma, la cadena polipeptídica es capaz de adoptar conformaciones de menor energía libre, y por tanto, más estables.

Hélice alfa • Un puente de H entre el CO de un aminoácido y el NH del cuarto por detrás • 3, 6 aacs por vuelta de hélice • 5, 4 Amstrong (0, 15 nm) de distancia entre vuelta y vuelta • Dextrógira

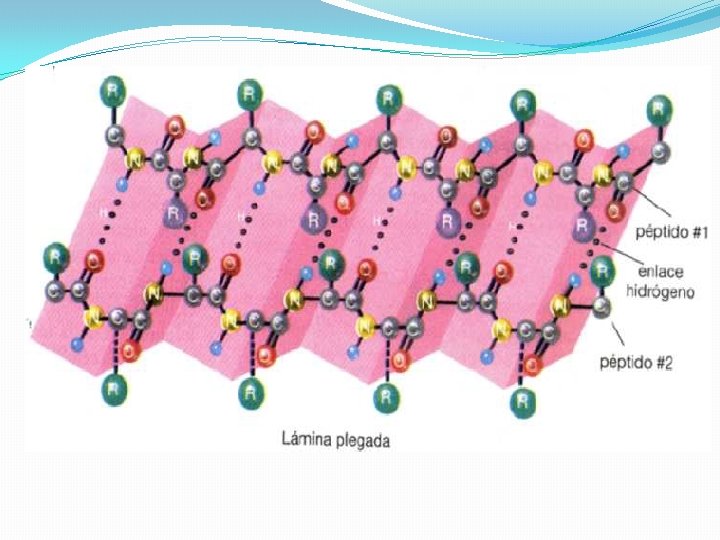
Hoja beta Cuando la cadena principal de un polipéptido se estira al máximo que permiten sus enlaces covalentes se adopta una configuración espacial denominada estructura b, que suele representarse como una flecha. En esta estructura las cadenas laterales de los aminoácidos se sitúan de forma alternante a la derecha y a la izquierda del esqueleto de la cadena polipeptídica. Las estructuras b de distintas cadenas polipeptídicas o bien las estructuras b de distintas zonas de una misma cadena polipeptídica pueden interaccionar entre sí mediante puentes de hidrógeno, dando lugar a estructuras laminares llamadas por su forma hojas plegadas u hojas b.

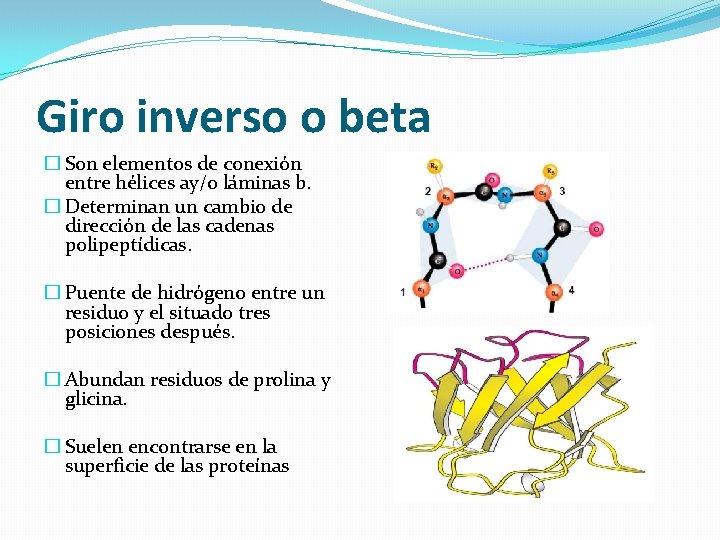
Giro inverso o beta � Son elementos de conexión entre hélices ay/o láminas b. � Determinan un cambio de dirección de las cadenas polipeptídicas. � Puente de hidrógeno entre un residuo y el situado tres posiciones después. � Abundan residuos de prolina y glicina. � Suelen encontrarse en la superficie de las proteínas

Hélice de colágeno �Es una variedad particular de la estructura secundaria, característica del colágeno. El colágeno es una importante proteína fibrosa presente en tendones y tejido conectivo con función estructural ya que es particularmente rígida

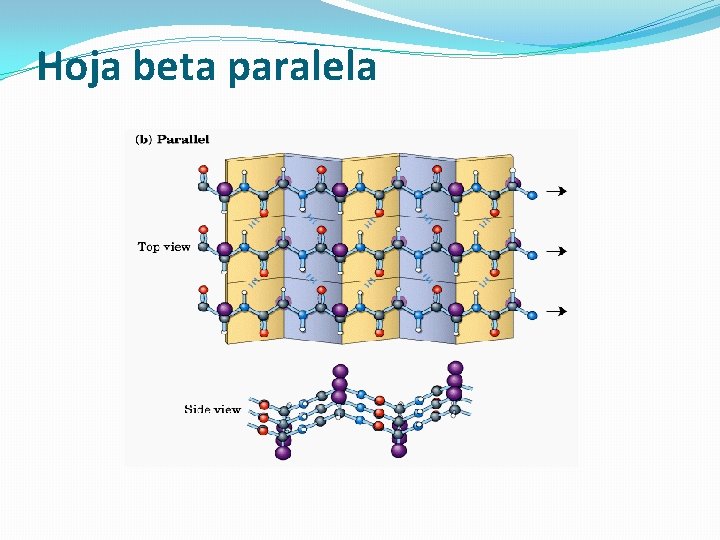
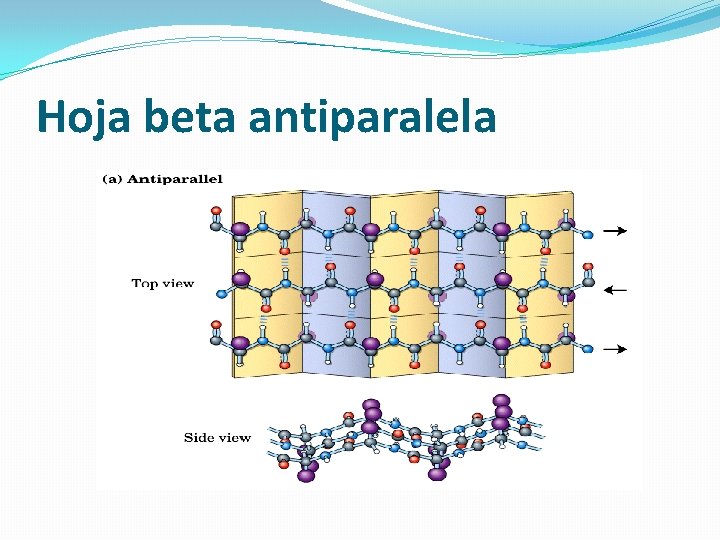
Láminas beta o láminas plegadas �Se forman cuando se alinean de lado dos o más segmentos de cadenas polipeptídicas • Esqueleto de la cadena polipeptídica extendido en zig-zag. • Las cadenas polipeptídicas en zig-zag se disponen de manera adyacente formando una lámina estabilizada por puentes de H. • Láminas beta paralelas (cadenas orientadas en la misma dirección) y antiparalelas (orientadas en direcciones opuestas).


Hoja beta paralela

Hoja beta antiparalela

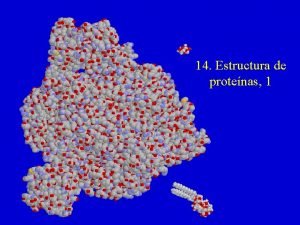
Estructura terciaria Se llama estructura terciaria a la disposición tridimensional de todos los átomos que componen la proteína, concepto equiparable al de conformación absoluta en otra moléculas. La estructura terciaria de una proteína es la responsable directa de sus propiedades biológicas, ya que la disposición espacial de los distintos grupos funcionales determina su interacción con los diversos ligandos. Para las proteínas que constan de una sola cadena polipeptídica (carecen de estructura cuaternaria), la estructura terciaria es la máxima información estructural que se puede obtener

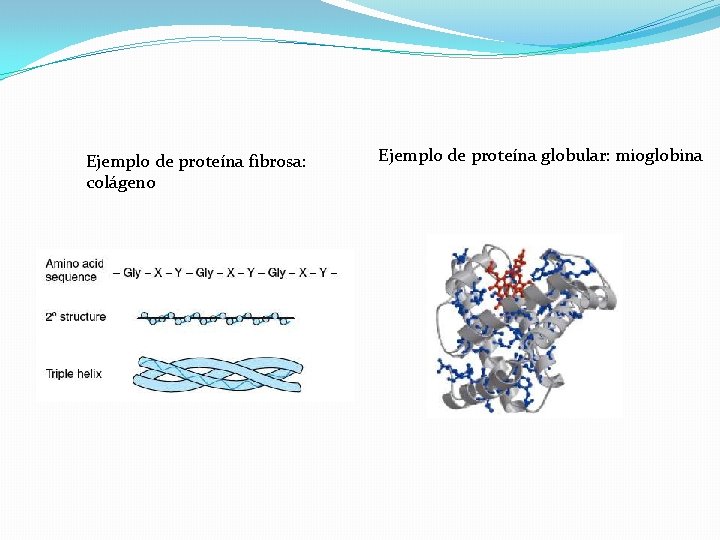
Ejemplo de proteína fibrosa: colágeno Ejemplo de proteína globular: mioglobina

Estructura cuaternaria Es el arreglo tridimensional de las proteínas que poseen más de una cadena polipeptídica. �Son oligoméricas. �Cada cadena se conoce como una subunidad. �Tienen efectos alostéricos: cambio en una subunidad afecta a otra subunidad. Fuerzas que estabilizan la estructura: �puentes de hidrógeno �interacciones hidrofóbicas �interacciones electrostáticas

HEMOGLOBINA �Tetrámero con cuatro grupos heme �Posee dos cadenas alfa (141 AA) y dos cadenas beta (146 AA). �Transporta oxígeno �Estructura cuaternaria �Dos conformaciones: estado R (enlaza O 2) y estado T (deoxi )
 Estructura primaria
Estructura primaria Función de las proteínas estructurales
Función de las proteínas estructurales Función de las proteínas estructurales
Función de las proteínas estructurales Proteinas de defensa
Proteinas de defensa Estructura adhocrática
Estructura adhocrática Language
Language Isomeria de carbohidratos
Isomeria de carbohidratos Nucleo bases curriculares
Nucleo bases curriculares So
So Proteinas simples e conjugadas
Proteinas simples e conjugadas Proteinas funcion en el organismo
Proteinas funcion en el organismo Interacciones que estabilizan la estructura terciaria
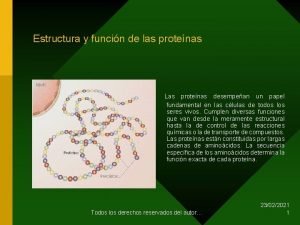
Interacciones que estabilizan la estructura terciaria Protenas
Protenas Protenas
Protenas Protenas
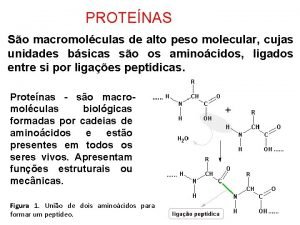
Protenas Enlace peptidico
Enlace peptidico Protenas
Protenas Protenas
Protenas Estructura quimica general de los aminoacidos
Estructura quimica general de los aminoacidos Protenas
Protenas