ISCMH Facultad de Estomatologa TEMA III Ttulo de













- Slides: 34

ISCM-H. Facultad de Estomatología TEMA III Título de la clase: Estructura y función de péptidos y proteínas.

Sumario • Péptidos y proteínas. • Niveles estructurales de las proteínas • Desnaturalización y renaturalización

Objetivo Explicar los aspectos estructurales de las proteínas, así como su relación con la función biológica de las mismas.

Composición elemental de la materia viva - Elementos fundamentales: O, C, H, N, P, S - Otros elementos importantes: Ca, K, Na, Cl, Mg, Fe - Oligoelementos (trazas): Cu, Mn, Co, I, Zn, F

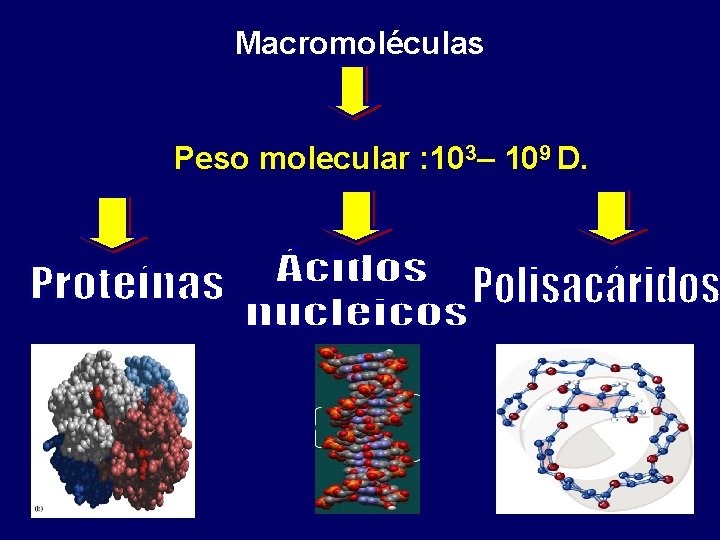
BIOMOLÉCULAS: Moléculas que caracterizan a los organismos vivos. Compuestos orgánicos de carbono que presentan generalmente Oxígeno, Hidrógeno y Nitrógeno y en algunos casos Fósforo y Azufre

Macromoléculas Peso molecular : 103– 109 D.

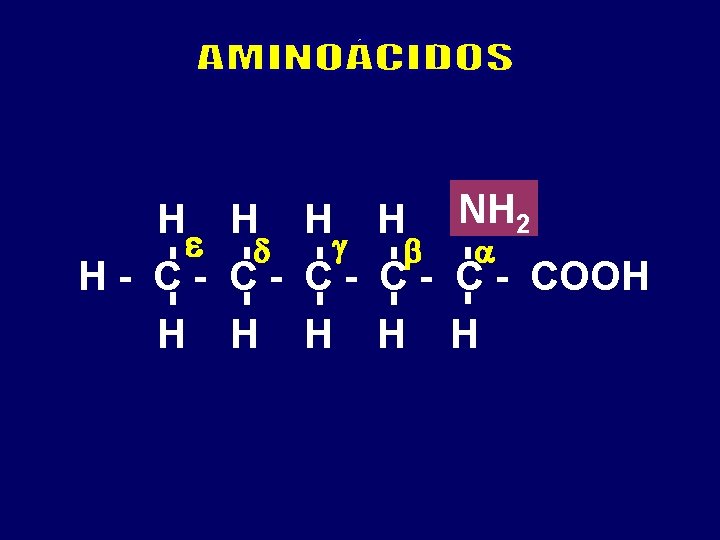
NH 2 H H H H - C - C - COOH H H

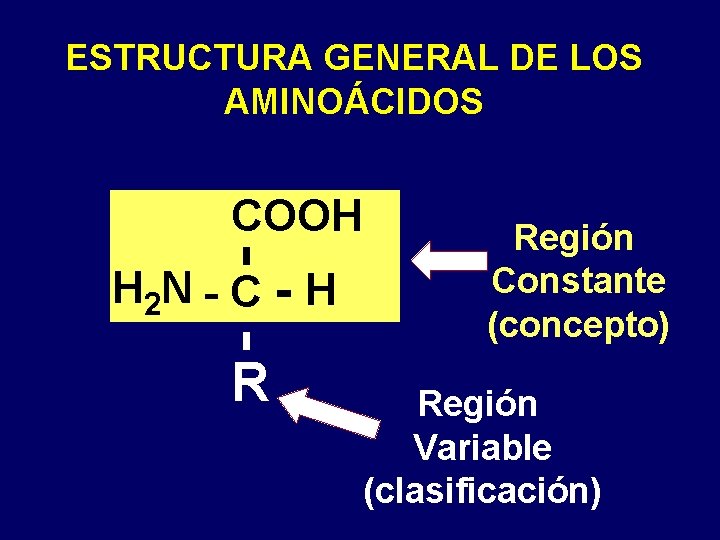
ESTRUCTURA GENERAL DE LOS AMINOÁCIDOS COOH H 2 N - C - H R Región Constante (concepto) Región Variable (clasificación)

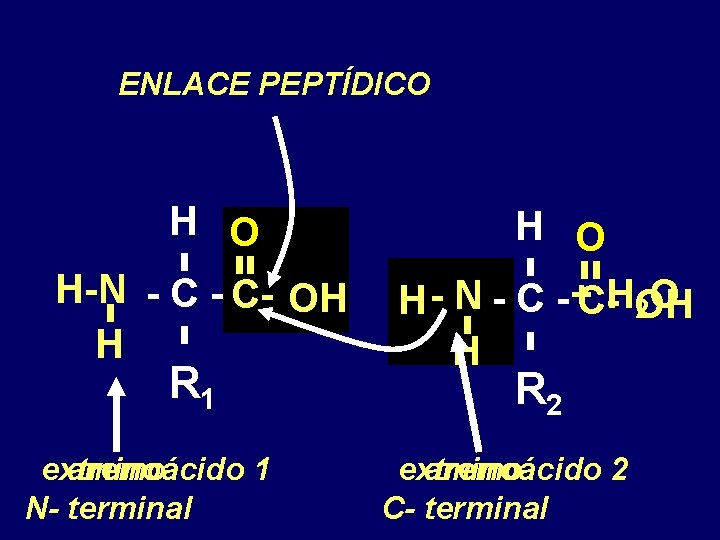
ENLACE PEPTÍDICO H O H-N - C- OH H R 1 extremo aminoácido 1 N- terminal H O H - N - C - +C-HOH 2 O H R 2 extremo aminoácido 2 C- terminal


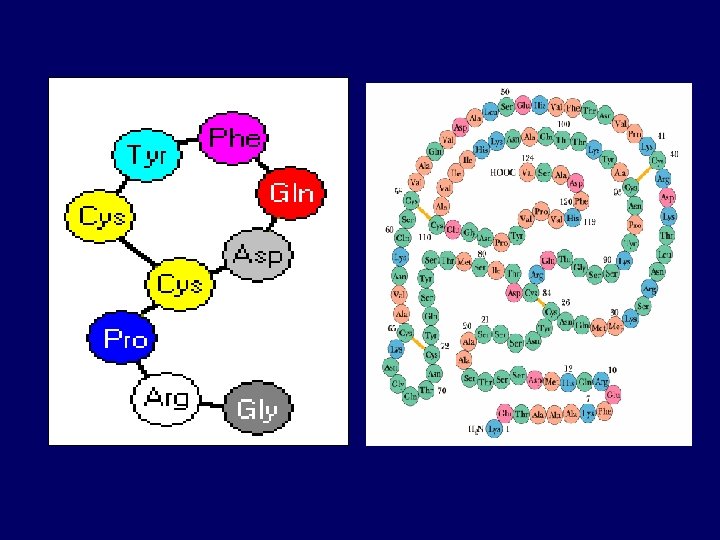
¿Qué distingue a los péptidos de las proteínas?

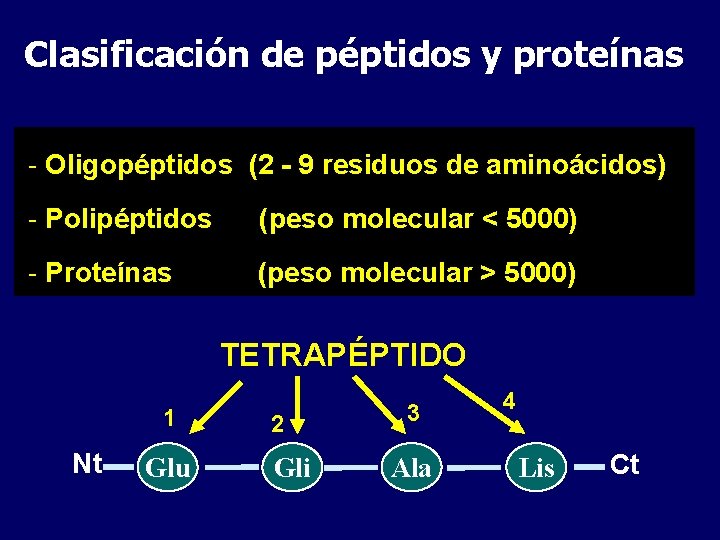
Clasificación de péptidos y proteínas - Oligopéptidos (2 - 9 residuos de aminoácidos) - Polipéptidos (peso molecular < 5000) - Proteínas (peso molecular > 5000) TETRAPÉPTIDO 1 Nt Glu 2 Gli 3 Ala 4 Lis Ct

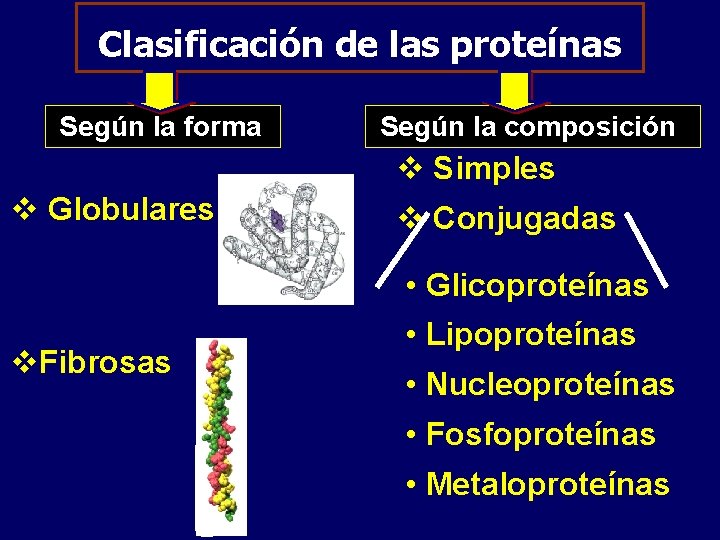
Clasificación de las proteínas Según la forma Según la composición v Simples v Globulares v Conjugadas • Glicoproteínas v. Fibrosas • Lipoproteínas • Nucleoproteínas • Fosfoproteínas • Metaloproteínas

Estudio Independiente • Confeccionar un cuadro sobre las funciones de las proteínas y ejemplos de proteínas que las cumplen.

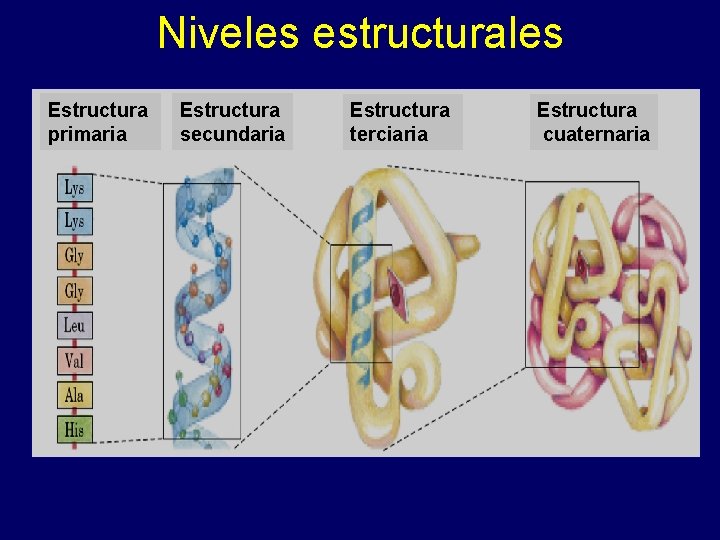
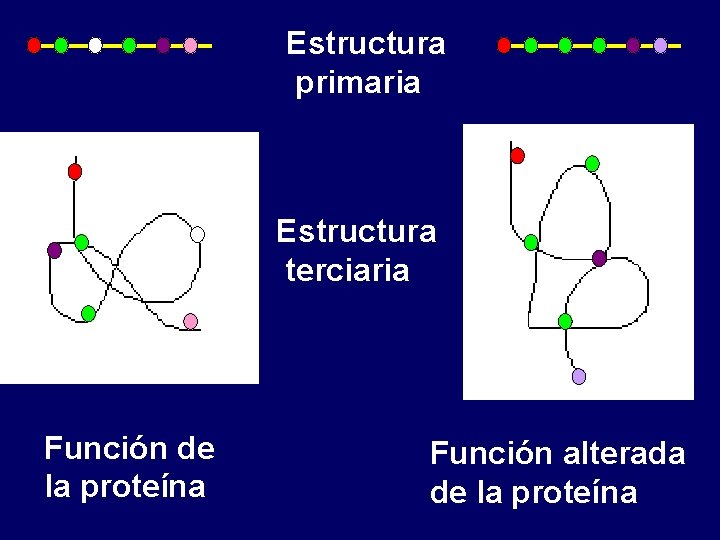
Niveles estructurales Estructura primaria Estructura secundaria Estructura terciaria Estructura cuaternaria

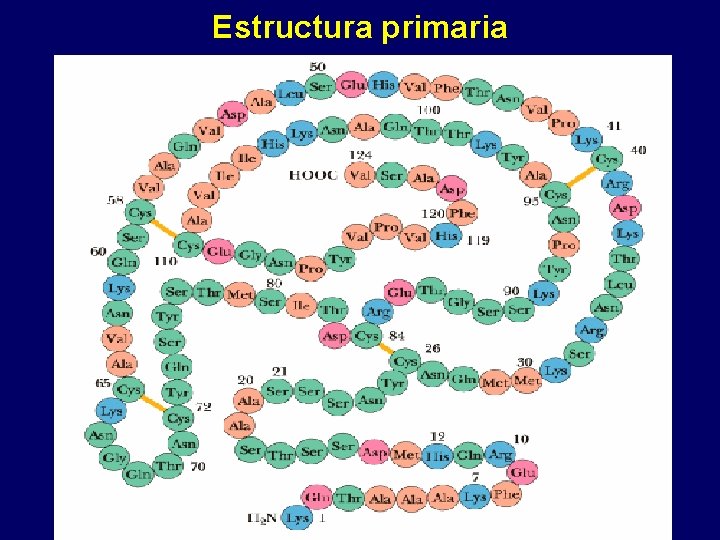
Estructura primaria

Estudio independiente ¿ Tendrán la misma estructura primaria? a)NH 2 Ala-Val-Cis-Asp-Glu-(Gli)100 –Arg-Tir COOH b)NH 2 Ala-Val-Tir-Asp-Glu-(Gli)100 -Arg-Cis COOH

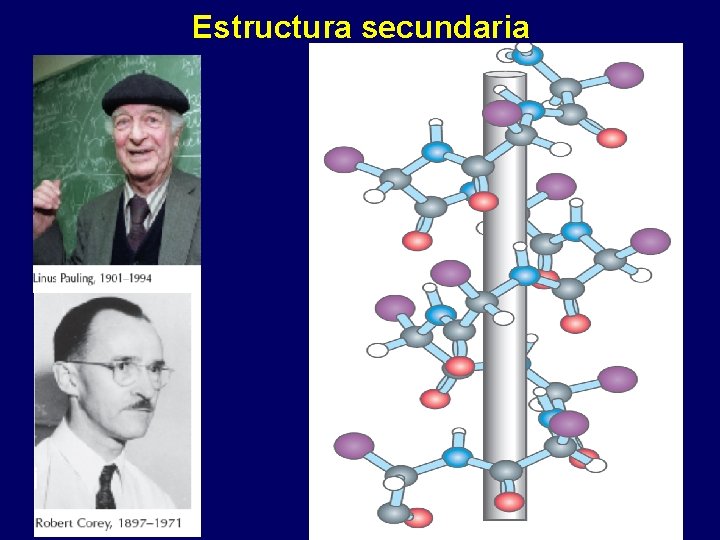
Estructura secundaria

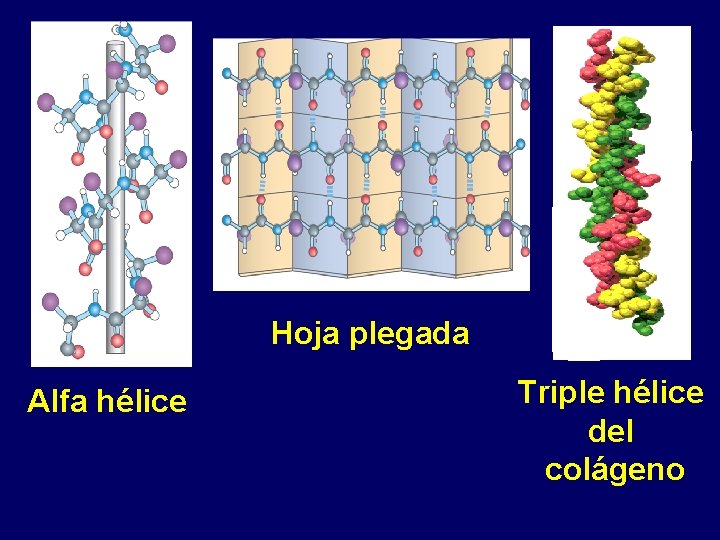
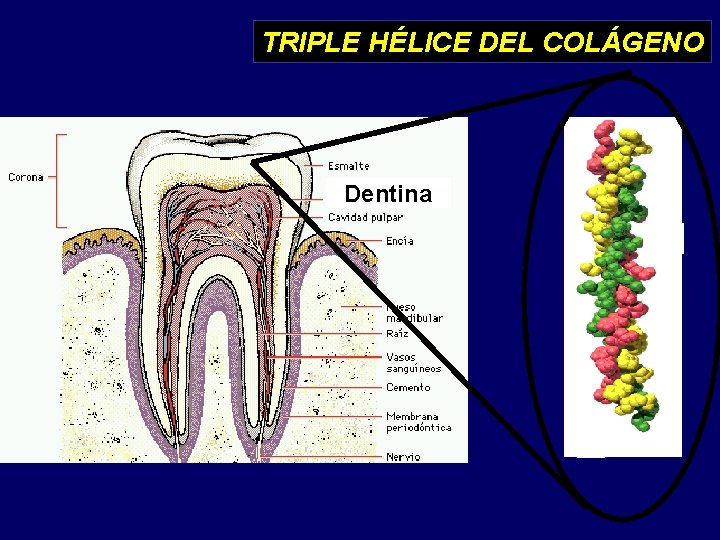
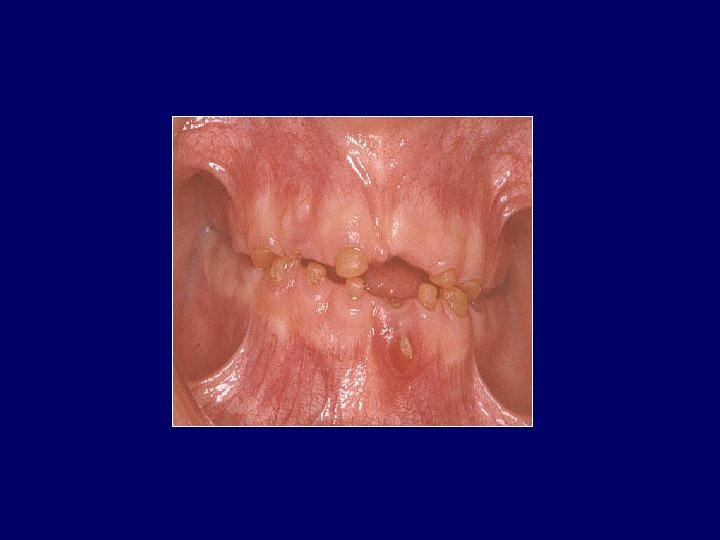
Hoja plegada Alfa hélice Triple hélice del colágeno

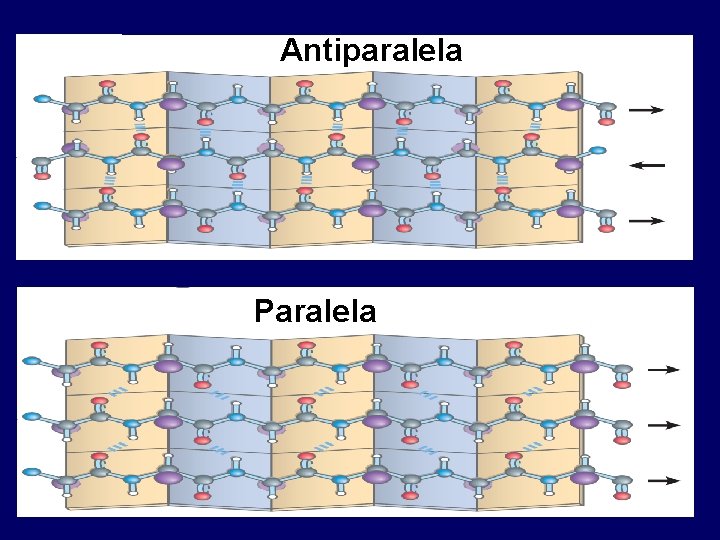
Antiparalela Paralela

TRIPLE HÉLICE DEL COLÁGENO Dentina

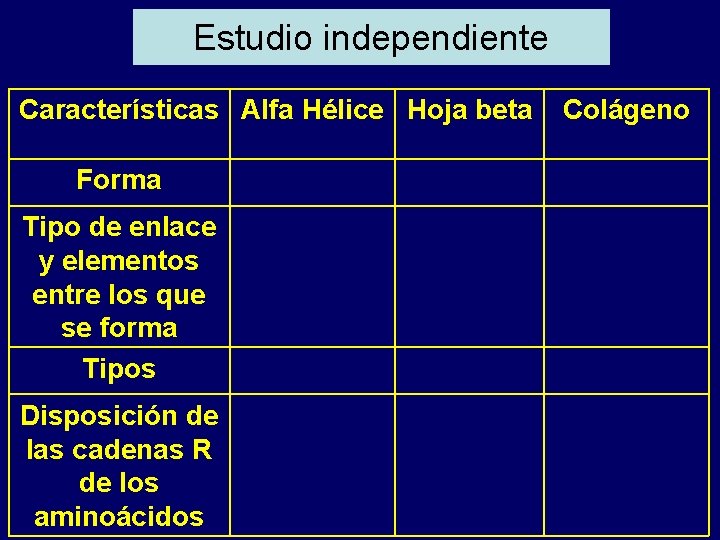
Estudio independiente Características Alfa Hélice Hoja beta Forma Tipo de enlace y elementos entre los que se forma Tipos Disposición de las cadenas R de los aminoácidos Colágeno

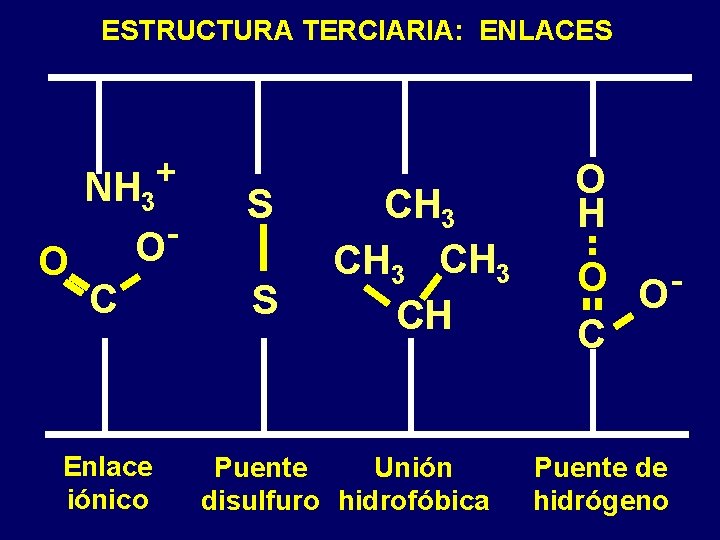
ESTRUCTURA TERCIARIA: ENLACES O + NH 3 O S C S Enlace iónico CH 3 CH Puente Unión disulfuro hidrofóbica O H O OC Puente de hidrógeno


Estructura primaria Estructura terciaria Función de la proteína Función alterada de la proteína

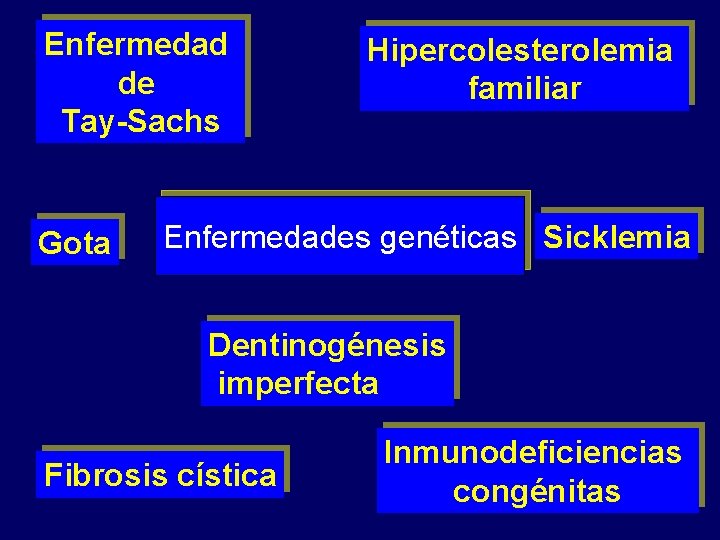
Enfermedad de Tay-Sachs Gota Hipercolesterolemia familiar Enfermedades genéticas Sicklemia Dentinogénesis imperfecta Fibrosis cística Inmunodeficiencias congénitas


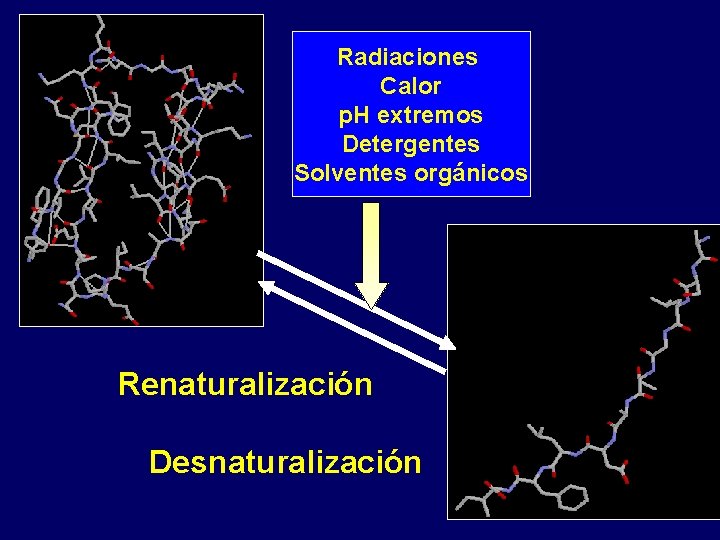
Radiaciones Calor p. H extremos Detergentes Solventes orgánicos Renaturalización Desnaturalización

Aspectos a revisar • Concepto de desnaturalización • Agentes desnaturalizantes: Clasificación y mecanismo de acción • Concepto de renaturalización

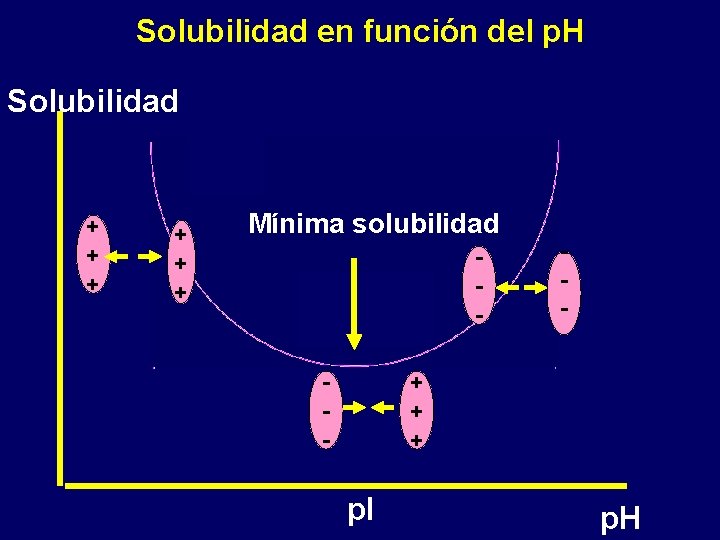
Solubilidad de las proteínas • Sales neutras • p. H • Solventes orgánicos

Solubilidad en función del p. H Solubilidad + + + Mínima solubilidad - - + + + p. I p. H

Conclusiones • La estructura de las proteínas incluye cuatro niveles estructurales: primario, secundario, terciario y cuaternario.

Conclusiones • La desnaturalización consiste en la pérdida de la conformación natural de las proteínas bajo la acción de agentes externos, lo que puede conducir a la pérdida de la función de las mismas.

BIBLIOGRAFÍA • Material complementario sobre aminoácidos y proteínas. • Capítulos sobre Proteínas tomado de Bioquímica Médica. Ubicado en la bibliografía por temas (tema II).