Programa Tcnicas Avanzadas en Qumica 2003 04 Leccin
























- Slides: 43

Programa Técnicas Avanzadas en Química (2003 -04) Lección 1: Principios de Análisis Químico Medioambiental Lección 2: Tratamiento de muestras y Técnicas de Separación de Analitos Lección 3: Técnicas Clásicas de Análisis Químico Lección 4: Técnicas Electroquímicas Lección 5: Técnicas Espectroscópicas Práctica 1: Determinación de fosfatos por espectrofotometría Práctica 2: Determinación de Calcio y Magnesio por complexometría Práctica 3: Determinación de ácidos y bases por valoraciones p. H-métricas Práctica 4: Determinación de materia orgánica en aguas: DQO Práctica 5: Determinación de metales pesados mediante voltametría Práctica 6: Técnicas de extracción de especies químicas de muestras sólidas Práctica 7: Análisis de contaminantes mediante técnicas espectroscópicas

Bibliografía Recomendada Manual de la asignatura: Daniel C. Harris, Análisis Químico Cuantitativo 2ª edición Textos complementarios: K. A. Rubinson, Análisis Instrumental. D. A. Skoog, Principios de Análisis Instrumental C. Baird, Química Ambiental Libros de referencia especializados: R. M. Silverstein, Spectrometric identification organic compounds M. A. H. Frason Métodos normalizados para el análisis de aguas potables y residuales

Evaluación 1. Obligatorio para aprobar: Asistencia obligatoria a todas las prácticas y entrega de los informes de laboratorio dentro del plazo estipulado 2. Calificación - Informes de laboratorio (5 puntos) - Examen Final escrito (5 puntos) El informe de cada práctica se entrega: a) En un plazo máximo de 2 semanas desde la realización de la práctica (1 punto menos por cada día de retraso) b) Puede ser individual o conjuntamente con el compañero con el que se haya trabajado en el Laboratorio. No está permitido repetir compañero más de 2 veces.

Cuaderno de Laboratorio 1. Objetivo (1 párrafo) 2. Metodología, técnica empleada (2 -3 párrafos) 3. Resultados 3. 1 Presentación de las medidas experimentales 3. 2 Análisis y presentación de resultados 4. Discusión CIENTÍFICA 4. 1 Resumen de los resultados y conclusiones del experimento realizado 4. 2 Crítica de la Técnica y metodología empleada

Grupos de Prácticas Grupo M 1 de Teoría de mañana Laboratorio de tarde: Grupos L 5, L 6, L 7, L 8 Grupo T 2 de Teoría de tarde Laboratorio de mañana: Grupos L 1, L 2, L 3, L 4 Comienzo de los Laboratorios: 20 de octubre Material Docente de la Asignatura: http: //www. upo. es/depa/webdex/quimfis/quif. TAQ. html

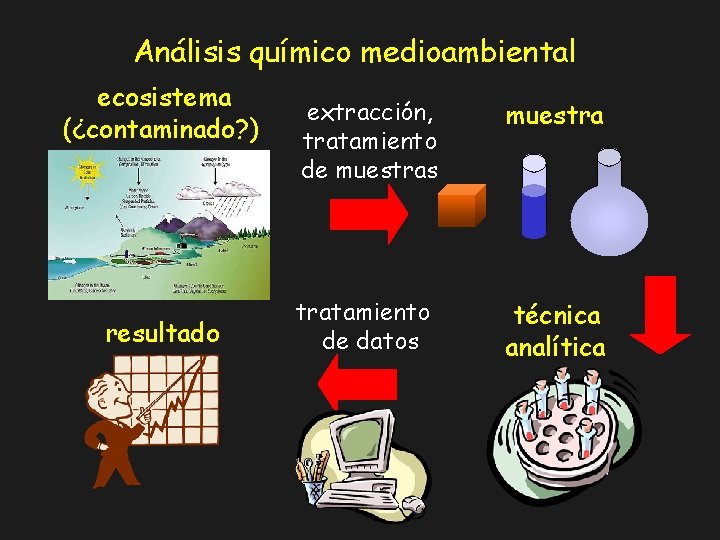
Análisis químico medioambiental ecosistema (¿contaminado? ) resultado extracción, tratamiento de muestras muestra tratamiento de datos técnica analítica

Método experimental y precisión de la técnica esencial para el análisis e interpretación Calentamiento global ¿mito o realidad?

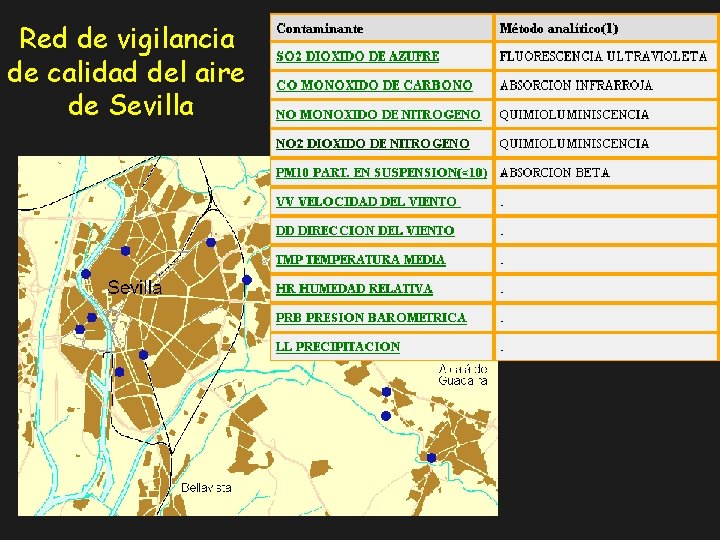
Red de vigilancia Medioambiental de la Junta de Andalucía http: //www. juntadeandalucia. es/medioambiente

Red de vigilancia de calidad del aire de Sevilla

Detección de NOx: quimiluminiscencia Problema de los NOx: ozono troposférico NO 2 + hn NO + O(1 D) mg/m 3 O(1 D) + O 2 O 3 Normativa (2010): NO 2 < 200 mg/m 3 Detección de NO 2 + hn NO + O(1 D) (fotólisis) O 3 + NO 2* + O 2 (reacción) NO 2* NO 2 + hn (quimiluminiscencia)

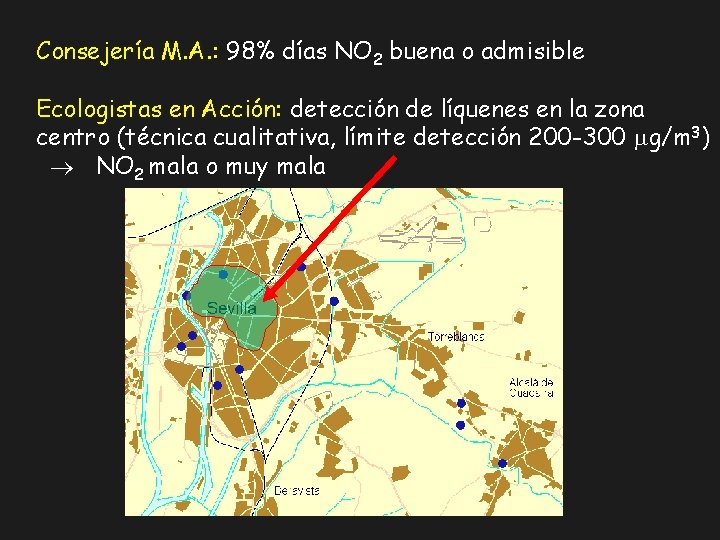
Consejería M. A. : 98% días NO 2 buena o admisible Ecologistas en Acción: detección de líquenes en la zona centro (técnica cualitativa, límite detección 200 -300 mg/m 3) NO 2 mala o muy mala

Planteamiento del problema Definir la información que se necesita Análisis cualitativo: ¿hay tal contaminante? Análisis cuantitativo: ¿en qué concentración? Especiación: ¿en qué forma química? Ejemplo: Detección de arsénico en un suelo Análisis cualitativo: el suelo contiene arsénico en una concentración superior a la sensibilidad de la técnica experimental [As] > 0. 1 g/m 3 Análisis cuantitativo: [As] = 2. 5 0. 2 g/m 3 Especiación: arsenito [As 3+] = 2. 0 0. 1 g/m 3 arsenato [As 5+] = 0. 5 0. 1 g/m 3

Elección de la técnica experimental Tipo de análisis a realizar: cualitativo, cuantitativo o especiación Límite de detección: concentración mínima detectable Precisión: error experimental requerido Especificidad: ¿sensible sólo al analito de interés? ¿interferencias de otras especies o de la matriz? Tipo y cantidad de muestra necesaria para aplicar la técnica. ¿Se requiere pretratamiento? Otros: precio, rapidez, residuos que produce, . . .

Concentración de un analito Molaridad: moles analito/ litro disolución Molalidad: moles analito/ kg disolvente % en peso: kg analito/ kg disolvente (x 100) p. H, escalas logarítmicas: p[C] = -log[C] ppm, ppb, ppt : partes por millón, billón, trillón millón: 106, billón: 109, trillón: 1012 masa/masa volumen/volumen masa/volumen ppm mg/g ml/l mg/l ppb ng/g nl/l mg/l ppt pg/g pl/l ng/l

Clasificación de los componentes de una muestra Mayoritarios: C = 1 – 100 % peso (o volumen) Minoritarios: C = 0. 01 – 1 % Traza: C < 0. 01% = 100 ppm Ultratraza: C < 1 ppb 1 ppm = 1 gota en 50 litros 1 ppt = 1 gota en una piscina olímpica

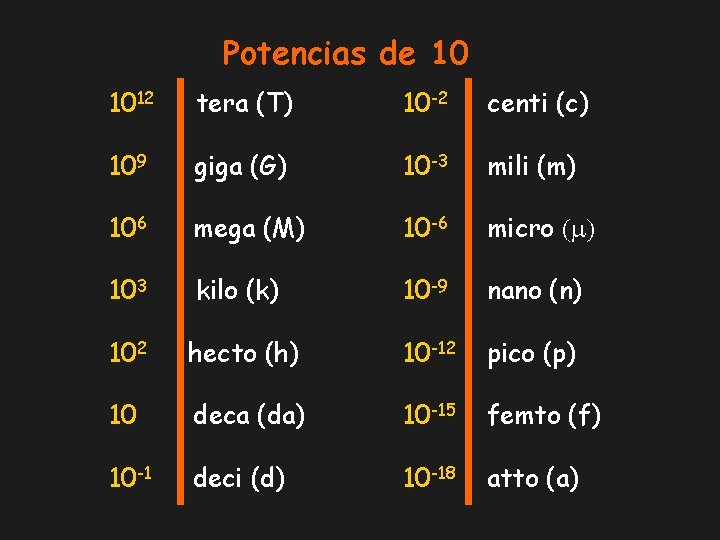
Potencias de 10 1012 tera (T) 10 -2 centi (c) 109 giga (G) 10 -3 mili (m) 106 mega (M) 10 -6 micro (m) 103 kilo (k) 10 -9 nano (n) 102 hecto (h) 10 -12 pico (p) 10 deca (da) 10 -15 femto (f) 10 -1 deci (d) 10 -18 atto (a)

Incertidumbre de las medidas experimentales Resultado = ( media error ) unidades Ejemplo: medidas de concentración de arsénico error absoluto A C = [As] = (0. 024 0. 006) ppm error relativo R = A/media x 100 (porcentaje) C = 0. 024 ppm 25% El valor real de C se encuentra en el intervalo media error con una probabilidad del 95%.

Expresión numérica de resultados experimentales Resultado = ( media error ) unidades Ejemplo: medidas de concentración de arsénico datos “crudos” C = 0. 024435 ppm A = 0. 006123 ppm error absoluto: una sola cifra significativa media: última cifra la afectada por el error C = (0. 024 0. 006) ppm (bien) C = (0. 024435 0. 006123) ppm (fatal, suspenso) C = (2. 4 0. 6) 10 -2 ppm (bien) C = (2. 4 10 -2 6 10 -3 ) ppm (mal)

Algunos casos particulares de redondeo Redondeo al alza y a la baja = 0. 006123 ppm = 0. 006 ppm C = 0. 024435 ppm C = 0. 024 ppm C = 0. 024535 ppm C = 0. 025 ppm Redondeo del error a dos cifras = 0. 0016369 ppm = 0. 0016 ppm C = 0. 0242435 ppm C = 0. 0242 ppm C = (2. 42 0. 16) 10 -2 ppm o bien C = (2. 4 0. 2) 10 -2 ppm

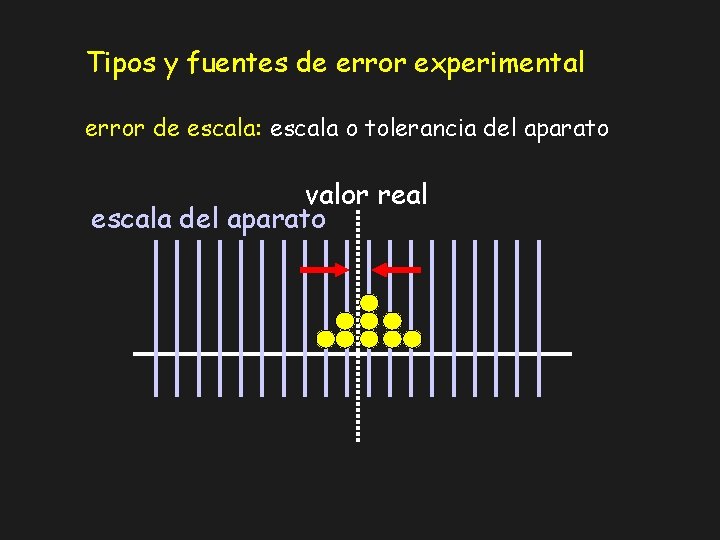
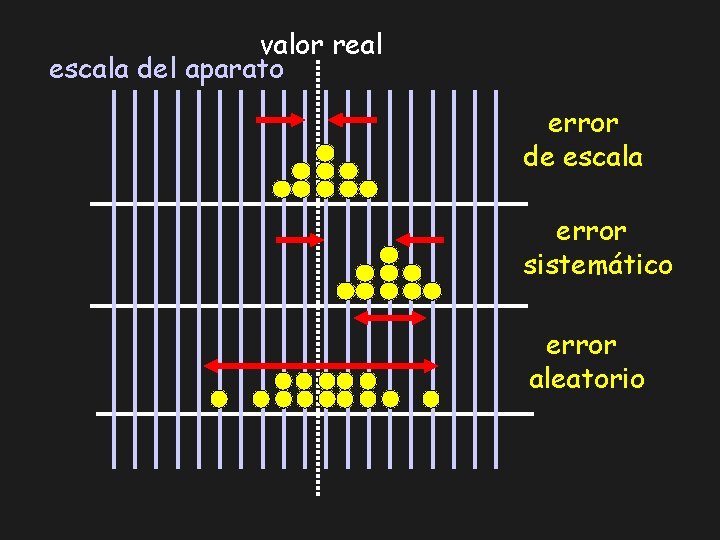
Tipos y fuentes de error experimental error de escala: escala o tolerancia del aparato valor real escala del aparato

Tipos y fuentes de error experimental errores sistemáticos: errores controlados e iguales en medidas realizadas bajo las mismas condiciones Pueden ser proporcionales a la cantidad de muestra Ejemplos: Error de calibración del aparato Incertidumbre en algún parámetro exptal. Interferencia con la matriz o con alguna otra especie química de la muestra valor real

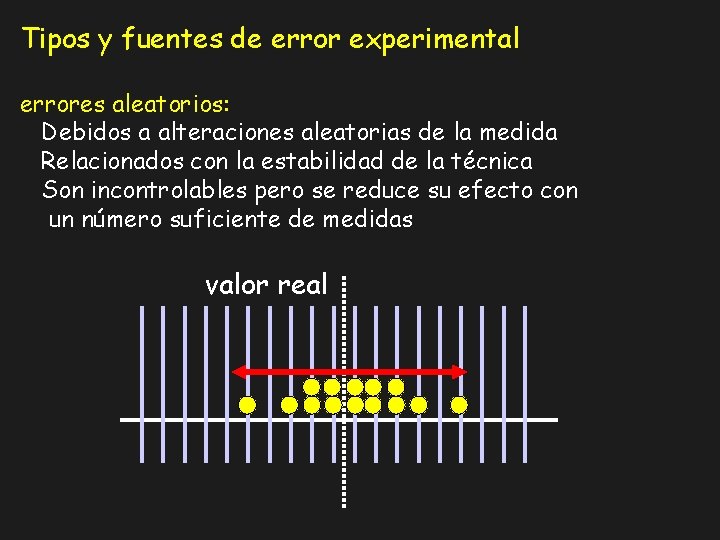
Tipos y fuentes de error experimental errores aleatorios: Debidos a alteraciones aleatorias de la medida Relacionados con la estabilidad de la técnica Son incontrolables pero se reduce su efecto con un número suficiente de medidas valor real

valor real escala del aparato error de escala error sistemático error aleatorio

Algunos parámetros de calidad de una técnica Propiedad parámetro de calidad Precisión desviación estándar, s (caracteriza la dispersión de las medidas) Sesgo o exactitud desviación de la media de las medidas sobre el valor real de un patrón conocido x – xreal Sensibilidad variación de la señal frente a cambios de concentración del analito S/ C. Se toma como parámetro el cociente de este valor con la desviación estándar: g = ( S/ C)/s Intervalo de respuesta lineal: proporcionalidad entre la señal y la concentración de contaminante

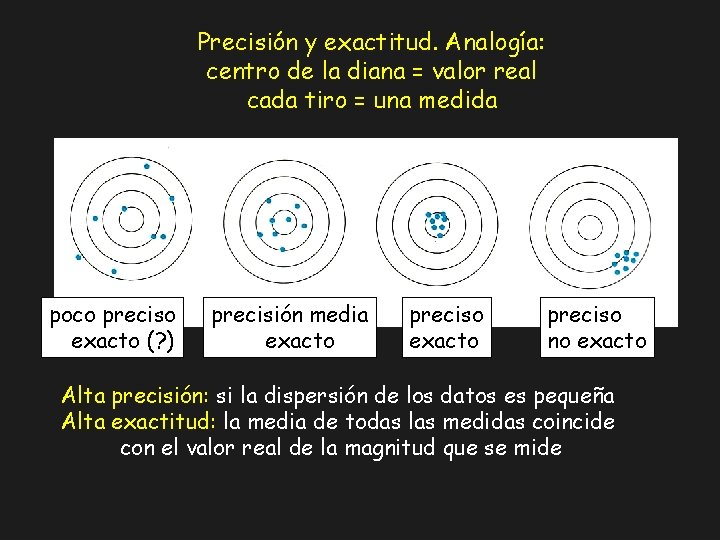
Precisión y exactitud. Analogía: centro de la diana = valor real cada tiro = una medida poco preciso exacto (? ) precisión media exacto preciso no exacto Alta precisión: si la dispersión de los datos es pequeña Alta exactitud: la media de todas las medidas coincide con el valor real de la magnitud que se mide

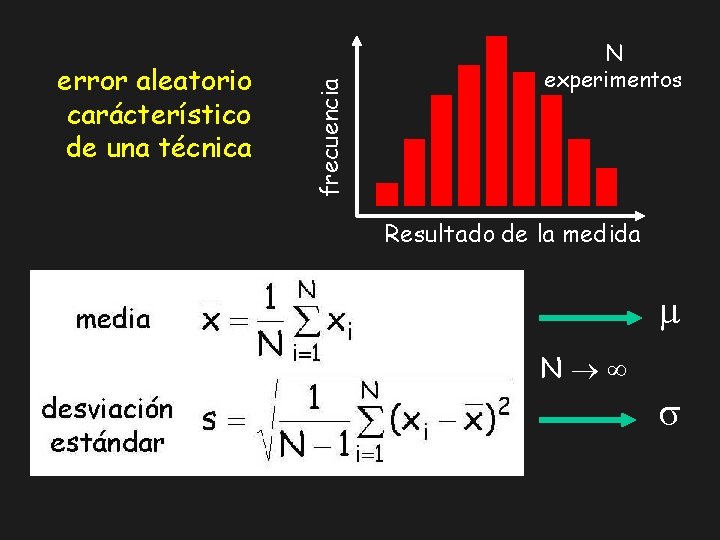
errores aleatorios frecuencia 5 experimentos 40 experimentos 10 experimentos frecuencia N experimentos valor medido (ppm)

valor medio m s 2 s

frecuencia error aleatorio carácterístico de una técnica N experimentos Resultado de la medida m N s

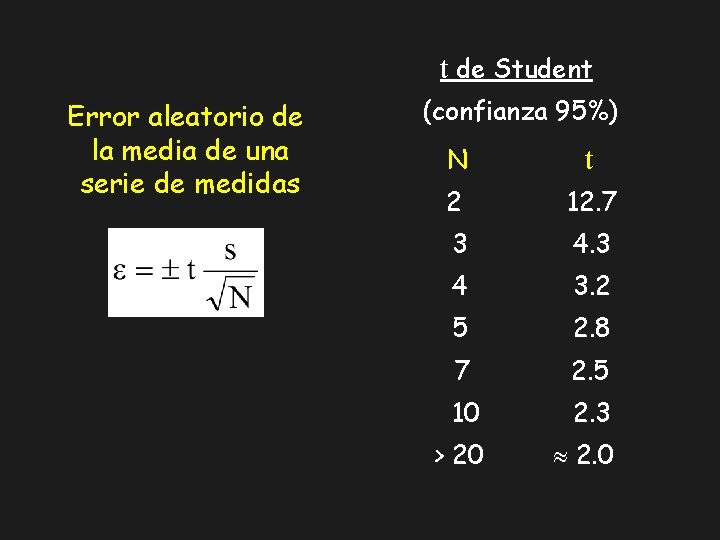
t de Student Error aleatorio de la media de una serie de medidas (confianza 95%) N t 2 12. 7 3 4 3. 2 5 2. 8 7 2. 5 10 2. 3 > 20 2. 0

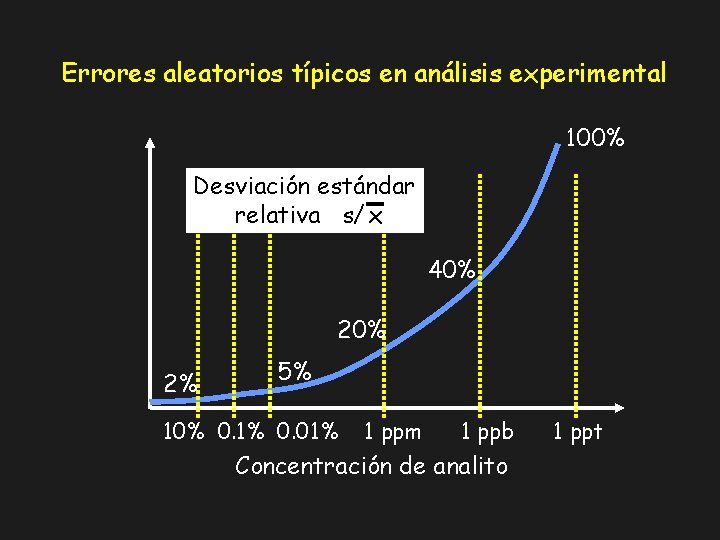
Errores aleatorios típicos en análisis experimental 100% Desviación estándar relativa s/ x 40% 2% 5% 10% 0. 1% 0. 01% 1 ppm 1 ppb Concentración de analito 1 ppt

Propagación de errores ejemplos A= f(x, y, z, . . ) A= ¿? x x, y y , z z conocidos

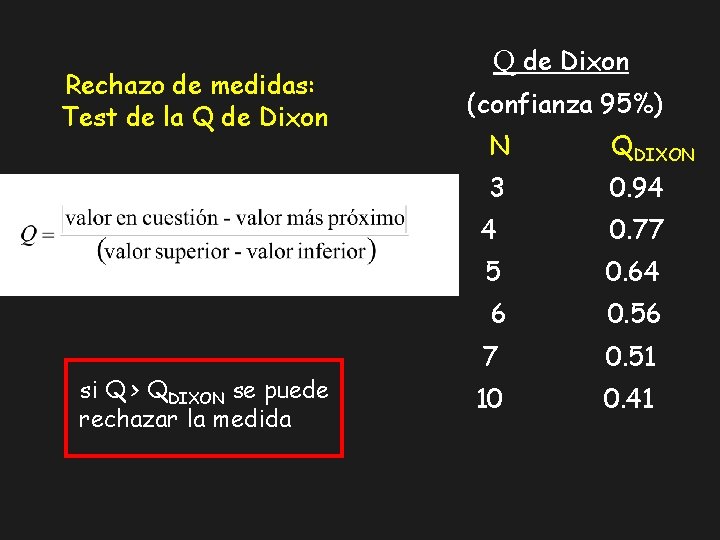
Rechazo de medidas: Test de la Q de Dixon si Q > QDIXON se puede rechazar la medida Q de Dixon (confianza 95%) N QDIXON 3 0. 94 4 0. 77 5 0. 64 6 0. 56 7 0. 51 10 0. 41

Comparación de 2 técnicas de análisis: Técnica 1: N 1 medidas, media x 1, desviación s 1 Técnica 2: N 2 medidas, media x 2, desviación s 2 si ttest < t-Student para N 1+N 2 -2 medidas, Los resultados de ambas técnicas son consistentes

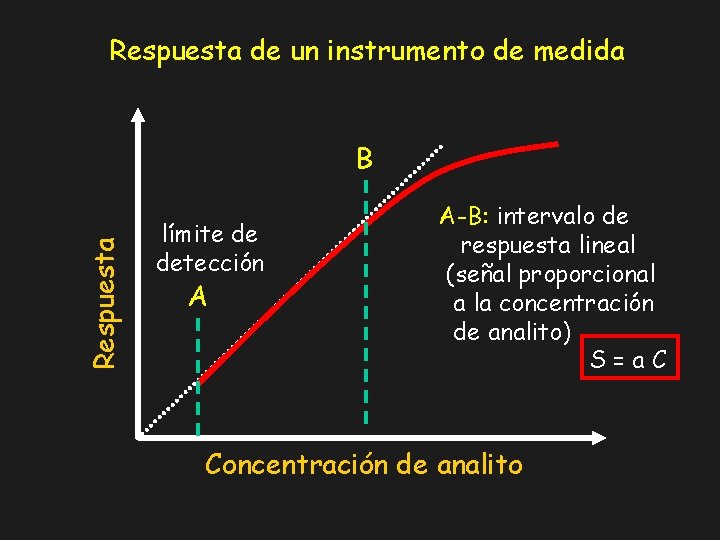
Respuesta de un instrumento de medida Respuesta B límite de detección A A-B: intervalo de respuesta lineal (señal proporcional a la concentración de analito) S=a. C Concentración de analito

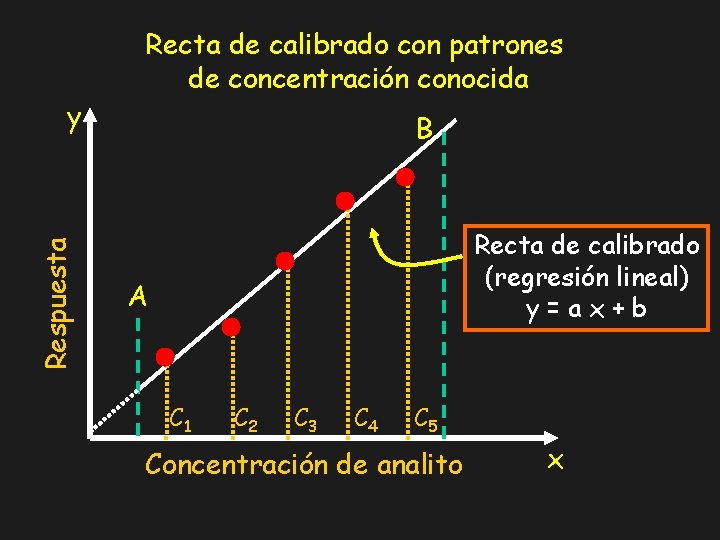
Respuesta y Recta de calibrado con patrones de concentración conocida B Recta de calibrado (regresión lineal) y=ax+b A C 1 C 2 C 3 C 4 C 5 Concentración de analito x

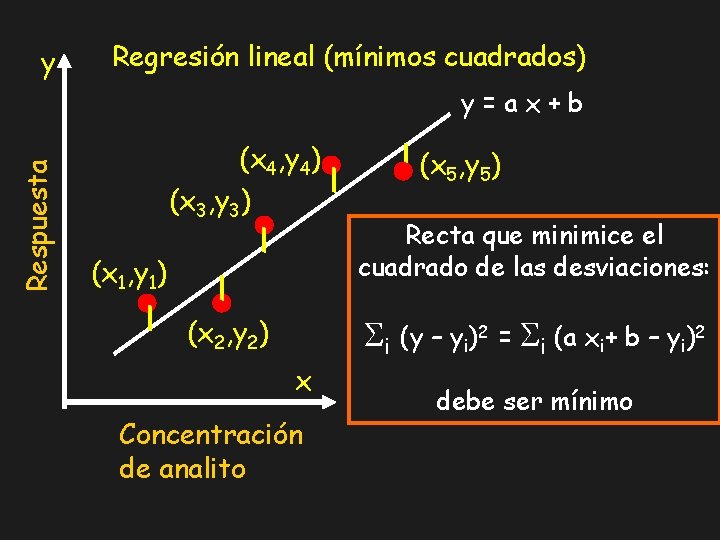
y Regresión lineal (mínimos cuadrados) Respuesta y=ax+b (x 4, y 4) (x 3, y 3) (x 1, y 1) (x 2, y 2) x Concentración de analito (x 5, y 5) Recta que minimice el cuadrado de las desviaciones: i (y – yi)2 = i (a xi+ b – yi)2 debe ser mínimo

Regresión lineal: y = (a a) x + (b b) coeficiente de correlación definiciones

ejemplos de regresiones lineales coef. de correlación 0. 98 señal coef. de correlación 0. 995 coef. de correlación 0. 90 concentración

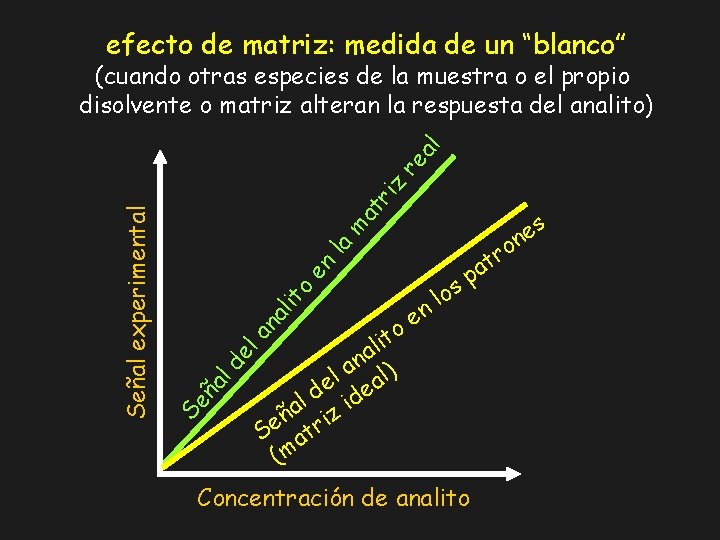
efecto de matriz: medida de un “blanco” ri z at m la en o it al n e o a p los t i l a n a l) l e ea d l id a ñ riz e S at (m an s e n o r t el ld ña Se Señal experimental re a l (cuando otras especies de la muestra o el propio disolvente o matriz alteran la respuesta del analito) Concentración de analito

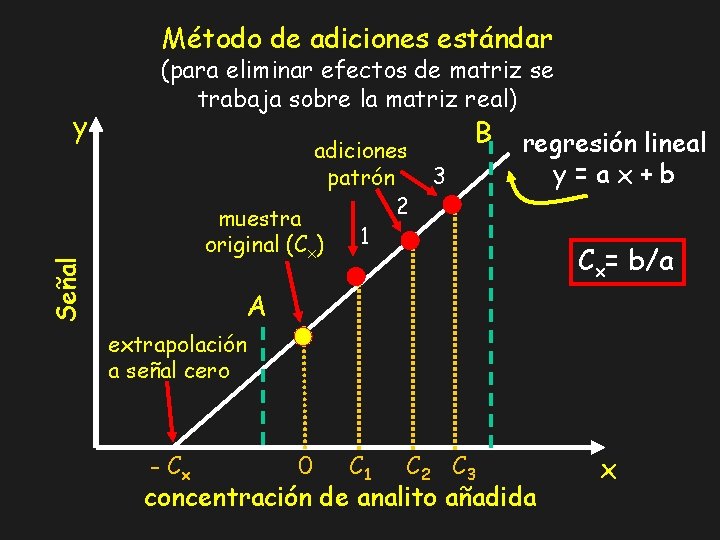
Método de adiciones estándar adiciones patrón 2 muestra 1 original (C ) B 3 regresión lineal y=ax+b x Señal y (para eliminar efectos de matriz se trabaja sobre la matriz real) Cx= b/a A extrapolación a señal cero - Cx 0 C 1 C 2 C 3 concentración de analito añadida x

Método de adiciones estándar (para eliminar efectos de matriz) En el intervalo de respuesta lineal la señal es proporcional a la concentración de analito S = k (Cs + Cx) Cs: concentración añadida Cx: concentración inicial relación lineal S vs. Cs: y = a x + b con y = S , x = Cs a = k, b = k Cx b/a = Cx Cx se puede obtener gráficamente extrapolando la recta de adiciones estándar a señal nula (y = 0) y = 0 = a x + b x = - b/a = - Cx

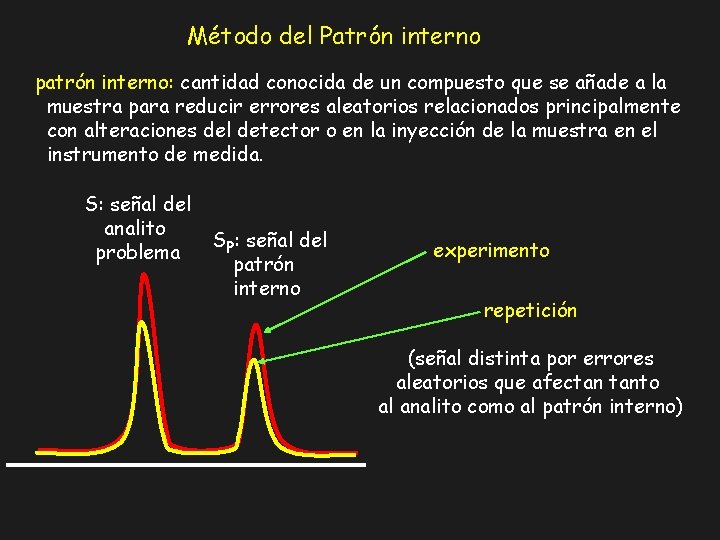
Método del Patrón interno patrón interno: cantidad conocida de un compuesto que se añade a la muestra para reducir errores aleatorios relacionados principalmente con alteraciones del detector o en la inyección de la muestra en el instrumento de medida. S: señal del analito problema SP: señal del patrón interno experimento repetición (señal distinta por errores aleatorios que afectan tanto al analito como al patrón interno)

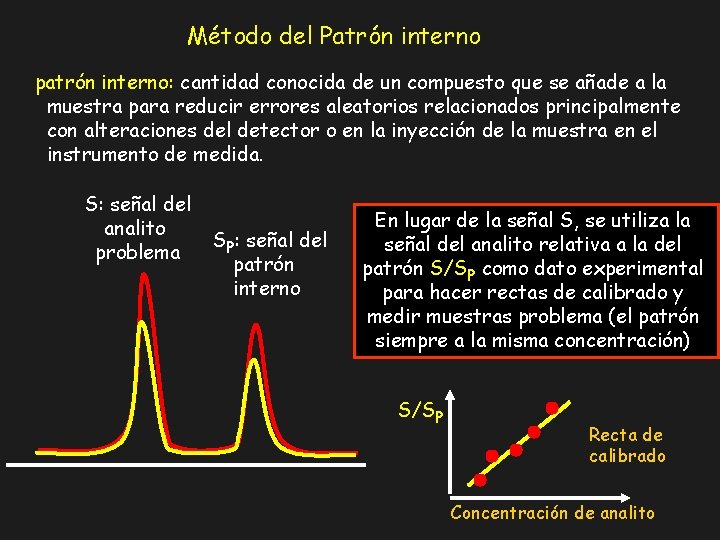
Método del Patrón interno patrón interno: cantidad conocida de un compuesto que se añade a la muestra para reducir errores aleatorios relacionados principalmente con alteraciones del detector o en la inyección de la muestra en el instrumento de medida. S: señal del analito problema SP: señal del patrón interno En lugar de la señal S, se utiliza la señal del analito relativa a la del patrón S/SP como dato experimental para hacer rectas de calibrado y medir muestras problema (el patrón siempre a la misma concentración) S/SP Recta de calibrado Concentración de analito
 Tcnicas de estudio
Tcnicas de estudio Que es lser
Que es lser Tcnicas
Tcnicas Tcnicas de estudio
Tcnicas de estudio Tcnicas de estudio
Tcnicas de estudio Actividades avanzadas de la vida diaria del adulto mayor
Actividades avanzadas de la vida diaria del adulto mayor Nodos hoja
Nodos hoja Herramientas avanzadas de software de aplicación
Herramientas avanzadas de software de aplicación Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin Decir subjunctive imperfect
Decir subjunctive imperfect Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin 1. te dan una pelota de fútbol si vas ahora.
1. te dan una pelota de fútbol si vas ahora. Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin Todo acerca de mi
Todo acerca de mi![(you [form., sing.] left) aquí la radiografía. (you [form., sing.] left) aquí la radiografía.](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%20200%20200%22%3E%3C/svg%3E) (you [form., sing.] left) aquí la radiografía.
(you [form., sing.] left) aquí la radiografía. Tener preterite
Tener preterite Leccin
Leccin Reação endergônica
Reação endergônica Qumica
Qumica Qumica
Qumica Reacciones de los halogenuros de alquilo
Reacciones de los halogenuros de alquilo Energia en los enlaces quimicos
Energia en los enlaces quimicos Qumica
Qumica O que são açucares redutores
O que são açucares redutores Qumica
Qumica Qumica
Qumica Clivagem oxidativa de alcenos
Clivagem oxidativa de alcenos Qumica
Qumica Caracteristicas dos seres vivos composição quimica
Caracteristicas dos seres vivos composição quimica Livresq
Livresq Que estudia la quimica aplicada
Que estudia la quimica aplicada Entalpia
Entalpia

























![(you [form., sing.] left) aquí la radiografía. (you [form., sing.] left) aquí la radiografía.](https://slidetodoc.com/wp-content/uploads/2020/12/2869291_b74ccaebd8876676efceeaa1f1a8fa04-300x225.jpg)








































