PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA Convegno NADIR

































































- Slides: 65

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA Convegno NADIR Roma 12 ottobre 2003 Dr Patrizia Villa Schering -Plough

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA CLASSIFICAZIONE DEGLI STUDI CLINICI in base al tipo di autorizzazione • • Studi di fase I (farmaci di nuova istituzione) Studi di fase II-IV Studi non interventistici (o osservazionali) Expanded access (o uso compassionevole) 2

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA RIFERIMENTI NORMATIVI(1) • Decreto Ministeriale 28 luglio 1977 e 28 agosto 1977 - DPR 21/9/1994 n. 754 Art 1 comma 1 lettera C • Decreto Presidente della Repubblica 21 settembre 2001 – Regolamento di semplificazioni delle procedure per la verifica e il controllo di nuovi sistemi e protocolli terapeutici sperimentali - • Decreto ISS 26 aprile 2002 (GU n. 105 del 7 maggio 2002) – Documentazione da presentare all’ISS per l’autorizzazione alla sperimentazione clinica di fase I 3

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA RIFERIMENTI NORMATIVI(2) • Decreto Ministeriale 15 Luglio 1997 Buone Pratiche di Sperimentazione Clinica 4

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA RIFERIMENTI NORMATIVI(2) Decreti Ministeriali • 18 Marzo 1998 - Modalità per l’esenzione dagli accertamenti sui medicinali utilizzati nelle sperimentazioni cliniche • 18 marzo 1998 - linee guida per l’istituzione dei Comitati Etici • 19 Marzo 1998 - Riconoscimento della idoneità dei centri per la sperimentazione clinica dei medicinali 5

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA RIFERIMENTI NORMATIVI(3) • Guidelines emanate dall’Istituto Superiore di Sanità per la sperimentazione clinica di medicinali per terapia genica • Decreto Ministeriale 20 gennaio 1999 Rischi di TSE connessi all’uso di medicinali • Circolare esplicativa n. 6 dell’aprile 1999 sui decreti del 18 -19 marzo 1998 6

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA RIFERIMENTI NORMATIVI(3) • Decreto Ministeriale 25 maggio 2000 Creazione dell’Osservatorio nazionale sulla sperimentazione clinica • Circolare n. 15 del 5 ottobre 2000 Modalità di presentazione e contenuto della domanda di autorizzazione alla sperimentazione clinica di medicinali 7

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA RIFERIMENTI NORMATIVI(3) • Decreto Ministeriale del 10 maggio 2001 Sperimentazioni cliniche controllate condotte da medici di medicina generale e pediatri di libera scelta • Circolare n. 6 del 2 settembre 2002 – Attività dei comitati etici. Studi osservazionali • Decreto Ministeriale 8 maggio 2003 - Uso terapeutico di un medicinale sottoposto a sperimentazioni clinica 8

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA RIFERIMENTI NORMATIVI(3) • Decreto Legislativo n. 211 del 24 giugno 2003 – Attuazione della direttiva 2001/20/CE relativa all’applicazione della buona pratica clinica nell’esecuzione delle sperimentazioni di medicinali per uso clinico 8/1

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO MAI UTILIZZATO NELL’UOMO(1) • Competenza per valutazione: Istituto Superiore di Sanità (DPR n 754 del 1994) Commissione per il comma C • Documentazione: Come previsto negli allegati al decreto dell’ISS 26 aprile 2002. • Rilascio dell’autorizzazione: ISS Per protocolli su pazienti (Ca, AIDS), il parere è relativo solo all’ammissibilità della sperimentazione sulla base della documentazione disponibile 9

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO MAI UTILIZZATO NELL’UOMO(2) Procedura per l’autorizzazione: • Domanda dello sponsor in parallelo all’Istituto Superiore di Sanità(ISS) e al Ministero della Salute • Trasmissione al solo ISS della documentazione e dei campioni per analisi (se richiesti) • Tempi: 60 gg (sospesi in caso di richiesta di documentazione aggiuntiva) +30 gg in casi particolari 10

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO MAI UTILIZZATO NELL’UOMO(3) Documentazione: 1. CHIMICA FARMACEUTICA • composizione quali - quantitativa • caratteristiche chimiche, chimico-fisiche e tecnologiche dei principi attivi e degli eccipienti • metodiche analitiche atte a determinare il principio attivo e, (se necessario), gli eccipienti • grado di purezza della materia prima, eventuali impurezze o prodotti di degradazione 11

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO MAI UTILIZZATO NELL’UOMO(4) Documentazione: 1. CHIMICA FARMACEUTICA materiale per analisi (solo su richiesta) 12

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO MAI UTILIZZATO NELL’UOMO(5) Documentazione: 2. PRECLINICA 2. a tossicologia (determina i tempi max di esposizione per l’uomo) • tossicità acuta • tossicità sub-acuta • azione mutagena (test su batteri o microorganismi eucarioti - test di riparazione del DNA) 13

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO MAI UTILIZZATO NELL’UOMO(6) Documentazione: 2. PRECLINICA 2. b farmacologia • dati sull’effetto farmacologico principale • meccanismo d’azione(se disponibile) • effetti su organi od apparati “non target” • studio delle interazioni (associazioni) 14

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO MAI UTILIZZATO NELL’UOMO(7) Documentazione: 2. PRECLINICA 2. c farmacocinetica: studi dopo sia somministrazione singola che ripetuta tenendo conto della via di somministrazione prevista nell’uomo 15

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO MAI UTILIZZATO NELL’UOMO(8) Documentazione: 3. CLINICA • Piano di sviluppo clinico con relativi protocolli di sperimentazione di fase I (anche in forma sinottica) 16

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(1) • Applicazione del DM 18 marzo 1998 “Modalità per l’esenzione dagli accertamenti sui medicinali utilizzati nelle sperimentazioni cliniche” A partire dall’ 1/1/04 è superato dalla direttiva EU 17

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(2) • Competenza per valutazione: Comitato etico del centro Coordinatore italiano • Documentazione: Allegati alla Circolare n. 15 Ottobre 2000 • Rilascio autorizzazione: Comitato etico del centro Coordinatore 18

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(3) DM 18. 3. 98 - Campo di applicazione • Medicinali già in commercio in uno degli Stati della Comunità Europea, Canada, USA, Nuova Zelanda, Australia • Medicinali già utilizzati nell’uomo in fasi di sperimentazione precedenti • medicinali già autorizzati alla sperimentazione da un organismo centrale di uno degli stati suddetti 19

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(4) assunto che: • Le indicazioni, la posologia e la via di somministrazione siano le stesse; se diverse devono essere supportate da dati di fase I/II • in caso di associazione il rapporto quantitativo tra i principi attivi sia lo stesso • eccipienti anche diversi purché già usati nell’uomo 20

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO (5) DM 18. 3. 98 – Procedura (1) • Domanda al centro prescelto (in caso di sperimentazione monocentrica) • Domanda al centro coordinatore( in caso di sperimentazione policentrica) • Tempi per l’ottenimento del giudizio di notorietà: 60 + 30 giorni 21

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(6) DM 18. 3. 98 - Procedura (2) Contenuto della domanda* • Dichiarazione dello sponsor che il medicinali ha i requisiti per l’esenzione • Dichiarazione relativa al rischio di TSE • Assunzione di responsabilità per budget farmacovigilanza, assicurazione e rispetto delle GCP *come da Circolare 15 dell’ottobre 2000 22

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(7) DM 18. 3. 98 - Procedura (3) Contenuto della domanda (con’t) • Investigator’s Brochure • Riassunto dei dati disponibili chimici, preclinici e clinici ( guidelines della ICH ) • programma clinico generale e protocollo • eventuali dinieghi ricevuti da altri CE • schema riassuntivo (come da circolare 15) 23

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(8) DM 18. 3. 98 - Procedura (4) Contenuto della autorizzazione a. conferma dell’applicabilità della esenzione in base alla documentazione presentata(giudizio di notorietà) b. valutazioni di competenza del comitato etico sul piano clinico e sul protocollo in base alle GCP 24

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(9) DM 18. 3. 98 - Procedura (5) Validità della autorizzazione SU TUTTO IL TERRITORIO NAZIONALE PER 3 ANNI DALLA SUA EMISSIONE 25

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(9) DM 18. 3. 98 - Procedura (6) Le procedure amministrative* nei singoli centri non vengono normate * La nuova direttiva EU prevede che le stesse vengano espletate contemporaneamente alla valutazione etica del protocollo 25/1

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(10) DM 18. 3. 98 - Eccezioni • • medicinali per terapia genica oligonucleotidi antisenso e ribozimi medicinali per terapie cellulari somatiche radiofarmaci • sostanze stupefacenti e psicotrope (successivamente selezionate dal Minsal) • medicinali per le tossicodipendenze • medicinali per la fecondazione assistita 26

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(11) DM 18. 3. 98 - Eccezioni • Competenza per valutazione: Comitato etico nazionale • Documentazione: Allegati alla Circolare n. 15 del 5 ottobre 2000 • Rilascio autorizzazione: Ministero della Salute 27

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(12) DM 18. 3. 98 - Eccezioni COMITATO ETICO NAZIONALE istituito presso il Ministero della Salute con compiti di: • giudizio di notorietà • valutazione etico-scientifica di sperimentazioni di interesse nazionale • compiti specifici assegnati dal Ministero 28

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ UTILIZZATO NELL’UOMO(13) DM 18. 3. 98 - Eccezioni Procedura • Domanda al Ministero della Salute ottemperanza alla Circolare n. 15/2000 • Tempi per l’ottenimento del giudizio di notorietà: non definiti • Validità dell’autorizzazione : 3 anni 29

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ IN COMMERCIO (1) - FASE IV • Competenza per valutazione: Comitato etico competente • Documentazione: Circolare n. 15 dell’ottobre 2000 • Autorizzazione Ministero della Salute solo per diniego motivato in 30 gg dall’invio del parere del primo CE 30

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ IN COMMERCIO (2) - FASE IV Procedura • Invio del protocollo ai comitati etici dei centri coinvolti • Ottenimento del parere dei comitati • Invio della domanda al Ministero della Salute corredata delle autorizzazione del CE 31

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ IN COMMERCIO (3) - FASE IV Contenuto della domanda* • Assunzione di responsabilità per budget farmacovigilanza e assicurazione • Dichiarazione relativa al rischio di TSE • Impegno a comunicare la data di inizio e fine sperimentazione e ogni eventuale variazione al programma *come da Circolare 15 del 5 ottobre 2000 32

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ IN COMMERCIO (4) - FASE IV Contenuto della domanda (con’t) • obiettivi e scopi dello studio (giustificazioni) • dati di farmacovigilanza • dati relativi a studi analoghi condotti in Italia e all’estero • dati relativi ai centri sperimentali 33

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA FARMACO GIA’ IN COMMERCIO (5) - FASE IV Contenuto della domanda (con’t) • copia del RCP autorizzato • copia del parere favorevole dei comitati etici dei centri coinvolti • copia del protocollo /consenso informato • data inizio studio • schema riassuntivo come da circolare n. 15 34

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA Tracking* • Comunicazione di inizio studio per studi di fase I, III e bioequivalenza • Comunicazione di completamento della sperimentazione *Circolare n. 15 del 5 ottobre e Decreto Ministeriale del 25 maggio 2000 (OSSC) 35

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA Tracking* • Comunicazione di rinuncia alla sperimentazione • Comunicazione di interruzione della sperimentazione • Comunicazione della sintesi dei dati ottenuti dalla sperimentazione *Circolare n. 15 del 5 ottobre 2000 Decreto Ministeriale del 25 maggio 2000 (OSSC) 36

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA Questioni aperte • • esperienza dei Comitati Etici Numero dei comitati etici Ruolo dell’Osservatorio per la sperimentazione Tempi non fissati per il Comitato etico Nazionale • Controllo delle procedure amministrative dei singoli centri 37

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA IL FUTURO Implementazione della Direttiva 2001/20/EC 38

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA IMPLEMENTAZIONE DELLA DIRETTIVA 2001/20/EC Scopo (Art 1) La direttiva non si applica agli studi osservazionali ed epidemiologici Compliance alle GCP Aumento delle ispezioni ai centri di sperimentazione e e alle GMP (Art 1) alle unità produttive Autorità competenti (Art 2) Direttore generale o Legale rappresentante della struttura ove si svolge la sperimentazione 39

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA IMPLEMENTAZIONE DELLA DIRETTIVA 2001/20/EC Protezione dei soggetti (Art 3) Verrà emanato uno specifico decreto sui requisiti minimi dell’assicurazione. Studi clinici sui minori (Art 4) L’articolo 4 della direttiva EU è stato recepito in maniera totale. Studi clinici su soggetti incapaci (Art 5) Il consenso informato deve essere ottenuto dal soggetto stesso dal momento in cui recupera le sue capacità psico-fisiche 40

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA IMPLEMENTAZIONE DELLA DIRETTIVA 2001/20/EC Comitati Etici (Art 6) L’accordo finanziario tra i centri e lo sponsor deve essere finalizzato nei 60 giorni previsti per l’esame della documentazione. Un decreto verrà emesso per dettagliare l’organizzazione e l’operatività dei CE Single opinion (Art 7) I centri partecipanti non possono modificare l’opinione del centro coordinatore. L’accettazione o il rifiuto in toto, deve essere comunicato entro 30 gg. 41

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA IMPLEMENTAZIONE DELLA DIRETTIVA 2001/20/EC Uno specifico decreto Domanda di stabilirà le modalità e il autorizzazione (Art 8) contenuto della domanda. Conduzione dello studio clinico (Art 10) 42 Uno specifico decreto stabilirà i diversi tipi di emendamento che dovranno essere valutati in 35 gg dal EC coordinatore e 15 dagli altri CE. Uno specifico decreto stabilirà le modalità di trasmissione dei risultati all’Osservatorio nazionale.

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA IMPLEMENTAZIONE DELLA DIRETTIVA 2001/20/EC Segnalazione degli eventi avversi (Art 17) Scambio di informazioni (Art 11) Gli eventi avversi molto gravi letali o non previsti (SUSAR), devono essere comunicati al Minsal entro 7 gg dalla conoscenza. Altri dettagli devono essere comunicati entro i successivi 8 gg. Tutti gli altri eventi avversi gravi e inattesi devono essere comunicati entro 15 gg L’osservatorio nazionale è incaricato di monitorare la conduzione degli studi clinici e di integrare queste informazioni nel database 43 europeo.

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA Circolare n. 15 del 5 ottobre 2000 Esempio di modulistica 44

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA Osservatorio della sperimentazione clinica Esempio di modulistica 45

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA STUDI NON INTERVENTISTICI O “OSSERVAZIONALI” Definizione “Studio centrato sui problemi e patologie nel cui ambito i medicinali sono prescritti nel modo consueto e conformemente all’AIC. L’inclusione del paziente non viene decisa in anticipo dal protocollo di sperimentazione ma rientra nella normale pratica clinica” 46

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA STUDI NON INTERVENTISTICI O “OSSERVAZIONALI” Requisiti per la conduzione • I protocolli di ricerca devono adottare una metodologia rigorosa e in essi devono essere individuati Ø Ø Le motivazioni e le ipotesi di ricerca Le attese dello studio I criteri di analisi dei risultati La metodologia statistica appropriata 47

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA STUDI NON INTERVENTISTICI O “OSSERVAZIONALI” Requisiti per la conduzione • Trasparenza delle sponsorizzazioni e degli impegni economici • Nessun costo aggiuntivo per il SSN • Trasparenza sulla proprietà dei dati • Protezione dei soggetti partecipanti • Notifica ai comitati etici di riferimenti (con eventuale approvazione formale) 48

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA USO TERAPEUTICO DI FARMACI SOTTOPOSTI A SPERIMENTAZIONE CLINICA O “EXPANDED ACCESS” Opportunità in grado di garantire al paziente l’accesso a farmaci ancora in fase di sperimentazione 49

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA USO TERAPEUTICO DI FARMACI SOTTOPOSTI A SPERIMENTAZIONE CLINICA O “EXPANDED ACCESS” Presupposti: • Il medicinale sia già stato oggetto di sperimentazione clinica di fase III (solo in casi particolari di fase II) nella stessa indicazione • Non esistono alternative terapeutiche • I dati disponibili siano sufficienti per formulare un giudizio sull’efficacia e la tollerabilità 50

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA USO TERAPEUTICO DI FARMACI SOTTOPOSTI A SPERIMENTAZIONE CLINICA O “EXPANDED ACCESS” • Il medicinale può essere richiesto alla azienda sponsor della sperimentazione clinica 51

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA USO TERAPEUTICO DI FARMACI SOTTOPOSTI A SPERIMENTAZIONE CLINICA O “EXPANDED ACCESS” Il medicinale può essere richiesto alla azienda sponsor della sperimentazione clinica da: • • Un medico per uso nominale per un singolo paziente Da gruppi di medici o gruppi cooperatori Da più medici operanti in diversi centri Da medici i cui pazienti hanno partecipato agli studi clinici dimostrando una risposta al farmaco 52

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA USO TERAPEUTICO DI FARMACI SOTTOPOSTI A SPERIMENTAZIONE CLINICA O “EXPANDED ACCESS” Il medicinale può essere richiesto alla azienda sponsor della sperimentazione clinica sulla base di un protocollo che contenga: • Un razionale clinico per la richiesta • I dati relativi all’efficacia e tollerabilità del farmaco derivanti dagli studi clinici • Il grado di comparabilità dei pazienti eleggibili rispetto a quelli già trattati negli studi clinici • Le modalità di informazione al paziente • Le modalità di raccolta dati secondo la logica di uno studio osservazionale 53

PROCEDURE E NORMATIVE DELLA SPERIMENTAZIONE CLINICA USO TERAPEUTICO DI FARMACI SOTTOPOSTI A SPERIMENTAZIONE CLINICA O “EXPANDED ACCESS” Il protocollo • Deve essere trasmesso al Comitato Etico del centro che può anche operare con procedura d’urgenza nel caso trattasi di pazienti provenienti da uno studio clinico concluso • Deve essere trasmesso contestualmente al Ministero della Salute che può eventualmente emettere un giudizio sospensivo. • I dati raccolti possono essere utilizzati “come supporto” in una procedura registrativa 54

Legge 112/02 art. . comma 9 ter I passaggi Ø Negoziazione prezzo con gruppo di lavoro CIPE Ø Firma dell’accordo con l’azienda Ø Preparazione del testo del decreto di rimborsabilità Ø Approvazione del testo di decreto da parte della CUF Ø Firma da parte del Direttore generale del farmaceutico

Legge 112/02 art. . comma 9 ter Ø Ø Ø Firma da parte del capo dipartimento Invio del decreto al Ministero del tesoro Ratifica da parte del Ministero del tesoro Ritorno del decreto al Minsal Invio del decreto alla Conferenza Stato. Regioni Ø Ratifica del decreto da parte della Conferenza Stato-Regioni

ØLegge 112/02 art. . comma 9 ter Ø Ø Ø Ø Ritorno del decreto al Minsal Invio al Ministro della Salute per la Firma Invio alla Corte dei Conti Registrazione presso la Corte dei Conti Ritorno del decreto al Minsal Invio del decreto in Gazzetta Ufficiale Pubblicazione del decreto

ØLegge 112/02 art. . comma 9 ter I tempi 11 passaggi in aggiunta all’iter previsto per la fissazione del prezzo 6 - 8 mesi dalla data di ratifica dell’accordo da parte della CUF

ØLegge 112/02 art. . comma 9 ter Il futuro Ø Creazione dell’Agenzia del Farmaco Ø Corresponsabilità nelle decisioni sul farmaco da parte del Ministero del Tesoro, della Salute e delle Regioni Ø Abolizione del 9 ter Ø Decadenza della CUF

LA CUF e le commissioni Ø Organo collegiale presieduto dal Ministro della Salute Ø Composto da 15 membri ufficiali di cui 5 designati dal Ministro e 7 dalle regioni Ø In carica per due anni Ø Si riunisce una volta al mese Ø Viene supportato dagli uffici della DG del farmaco e da esperti esterni

LA CUF e le commissioni Ha i compiti di: Ø Autorizzare l’immissione in commercio di nuovi farmaci registrati per via nazionale Ø Classificare ai fini del rimborso e definire il prezzo delle nuove specialità Ø Preparare e aggiornare il PTN Ø Prendere decisioni in tema di farmacovigilanza

LA CUF e le commissioni Ø Autorizzare la sperimentazione clinica per farmaci “particolari” Ø Emanare linee guida Ø collaborare alla stesura di decreti in tema di farmaci, dispositivi medici, presidi etc.

LA CUF e le commissioni Opera attraverso commissioni “tematiche” Ø Ø Ø Prezzi e rimborso Procedure comunitarie Procedure nazionali Sperimentazione clinica Farmacovigilanza Revisione programmata e stampati
 Sperimentazione clinica dispositivi medici
Sperimentazione clinica dispositivi medici Strumenti di stenotipia computerizzata
Strumenti di stenotipia computerizzata Convegno origami e didattica
Convegno origami e didattica Convegno ecclesiale di firenze documento finale
Convegno ecclesiale di firenze documento finale Nadir korkmazer
Nadir korkmazer Geometry of aerial photograph
Geometry of aerial photograph Nadir afonso rodrigues
Nadir afonso rodrigues Dagestan map
Dagestan map Geodesia astronomica
Geodesia astronomica Plano general extremo
Plano general extremo Nadir of race relations
Nadir of race relations Dr nadir shah
Dr nadir shah Types of drowning
Types of drowning Nadir point in aerial photography
Nadir point in aerial photography Nadir belkhiter
Nadir belkhiter Prove della sfericità della terra
Prove della sfericità della terra Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Klein soluzioni
Klein soluzioni Moti millenari della terra zanichelli
Moti millenari della terra zanichelli Terzo principio fichte
Terzo principio fichte Prove sfericità della terra zanichelli
Prove sfericità della terra zanichelli Pei disturbo misto della condotta e della sfera emozionale
Pei disturbo misto della condotta e della sfera emozionale Disturbo misto della condotta e della sfera emozionale
Disturbo misto della condotta e della sfera emozionale Culture e formati della televisione e della radio
Culture e formati della televisione e della radio Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Lavorazione della seta fasi
Lavorazione della seta fasi Serie di bowen
Serie di bowen La coccinella in cerca della felicità pdf
La coccinella in cerca della felicità pdf Elena bettinelli
Elena bettinelli Il racconto della chimica e della terra soluzioni
Il racconto della chimica e della terra soluzioni Saba ritratto della mia bambina
Saba ritratto della mia bambina Simonetta klein il racconto della chimica
Simonetta klein il racconto della chimica Tools of normative analysis
Tools of normative analysis Utilitarianism vs kantianism
Utilitarianism vs kantianism Descriptive ethics vs normative ethics
Descriptive ethics vs normative ethics Trajta normative
Trajta normative Antinomie normative
Antinomie normative Normative ethics
Normative ethics Empirical statement examples
Empirical statement examples Tools of normative analysis
Tools of normative analysis Normative social influence
Normative social influence Superordinate goals
Superordinate goals Stick drop test is an example of what component of fitness
Stick drop test is an example of what component of fitness Informational social influence psychology definition
Informational social influence psychology definition Normative-reeducative
Normative-reeducative Normative statement
Normative statement The 3 ethical theories
The 3 ethical theories Normative social influence
Normative social influence Ethics is the branch of philosophy concerned with:
Ethics is the branch of philosophy concerned with: évaluation normative
évaluation normative Normative und deskriptive entscheidungstheorie
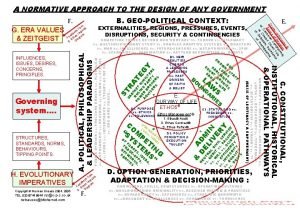
Normative und deskriptive entscheidungstheorie Normative design
Normative design Beneficence
Beneficence Ybrowser
Ybrowser Normative language
Normative language Theories of the press
Theories of the press Normative theories of mass communication
Normative theories of mass communication Muscular strength fitness test
Muscular strength fitness test Tools of normative analysis
Tools of normative analysis Physical mobility scale pdf
Physical mobility scale pdf Meta ethics vs normative ethics
Meta ethics vs normative ethics Informational influence
Informational influence Financial accounting theory craig deegan
Financial accounting theory craig deegan Normative research design
Normative research design Aspects of honesty
Aspects of honesty Normative statement
Normative statement