LA SPERIMENTAZIONE CLINICA CON DISPOSITIVI MEDICI IN ITALIA





- Slides: 6

LA SPERIMENTAZIONE CLINICA CON DISPOSITIVI MEDICI IN ITALIA: NODI PROBLEMATICI PER I COMITATI ETICI Prof. Claudio Buccelli Federazione Nazionale dei Comitati Etici (FNa. CE) Presidente del Comitato Etico per le Attività Biomediche “Carlo Romano” Università degli Studi di Napoli Federico II

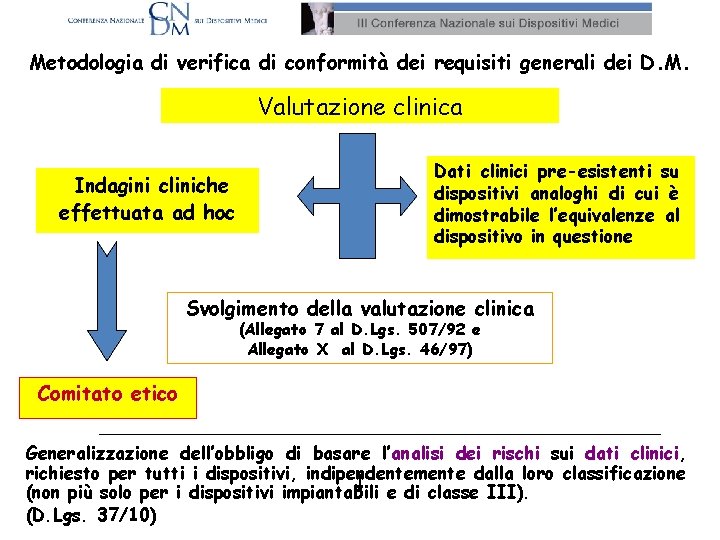
Metodologia di verifica di conformità dei requisiti generali dei D. M. Valutazione clinica Indagini cliniche effettuata ad hoc Dati clinici pre-esistenti su dispositivi analoghi di cui è dimostrabile l’equivalenze al dispositivo in questione Svolgimento della valutazione clinica (Allegato 7 al D. Lgs. 507/92 e Allegato X al D. Lgs. 46/97) Comitato etico Generalizzazione dell’obbligo di basare l’analisi dei rischi sui dati clinici, clinici richiesto per tutti i dispositivi, indipendentemente dalla loro classificazione (non più solo per i dispositivi impiantabili e di classe III). (D. Lgs. 37/10)

Ambiti di interventi dei C. E. nelle indagini cliniche con dispositivi medici • DM non recanti marchiatura CE; • DM già con struttura; marcatura CE ma modificati nella • DM già marcati CE ma proposti per indicazioni d’uso diverse da quelle prese in considerazione nelle procedure di valutazione di conformità seguite ai fini dell’apposizione di tale marcatura; • DM in studi post-marketing già marcati CE utilizzati nella stessa destinazione d’uso per cui hanno ottenuto la marcatura CE.

Indagini cliniche sui DM e coperture assicurative 1. D. M. 2 agosto 2005 (modalità di presentazione della documentazione per notifica di indagine clinica con dispositivi medici): Art. 3, comma 1, lettera n: Dichiarazione del fabbricante che “è stata stipulata idonea copertura assicurativa per i soggetti in studio e che questa è stata sottoposta alla valutazione del comitato etico competente”; 2. D. M. 14 luglio 2009 (requisiti minimi per le polizze assicurative a tutela dei soggetti partecipanti alle sperimentazioni cliniche dei medicinali) Art. 1, comma 1: “Il promotore della sperimentazione clinica deve presentare al comitato etico, in conformità all’art. 3, comma 3 del decreto legislativo 24 giugno 2003, n. 211, un certificato assicurativo […]”;

Indagini cliniche sui DM e coperture assicurative D. Lgs. 211/03: Attuazione della direttiva 2001/20/CE relativa all'applicazione della buona pratica clinica nell'esecuzione delle sperimentazioni cliniche di medicinali per uso clinico Art. 1 (ambito di applicazione): “[…] Il presente decreto non si applica alla sperimentazione non interventistica o studio osservazionale”; Art. 2 (definizioni): “Ai fini del presente decreto legislativo si applicano le seguenti definizioni: a) «sperimentazione clinica» ; qualsiasi studio sull'uomo finalizzato a scoprire o verificare gli effetti clinici, farmacologici e/o altri effetti farmacodinamici di uno o più medicinali sperimentali, e/o a individuare qualsiasi reazione avversa ad uno a più medicinali sperimentali, e/o a studiarne l'assorbimento, la distribuzione, il metabolismo e l'eliminazione, con l'obiettivo di accertarne la sicurezza e/o l'efficacia. Questa definizione include le sperimentazioni cliniche effettuate in un unico centro o in più centri, solo in Italia o anche in altri Stati membri dell'Unione europea; […]”.

Ulteriori elementi di perplessità • documentazione da presentare al Comitato Etico: criterio analogico con quella prevista nel DM 21 dicembre 2007 (modalità di inoltro della richiesta di autorizzazione all’Autorità competente, per la comunicazione di emendamenti sostanziali e la dichiarazione di conclusione della sperimentazione clinica e per la richiesta di parere al comitato)? ; • competenze specifiche dei membri: 12 maggio 2006 o riferimento al comma 6? ; modifica art. 2, comma 4 DM • mutuabilità della normativa degli studi no profit per indagini cliniche no profit sui DM? ; • database degli studi con dispositivi medici dispositivi? ); • sperimentabilità riutilizzati. sul reimpiego dei (DM 17/12/04) (OSIC dispositivi per i medici