PREDICCION DE GENES CON GENSCAN Jos Mara Hidalgo






























- Slides: 47

PREDICCION DE GENES CON GENSCAN José María Hidalgo Utrera Joan Miquel Fuster Mollá Ana Isabel Martínez García

ÍNDICE n n n n Introducción Problemas Conocimientos básicos Objetivos Modelo general. Métodos Limitaciones Resultados Conclusión

Introducción GENSCAN: modelo probabilístico capaz de encontrar múltiples genes o genes parciales en una secuencia. (http: //genes. mit. edu/GENSCAN. html) n Tipos de predicción n q q q Por Homología Por uso de Señales Por análisis Estadístico

Problemas n n Al principio, encontrar elementos funcionales, promotores, splice, regiones codificadas (por métodos biológicos). Después, predicción de genes completos (por métodos informáticos) con limitaciones: q q Algoritmo suponen las secuencias contienen genes completos. Sólo 50% de exones identificados.

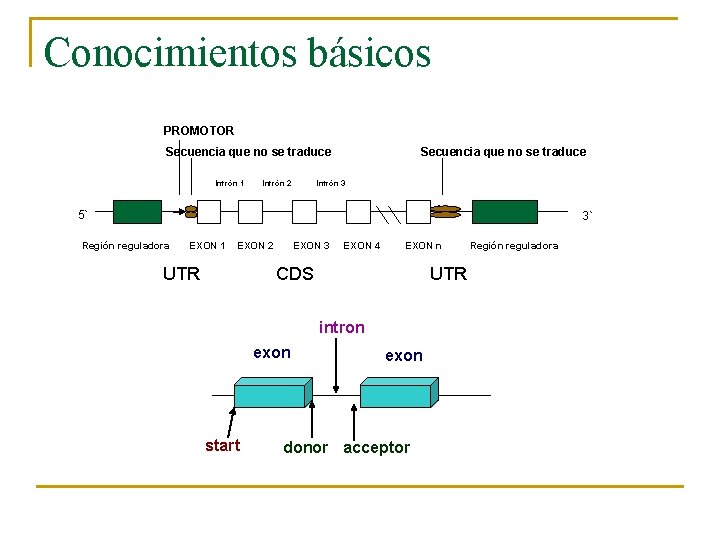
Conocimientos básicos PROMOTOR Secuencia que no se traduce Intrón 1 Intrón 2 Secuencia que no se traduce Intrón 3 5` 3` Región reguladora EXON 1 EXON 2 UTR EXON 3 EXON 4 EXON n CDS UTR intron exon start exon donor acceptor Región reguladora

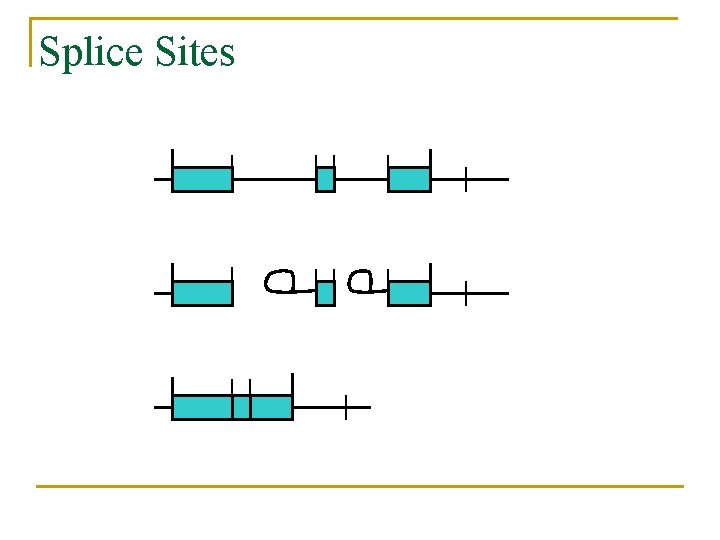
Splice Sites

Objetivos n Intenta encontrar, mediante métodos computacionales, la localización de zonas importantes, como: q q n Actividad transcripcional. Las zonas de corte y empalme (splicing). Utiliza un modelo probabilístico para la predicción de la localización de exones/genes en secuencias genómicas.

Objetivos n Algunas características del modelo: q q q Capturar diferencias en la estructura de genes entre distintas regiones C + G. Capacidad de predecir múltiples genes de una secuencia, genes parciales y completos. Modelos estadísticos para las zonas de splicing del donante y del aceptador que capturan dependencias importantes entre las posiciones de la señal.

Objetivos n n Genscan puede ser usado para detectar genes noveles (genes que no se encuentran en la BD). En la práctica se suelen utilizar distintos programas a la vez que usamos Genscan: 1. CENSOR: identifica y enmascara secuencias repetidas. 2. Uso de Genscan y las secuencias obtenidas buscarlas en bases de datos de proteínas con BLASTP para detectar posibles homólogos. 3. 1 Si homólogos detectados, refinar la predicción sometiendo la región del genoma correspondiente junto con la proteína homologa usando Procrustes (algoritmo ”spliced alignment”). 3. 2 Sino, se podría usar la base de datos Expressed Sequence Tags para precisar terminos 3’. 4. RT-PCR y 3’ RACE: para precisar las posiciones exactas de los exones/intrones y posibles zonas de unión (splice).

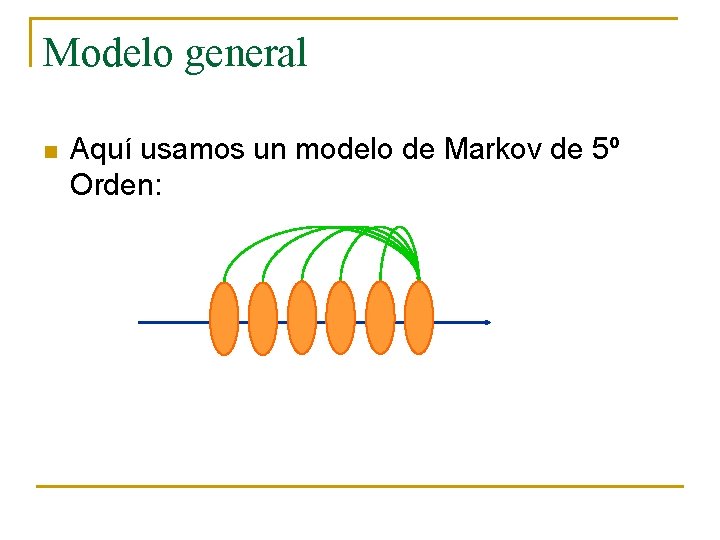
Modelo general n Modelos de Markov: q q q Modelo probabilístico basado en la estadística. Toma información adicional de los residuos de los vecinos. Hay órdenes: n n Primer orden: Toma la información del nucleótido adyacente (precedencias y sucesores) Orden N: Toma la información de los N nucleótidos más cercanos.

Modelo general n Aquí usamos un modelo de Markov de 5º Orden:

Modelo general Algorithmic issues State length distributions Initial, transition probabilities Signal Models Splice Signals Acceptor splice Site model Transcriptional Translational signals MDD Exon models Reverse-strand states HMM

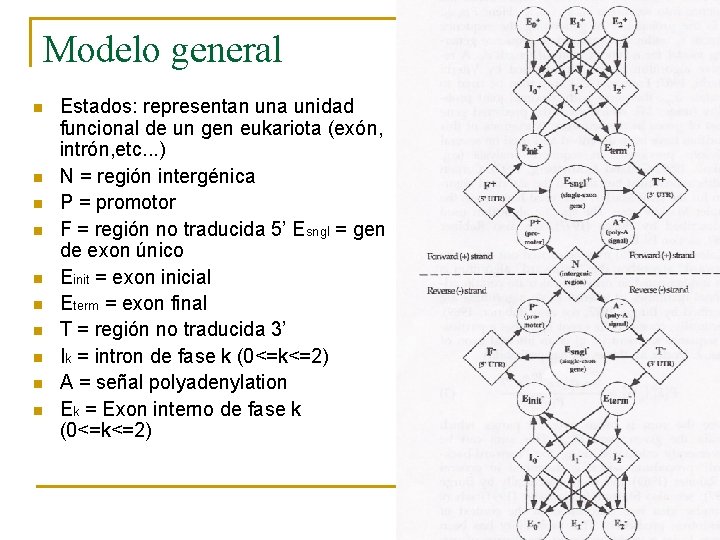
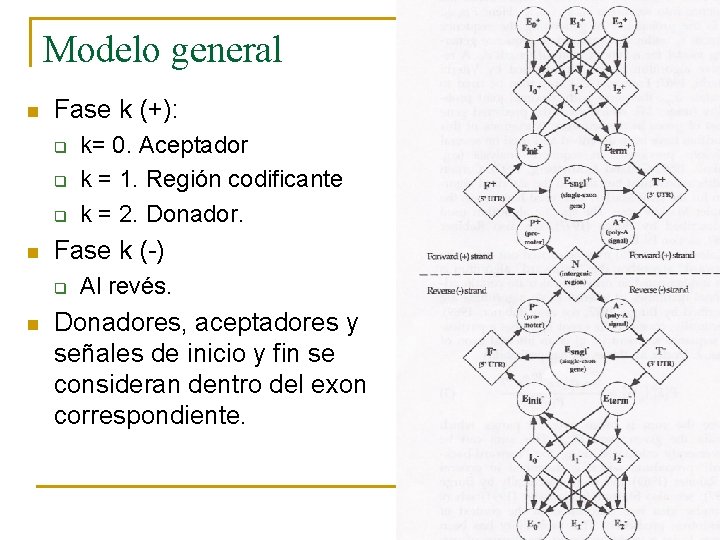
Modelo general n n n n n Estados: representan una unidad funcional de un gen eukariota (exón, intrón, etc. . . ) N = región intergénica P = promotor F = región no traducida 5’ Esngl = gen de exon único Einit = exon inicial Eterm = exon final T = región no traducida 3’ Ik = intron de fase k (0<=k<=2) A = señal polyadenylation Ek = Exon interno de fase k (0<=k<=2)

Modelo general n Fase k (+): q q q n Fase k (-) q n k= 0. Aceptador k = 1. Región codificante k = 2. Donador. Al revés. Donadores, aceptadores y señales de inicio y fin se consideran dentro del exon correspondiente.

Método: Conjunto de secuencias n Proceso para elegir las secuencias de genes: q Gen. Bank: Conjunto inicial no redundante (Kulp/Reese): n n n q Limpieza genes: n n n q Secuencias completas (ATG a stop por lo menos) a Inclusión regiones 5’ 3’ no traducidas X Uso BLASP: elimina redundancia CDS Exones inciertos o putativos Genes solapados Pseudogenes De origen viral Quedan 428 secuencias

Método: Conjunto de secuencias q q n Borrado de genes con más de 25% igualdad a nivel de aminoácidos (PROSET). Quedan 238 secuencias multi-exón y 142 de exón único = 2, 580, 965 pbs. Todos los parámetros en los métodos se basan en estos datos, salvo: q q Modelo promotor: basado en las fuentes publicadas Modelo de región codificante: sustitución por otro conjunto de proteinas humanas de 100 aminoácidos de longitud mínimo (también PROSET).

Método: Algorithmic issues n Dado una secuencia S de longitud L, la probabilidad de unión de generar el parse Φi: q q Uso del agortimo recursivo de Viterbi modificado porque aquí usamos un modelo semi-Markov. P{S} se calcula con el algoritmo hacia delante; hacia atrás para el evento E (exon):

Método: Probabilidades inicial y de transición

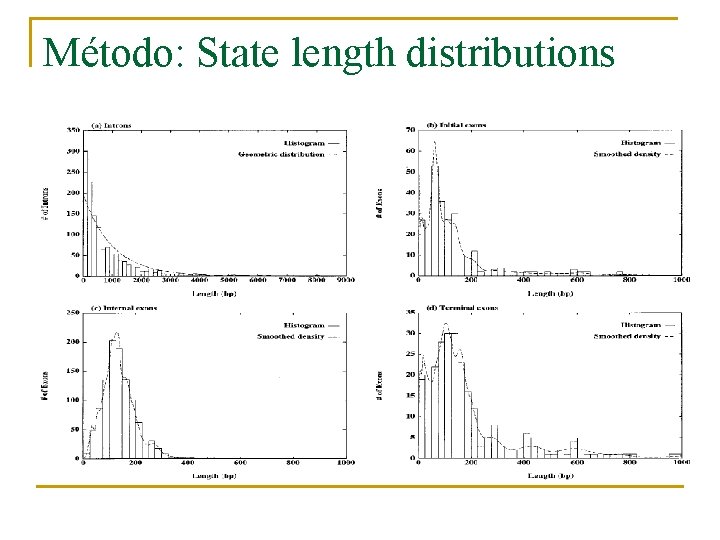
Método: State length distributions n Importante: longitud en los exones internos. q q q Pueden producir fallos al incluir el exon en el m. RNA final. Pueden producir interferencias en los factores que reconocen los splicing y podría hacer la unión de exones pequeños más difícil. Idea “medium-sized” entre 50 y 300 bp, todo más fácil.

Método: State length distributions n Poner figura 4

Método: Signal models n Modelo weight matrix method WMM de Staden. q q q n Frecuencia pij de cada nucleótido j a cada posición i de una señal de longitud n. : probabilidad de generar una secuencia particular (X=x 1, x 2, …, xn). Modelo más simple usado para cierto tipo de señales. Modelo weight array (WAM)de Zhang & Marr q q q Considera las adyacentes dependencias secuencia particular. Deriva al modelo MDD. entre las posiciones : probabilidad de generar una

Método: Transcriptional and translational signals n n n Señal poly. A: 6 bp WMM (consensus: AATAAA) model. Señal de iniciación de la traducción: (“CDS”). 12 bp WMM model. Señal de terminación de la traducción: codón de parada (UAA, UAG, UGA) y siguientes tres nucleótidos usamos modelo WMM.

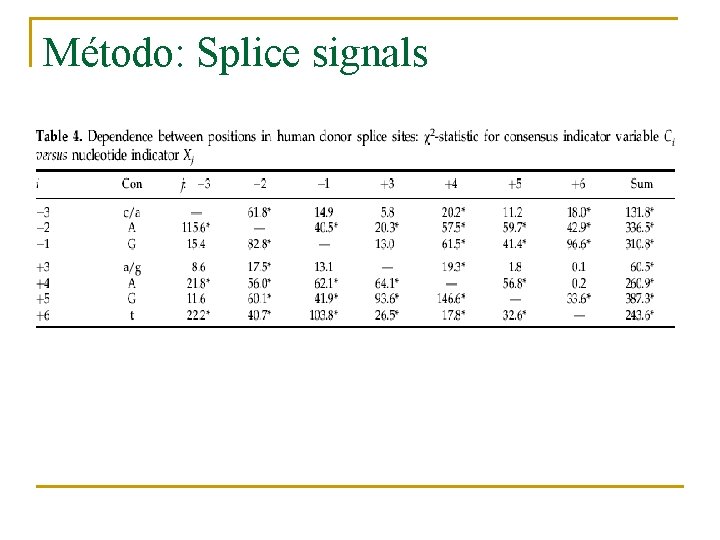
Método: Splice signals n n n Señales de donante y aceptador son las más críticas para la buena predicción de genes. Significantes dependencias tanto en posiciones no adyacentes como en las adyacentes en la señal del donante. La región de consenso del donante se encuentra en los últimos 3 bp del exón (posiciones -3 a -1) y los primeros 6 bp del siguiente intrón (1 a 6).

Método: Splice signals

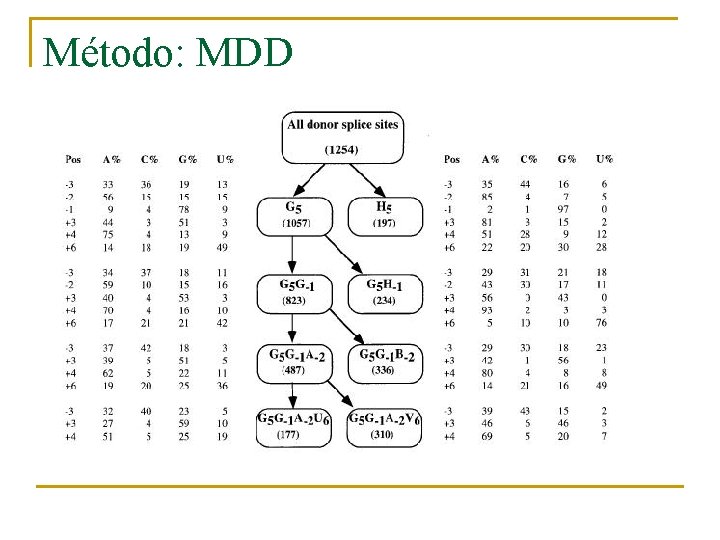
Método: MDD n n Estudio sobre un conjunto de zonas de corte y empalme. Subdividir el conjunto hasta encontrar la secuencia modelo, basándonos en la tabla de dependencias creada.

Método: MDD

Método: Aceptor splice site model n n Consiste en el modelado de la región de splice utilizando una ventana WAM. Objetivo: calcular probabilidades condicionales de todas y cada una de las posiciones.

Método: Exon Models n n n Utilizado cuando es mayor la concentración A+T. No es posible utilizar probabilidades calculadas. Utiliza una matriz derivada de C+G < 43%.

Método: Reserve-strand states n n Depende del sentido en el que se lea la hebra. Ej: se predice TAG – TAA – TGA se generan CTA – TTA - TCA

Limitaciones n n n Número de genes Organismo Tests no representativos Tipo de exón Señales de Splice

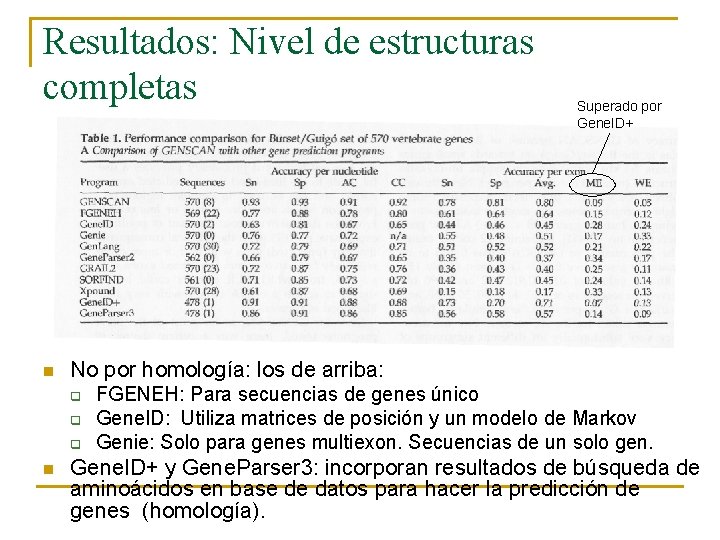
Resultados n n Test conjunto Burset/Guigó: 570 vertebrados (multiexones). La evaluación del conjunto de Burset/Guigó consiste en tres pasos: 1. 2. 3. Extraer un conjunto de secuencia de vertebrados de los que se conoce su estructura génica (Conjunto de Test); Definición de un número de medidas de exactitud de predicción; y Evaluación de un número de programas con el conjunto de test usando las medidas.

Resultados n Nivel de Base (Nucleótido). q n Nivel de Exón (Estructura del exón). q n Fiabilidad de la predicción por base Fiabilidad de la predicción con respecto a la predicción exacta del comienzo y fin del exón. Nivel de Proteína (Proteína). q Fiabilidad de la predicción con respecto a la proteina codificada por el gen predicho

Resultados n Nivel de Base (Nucleótido) • TP: verdadero positivo • TN: verdadero negativo • FP: falso positivo • FN: falso negativo

Resultados n Nivel de Base (Nucleótido). q Sn: Sensibilidad = TP/(TP+FN) Sp: Especificidad = TN/(TN+FP) AC: Correlación aproximada q CC: Coeficiente de correlación q q

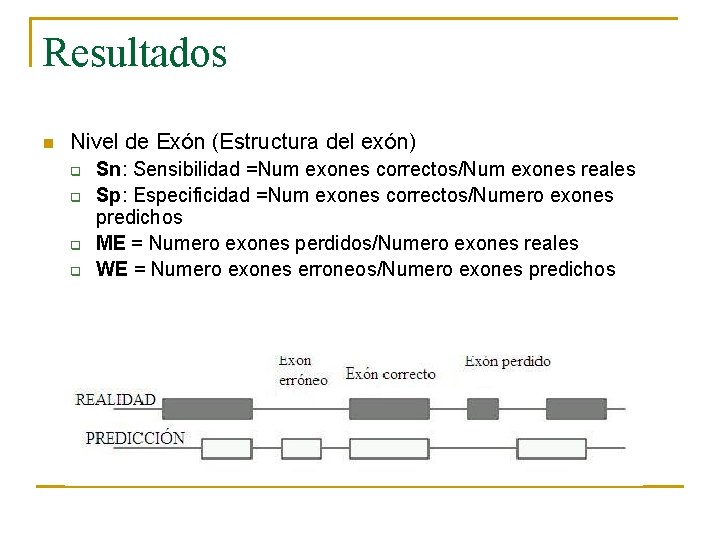
Resultados n Nivel de Exón (Estructura del exón) q q Sn: Sensibilidad =Num exones correctos/Num exones reales Sp: Especificidad =Num exones correctos/Numero exones predichos ME = Numero exones perdidos/Numero exones reales WE = Numero exones erroneos/Numero exones predichos

Resultados n Nivel de Proteína (Proteína). q % Sim: porcentaje de similaridad entre la secuencia de aminoácidos codificada por el gen predicho y la secuencia de aminoácidos codificada por el gen real

Resultados: Nivel de estructuras completas n No por homología: los de arriba: q q q n Superado por Gene. ID+ FGENEH: Para secuencias de genes único Gene. ID: Utiliza matrices de posición y un modelo de Markov Genie: Solo para genes multiexon. Secuencias de un solo gen. Gene. ID+ y Gene. Parser 3: incorporan resultados de búsqueda de aminoácidos en base de datos para hacer la predicción de genes (homología).

Resultados: Nivel de gen n Resultados a nivel de gen (GA) para un conjunto de secuencias: proporción de genes que realmente son predichos exactamente. Resultados: 0. 43 (243/570) => es posible predecir estructuras multi-exón con un resultado razonable. Ejemplo: Gen gástrico humano con 22 exones codificantes

Resultados: Nivel de gen n n Relativamente insensible al contenido C+G (CC) Similar a AC.

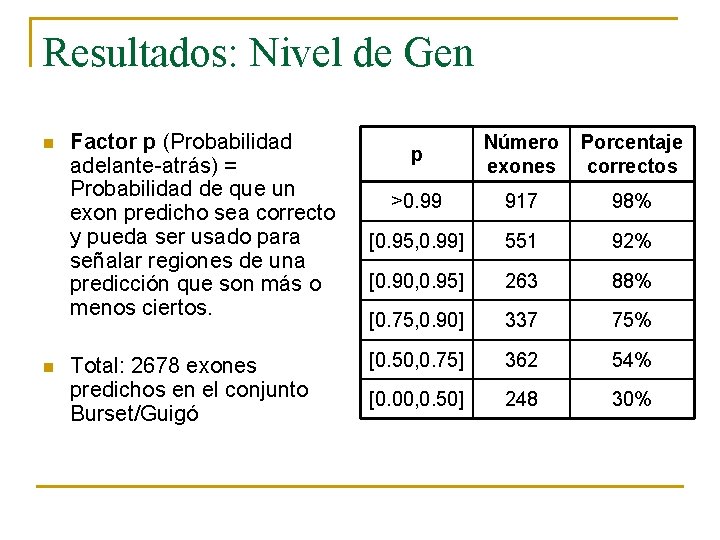
Resultados: Nivel de Gen n n Factor p (Probabilidad adelante-atrás) = Probabilidad de que un exon predicho sea correcto y pueda ser usado para señalar regiones de una predicción que son más o menos ciertos. Total: 2678 exones predichos en el conjunto Burset/Guigó p Número exones Porcentaje correctos >0. 99 917 98% [0. 95, 0. 99] 551 92% [0. 90, 0. 95] 263 88% [0. 75, 0. 90] 337 75% [0. 50, 0. 75] 362 54% [0. 00, 0. 50] 248 30%

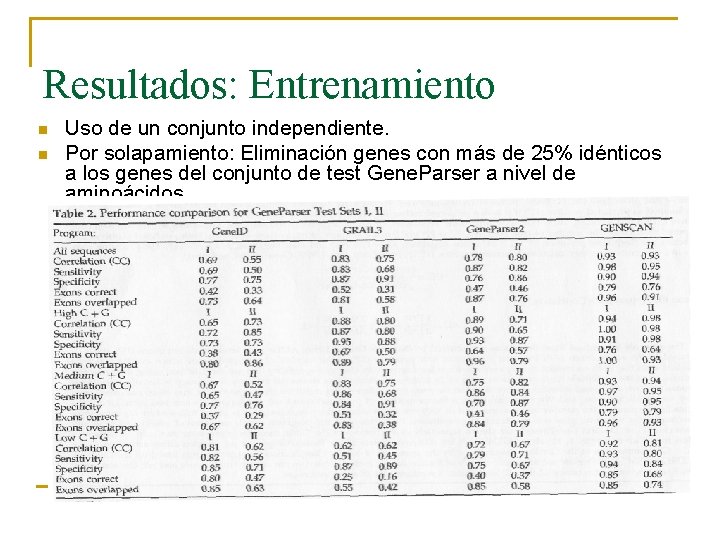
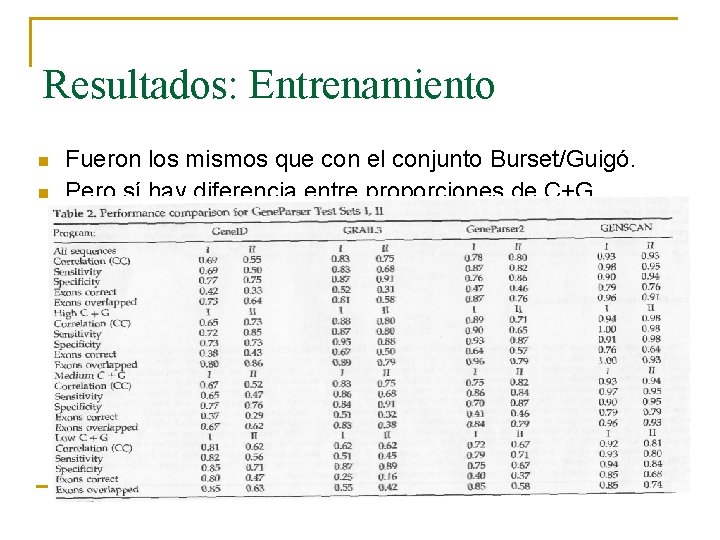
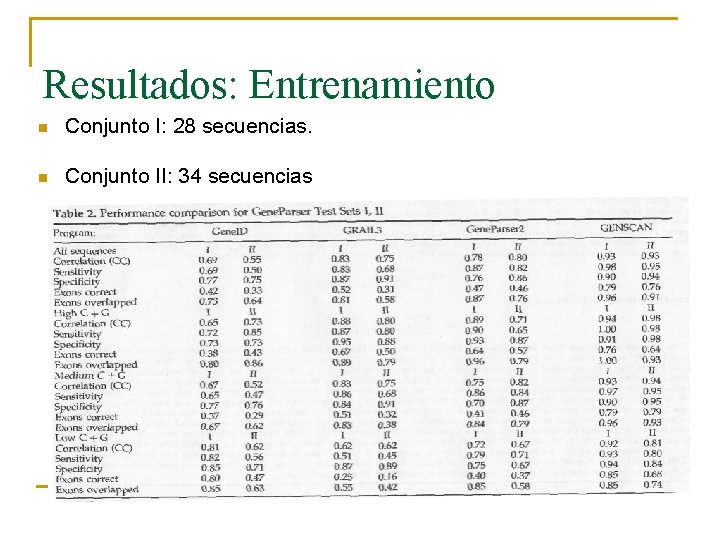
Resultados: Entrenamiento n n Uso de un conjunto independiente. Por solapamiento: Eliminación genes con más de 25% idénticos a los genes del conjunto de test Gene. Parser a nivel de aminoácidos

Resultados: Entrenamiento n n Fueron los mismos que con el conjunto Burset/Guigó. Pero sí hay diferencia entre proporciones de C+G

Resultados: Entrenamiento n Conjunto I: 28 secuencias. n Conjunto II: 34 secuencias

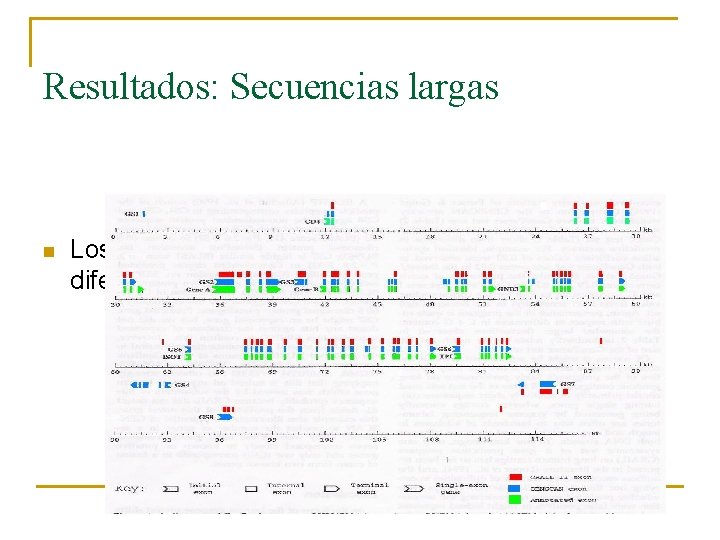
Resultados: Notas n Ninguno de los resultados son verdaderamente significativos de la realidad. Aquí usamos secuencias cortas. n Sólo GRAIL ha conseguido resultados aceptables en secuencias grandes, e incluso se encontraron dificultades

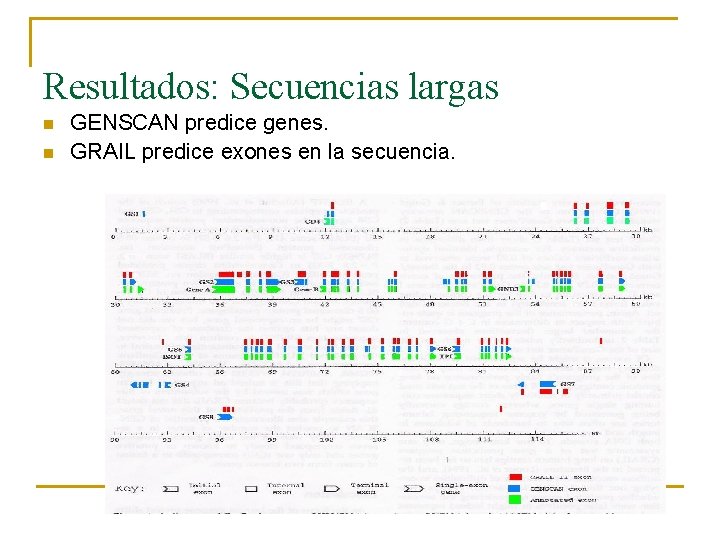
Resultados: Secuencias largas n Los dos encuentran exones conocidos, pero con diferencias

Resultados: Secuencias largas n n GENSCAN predice genes. GRAIL predice exones en la secuencia.

Conclusión n GENSCAN es lo “mejor”
 Linked genes and unlinked genes
Linked genes and unlinked genes Homeotic genes vs hox genes
Homeotic genes vs hox genes Polygenic inheritance
Polygenic inheritance Preguntas de miguel hidalgo con respuesta
Preguntas de miguel hidalgo con respuesta Engradece
Engradece Modelo gestión ontológica (ivonne hidalgo)
Modelo gestión ontológica (ivonne hidalgo) Conesthgo
Conesthgo Marian congregation jose rizal
Marian congregation jose rizal Colegio mariano hidalgo plataforma
Colegio mariano hidalgo plataforma Carmen hidalgo tenorio
Carmen hidalgo tenorio Modelo gestión ontológica (ivonne hidalgo)
Modelo gestión ontológica (ivonne hidalgo) Siipped hidalgo
Siipped hidalgo Toussaint louverture simon bolivar
Toussaint louverture simon bolivar Toledo hidalgo washington
Toledo hidalgo washington Entrevista a miguel hidalgo
Entrevista a miguel hidalgo Descripcion fisica don quijote
Descripcion fisica don quijote Pertinent
Pertinent Isabel hidalgo md
Isabel hidalgo md Tula hidalgo
Tula hidalgo Código civil del estado de hidalgo
Código civil del estado de hidalgo Hsi yuan lu
Hsi yuan lu Colegio villa hidalgo
Colegio villa hidalgo Pensamiento de miguel hidalgo
Pensamiento de miguel hidalgo Dbox develop
Dbox develop Propaccess hidalgo
Propaccess hidalgo Cifrhs hidalgo
Cifrhs hidalgo Liceo superior de hidalgo
Liceo superior de hidalgo Washington toledo hidalgo
Washington toledo hidalgo Scudiero di don chisciotte
Scudiero di don chisciotte Khi tình yêu con còn mơ
Khi tình yêu con còn mơ Université dunarea de jos de galati
Université dunarea de jos de galati Identifica subiectele din textele de mai jos
Identifica subiectele din textele de mai jos Suomen kielen pilkkusäännöt
Suomen kielen pilkkusäännöt Jos oostveen
Jos oostveen Kas yra bendruomenė ir kodėl mums jos reikia
Kas yra bendruomenė ir kodėl mums jos reikia Jos van berkum
Jos van berkum Jos kuilboer
Jos kuilboer Bahs jos
Bahs jos Www.buurtzorgweb.nl
Www.buurtzorgweb.nl Pjesme budnice
Pjesme budnice Pliu palmar unic
Pliu palmar unic Algoritmo distribuido
Algoritmo distribuido Completează cu predicatele potrivite
Completează cu predicatele potrivite Budnica još hrvatska ni propala
Budnica još hrvatska ni propala Jos slovick wayfaring stranger
Jos slovick wayfaring stranger Jos brinkman
Jos brinkman Jos operating system
Jos operating system Jos jaspars
Jos jaspars