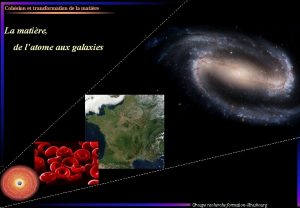
La matire Partie I Rvison La matire une




































- Slides: 56

La matière Partie I: Révison

La matière…. • à une masse et un volume • peut subir des changements – chimiques: irréversibles, formation de nouvelles substances – physique: réversibles, changement d’apparence, pas de nouvelles substances • est composé de particules minuscules qui… – sont séparées par des espaces – bougent constamment – bougent à cause de l’énergie

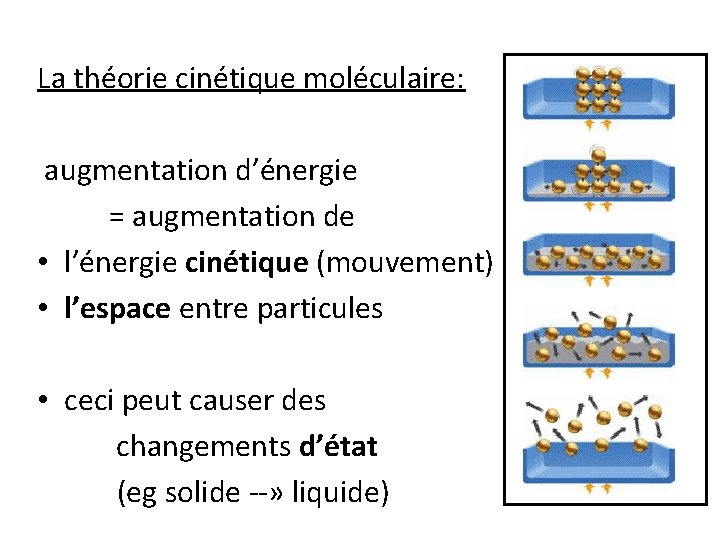
La théorie cinétique moléculaire: augmentation d’énergie = augmentation de • l’énergie cinétique (mouvement) • l’espace entre particules • ceci peut causer des changements d’état (eg solide --» liquide)

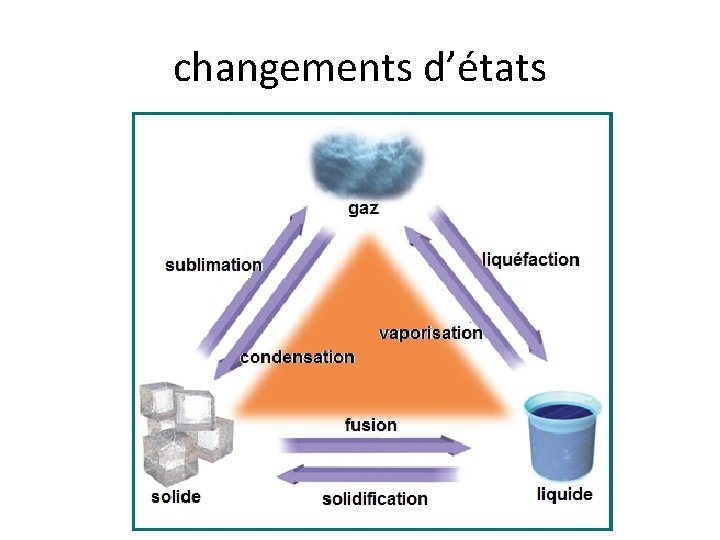
changements d’états

les propriétés physiques Quantitative • • • solubilité conductibilité viscosité masse volumique point de fusion/congélation point d’ébullition/liquéfaction Qualitative • • • état couleur malléabilité ductilité cristallinité magnétisme

La matière Partie II: Les éléments

Un élément est… …. une substance pure qui ne peut PAS être décomposé ou séparée en substances plus simples • chaque élément est composé d’un type d’atome seulement • la chimie est l’étude de la matière, est en étudiant les éléments on peut mieux comprendre la matière

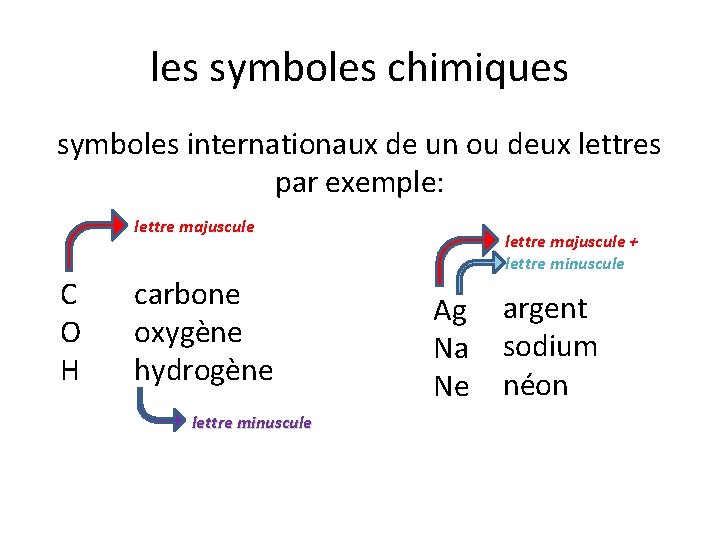
les symboles chimiques symboles internationaux de un ou deux lettres par exemple: lettre majuscule C O H carbone oxygène hydrogène lettre minuscule lettre majuscule + lettre minuscule Ag Na Ne argent sodium néon

certains éléments sodium fer carbone or néon chlore argent

La matière Partie III: le tableau périodique

le tableau périodique Masse atomique

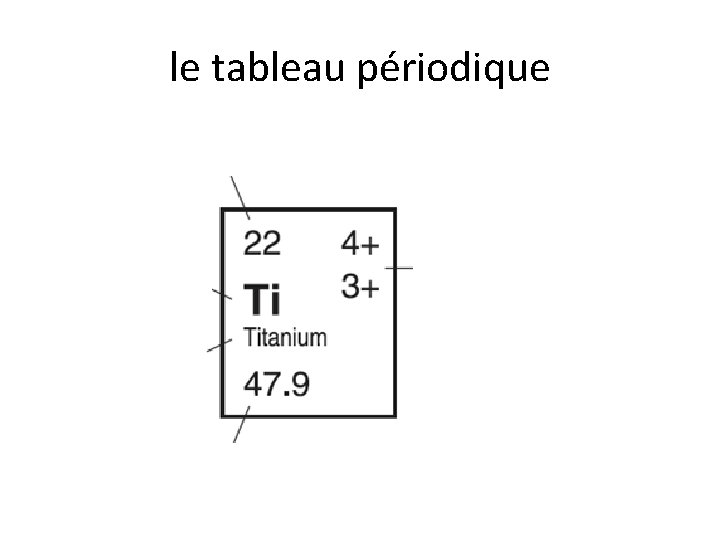
le tableau périodique • numéro atomiques = le nombre de protons (toujours un nombre entier) = le nombre d’électron d’un atome neutre • masse atomique = la masse moyenne des atomes d’un élément mesurer en: «unités de masse atomiques» (uma)

le tableau périodique • la charge ionique = la charge électrique formée sur un atome lorsqu’il perde ou gagne des électrons • certains éléments possèdent une charge multiple de l’ion – ils peuvent avoir plusieurs charges. ex Ti 4+ Ti 3+

Activité: À la rencontre des éléments

Projet Recherche Atome! pour un tableau périodique géant! Choisi un élément de numéro 1 à 36 et communique ton choix à Mme. Sorbetti (chaque élève va faire un élément différent)

le tableau périodique • au cours du XIXe siècle, les chimistes ont commencé à organiser leurs observations sur les éléments • en 1867 Dmitri Mendeleev a créé un tableau des éléments qui est devenu notre tableau périodique d’aujourd’hui • il y a plusieurs façons qu’on pourrait organiser les éléments…. !

• Mendeleev n’était pas le seul à créer un tableau, mais le sien était important parce que il a laissé des espaces pour des éléments découverts plus tard!








l’histoire de Medeleev • https: //www. youtube. com/watch? v=O 48 zn. Ag 7 VE • https: //www. youtube. com/watch? v=f. Pnw. BIT Smg. U

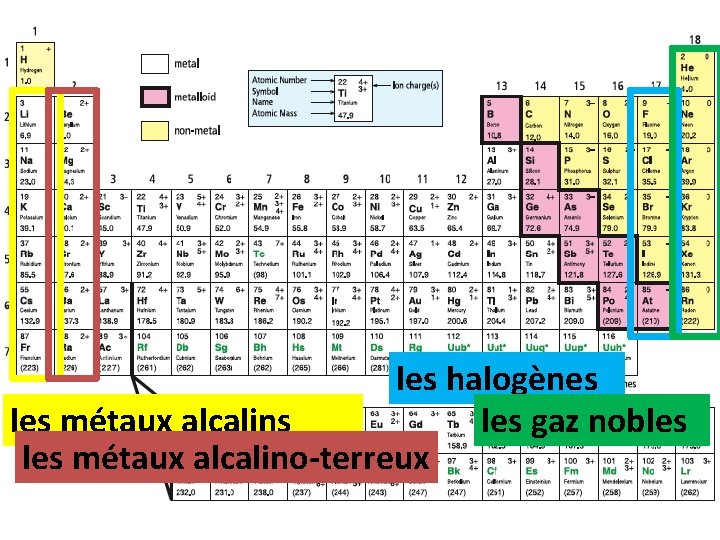
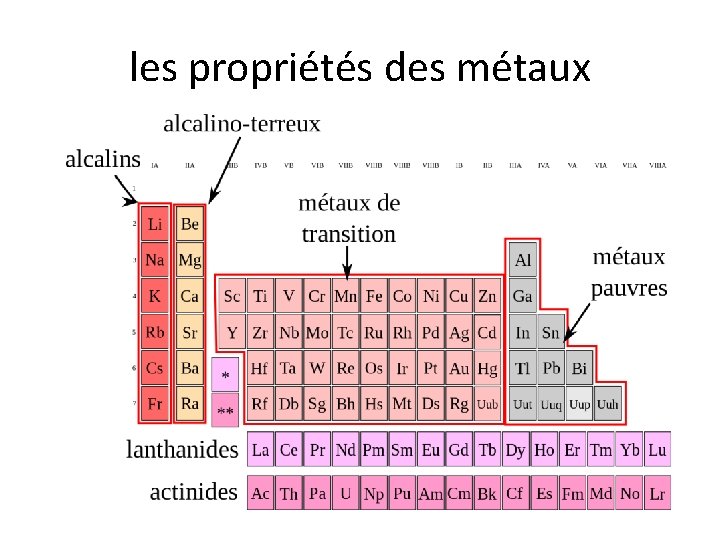
les halogènes les gaz nobles métaux alcalins les métaux alcalino-terreux

les périodes et les familles • les rangées horizontale = les périodes (#1 -7) – ex. lithium (Li) et azote (N) sont dans la même période • les colonnes verticales = les familles chimiques – les éléments de la même famille ont des propriétés semblables (mais pourquoi……? !) – ex. fluor (F) et brome (Br) sont dans la même famille

les propriétés des métaux, nonmétaux, et des métalloides État à la température de Apparence la pièce Métaux Non-métaux Métalloïdes page 55… Conductivité Malléabilité et ductilité

les propriétés des métaux

les propriétés des métaux Métaux État à la température Apparence de la pièce Conductivité solides (sauf le mercure – liquide) bon conducterus malléables de chaleur et ductiles et d’électricité lustre brillant Malléabilité et ductilité

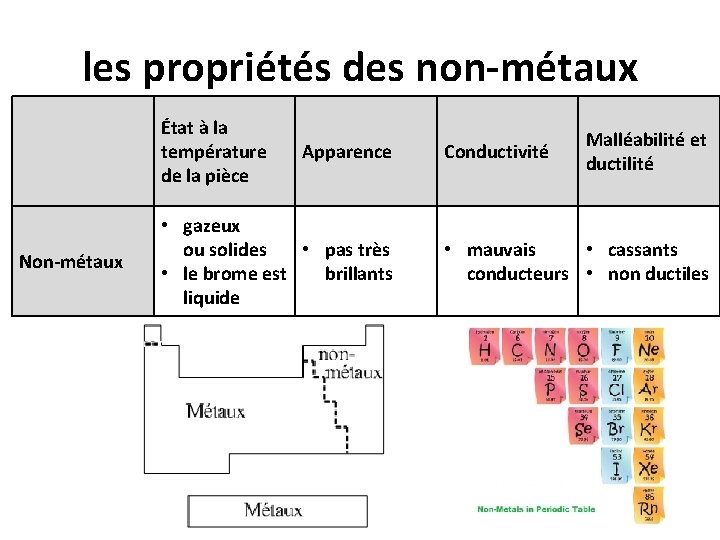
les propriétés des non-métaux État à la température de la pièce Non-métaux Apparence • gazeux ou solides • pas très • le brome est brillants liquide Conductivité Malléabilité et ductilité • mauvais • cassants conducteurs • non ductiles

les propriétés des métalloides État à la température de la pièce Métalloïdes • solides Apparence Conductivité Malléabilité et ductilité • brillants ou • mats • possibles conducteurs d’électricité • mauvais conducteurs de chaleur • cassants • non ductiles

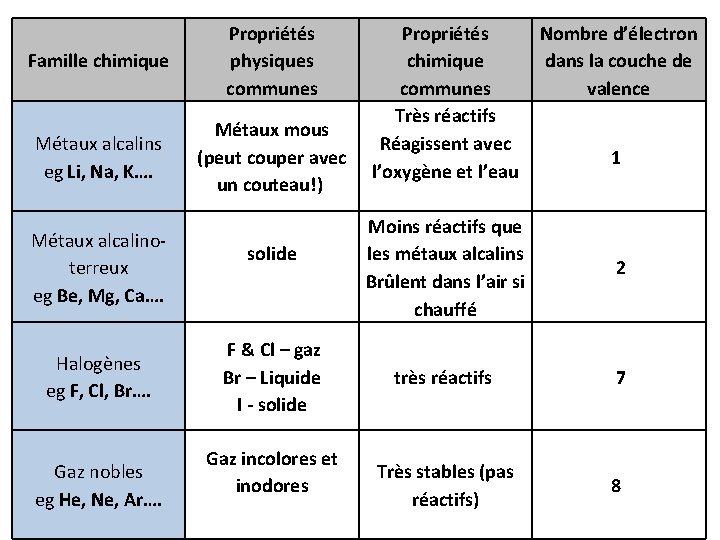
Famille chimique Propriétés physiques communes Propriétés chimique communes Nombre d’électron dans la couche de valence Métaux alcalins eg _____ Métaux alcalinoterreux eg _____ Halogènes eg _____ Gaz nobles eg _____ pages 56 -57

Famille chimique Propriétés physiques communes Métaux alcalins eg Li, Na, K…. Métaux mous (peut couper avec un couteau!) Métaux alcalinoterreux eg Be, Mg, Ca…. Halogènes eg F, Cl, Br…. Gaz nobles eg He, Ne, Ar…. solide F & Cl – gaz Br – Liquide I - solide Gaz incolores et inodores Propriétés chimique communes Très réactifs Réagissent avec l’oxygène et l’eau Nombre d’électron dans la couche de valence 1 Moins réactifs que les métaux alcalins Brûlent dans l’air si chauffé 2 très réactifs 7 Très stables (pas réactifs) 8

les métaux alcalins et l’eau https: //www. youtube. com/watch? v=uixx. Jt. JPVXk https: //www. youtube. com/watch? v=m 55 kgy. Ap Yr. Y

mais pourquoi les éléments de la même famille ont des propriétés en commun?

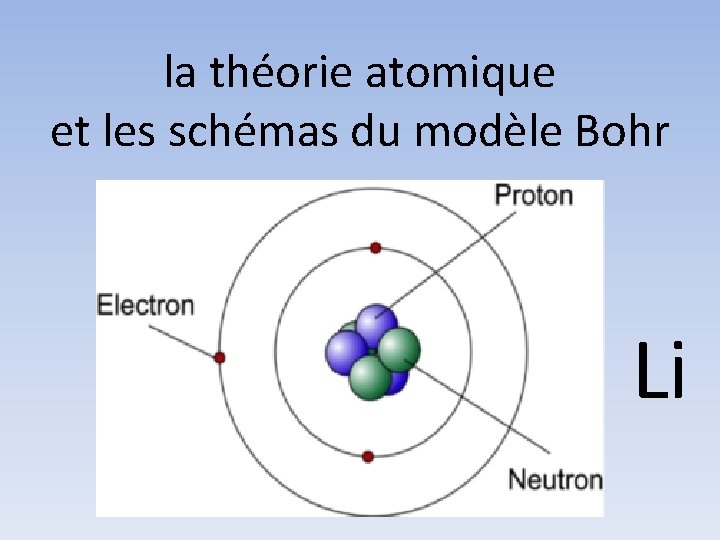
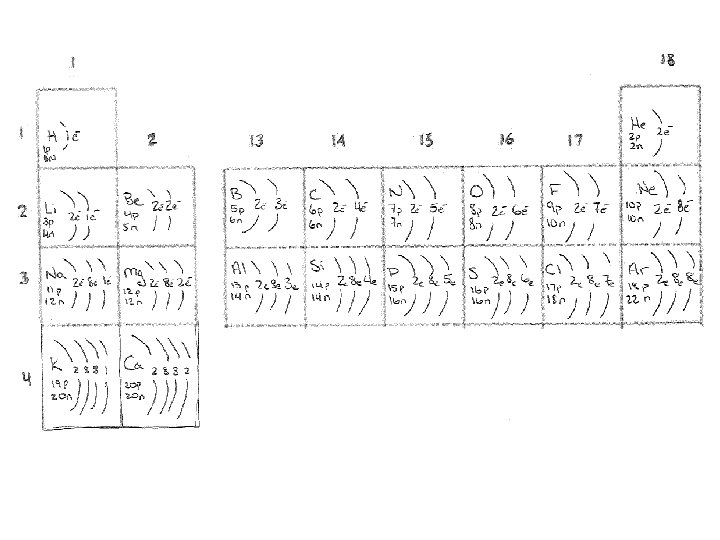
la théorie atomique et les schémas du modèle Bohr Li

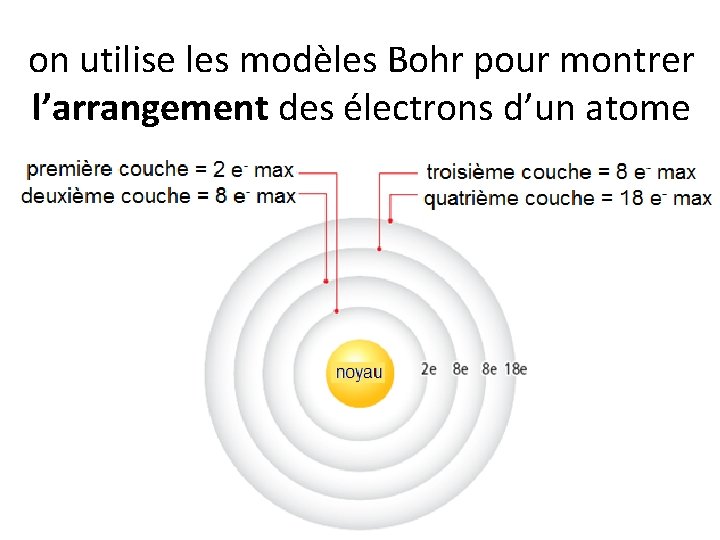
on utilise les modèles Bohr pour montrer l’arrangement des électrons d’un atome

Pour faire un schéma du modèle de Bohr: • indique le numéro de protons et neutron dans le noyau • remplis les couches plus proches au noyau en premier • on dessine les électrons en paires • les couches peuvent contenir: 2, 8, 8, 18, e • la couche la plus externe = la couche de valence

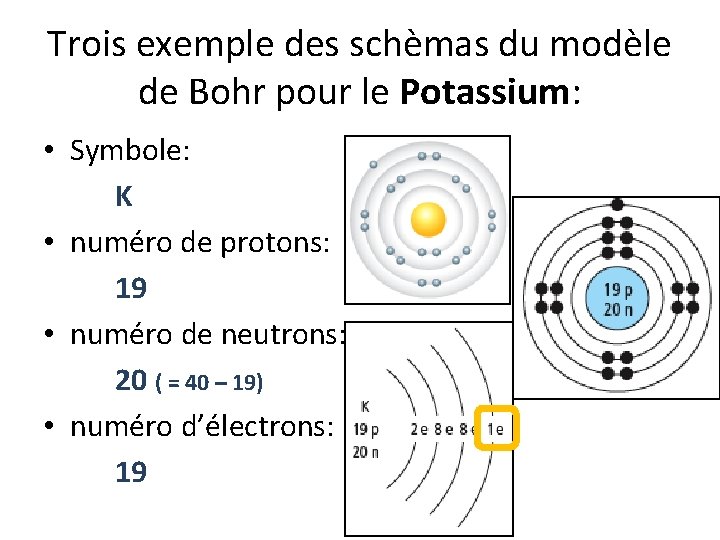
Trois exemple des schèmas du modèle de Bohr pour le Potassium: • Symbole: K • numéro de protons: 19 • numéro de neutrons: 20 ( = 40 – 19) • numéro d’électrons: 19

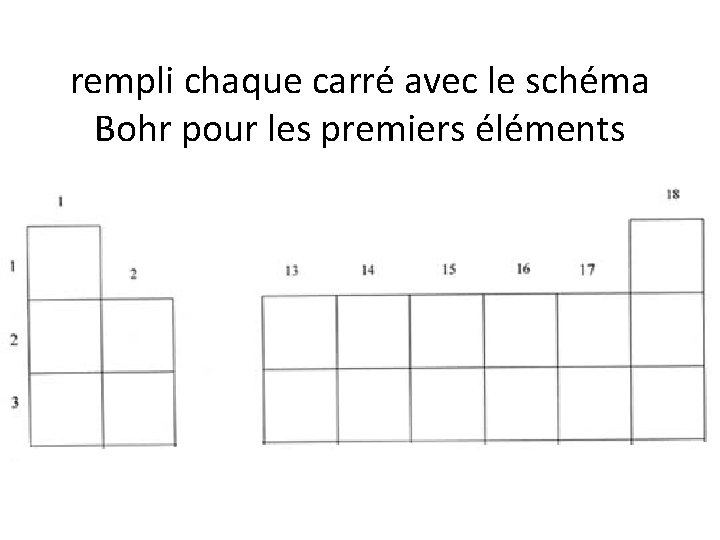
rempli chaque carré avec le schéma Bohr pour les premiers éléments



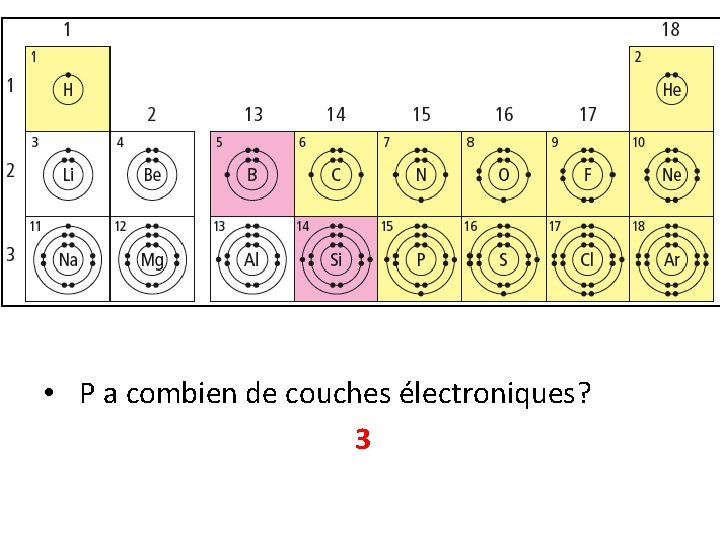
• P a combien de couches électroniques? 3

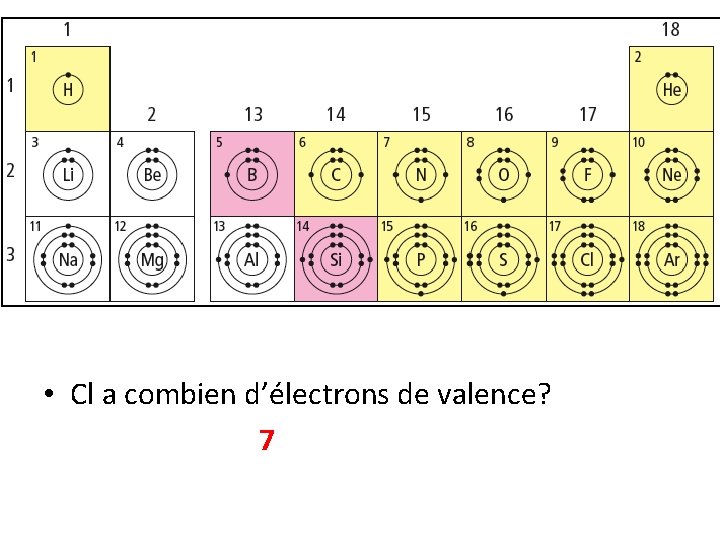
• Cl a combien d’électrons de valence? 7

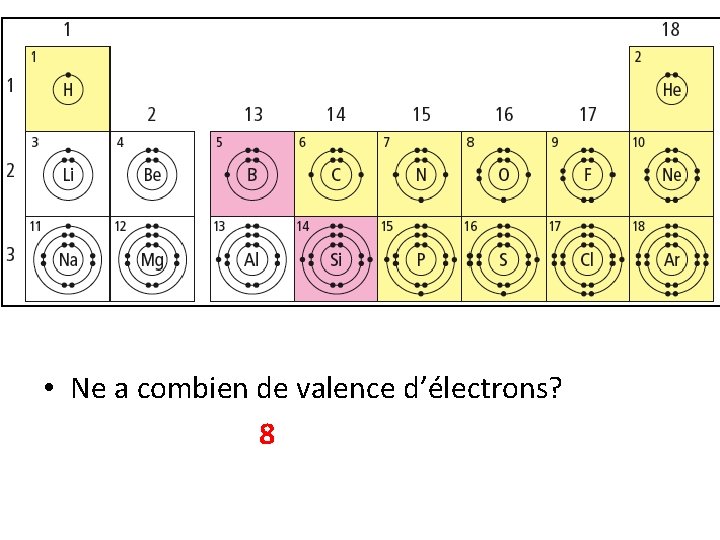
• Ne a combien de valence d’électrons? 8

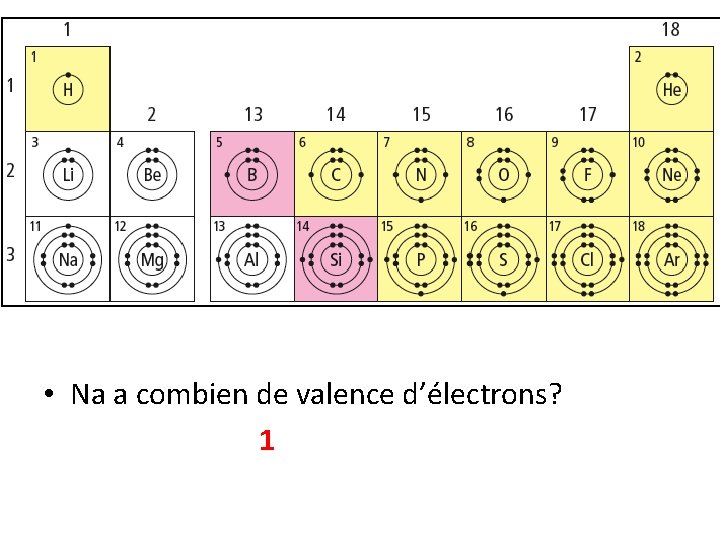
• Na a combien de valence d’électrons? 1

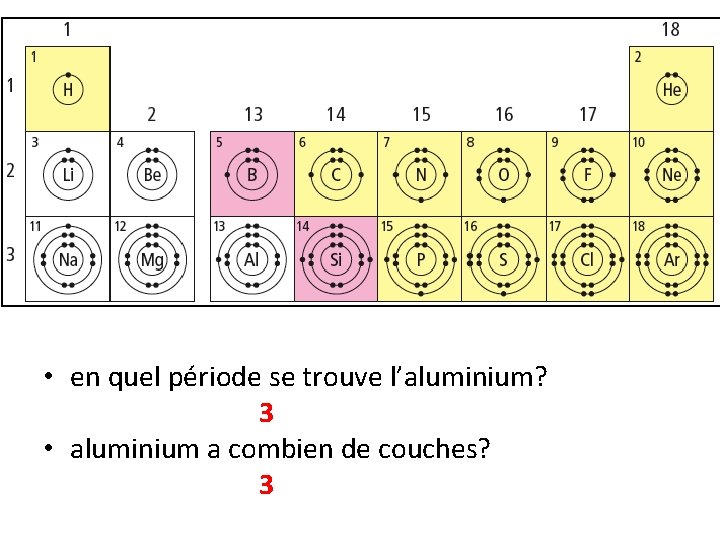
• en quel période se trouve l’aluminium? 3 • aluminium a combien de couches? 3

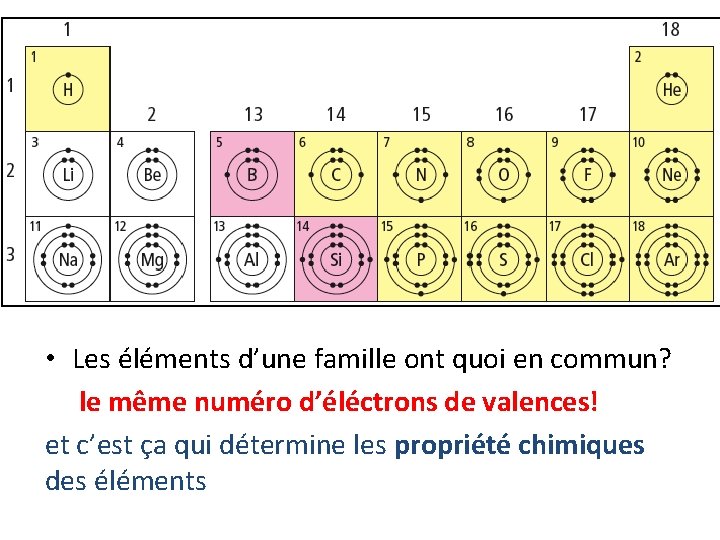
• Les éléments d’une famille ont quoi en commun? le même numéro d’éléctrons de valences! et c’est ça qui détermine les propriété chimiques des éléments

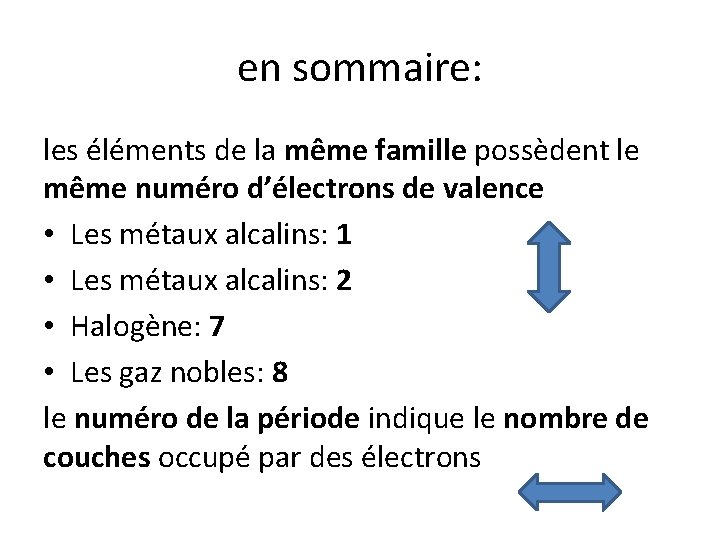
en sommaire: les éléments de la même famille possèdent le même numéro d’électrons de valence • Les métaux alcalins: 1 • Les métaux alcalins: 2 • Halogène: 7 • Les gaz nobles: 8 le numéro de la période indique le nombre de couches occupé par des électrons

Les ions • Jusqu’à maintenant nous avons seulement parlé des éléments • Mais on trouve plus souvent de composés, qui sont formé par des ions Sodium Na Chlore Cl Chlorure de sodium Na. Cl

la stabilité des gaz nobles • les gaz nobles ne sont pas réactif parce que leur couche de valence et pleine • lorsque deux atomes se joignent pour former des nouvelles substances les atomes doivent : gagner, perdre, ou partager des électrons un atome qui a gagné ou a perdu des éléctrons est appelé un ion

• les ions ont le même arrangement des électrons du gaz noble le plus proche • les métaux perdent des électrons pour former des ions positifs • les non-métaux gagnent des électrons pour former des ions negatifs

Les ions et les composés • Na (métal) → perd un électron = Na+ • Cl (gas) → gagne un électron = Cl • (les électrons ont un charge negative) • Les deux ions se combinent Chlorure de sodium Na. Cl https: //www. youtube. com/watch? v=d 2 gei. GKFve. E

métal, non-métal, ion ? ? numéro d’électrons? Ca Na+ Mg 2+ Al Al 3+ H He O 2 - métal – 20 éléctrons - / ion positif – 10 électrons - perdu métal - 13 éléctrons - / ion positif – 10 électrons - perdu non-métal – 1 électron - / non-métal – 2 électrons - / ion negatif– 10 électrons - gagné

pratique: page 71 # 1 -16
 Qu'est-ce qu'une synecdoque
Qu'est-ce qu'une synecdoque La matire
La matire Matire
Matire Matire1
Matire1 Matire noir
Matire noir Comment faire une introduction dans une dissertation
Comment faire une introduction dans une dissertation Robaxacet jean coutu
Robaxacet jean coutu Il était une fois une petite fille
Il était une fois une petite fille Si une porte se ferme une autre s'ouvre
Si une porte se ferme une autre s'ouvre Coupe d'une racine
Coupe d'une racine Ponctuation poésie renee jeanne mignard
Ponctuation poésie renee jeanne mignard Le bonheur est une trajectoire et non pas une destination
Le bonheur est une trajectoire et non pas une destination Une ouverture dans une conclusion
Une ouverture dans une conclusion Appuyez sur l’image qui est dans le bon sens
Appuyez sur l’image qui est dans le bon sens Définition de la une d'un journal
Définition de la une d'un journal Partie décimale
Partie décimale Résumé la route de chlifa
Résumé la route de chlifa Partie theorique
Partie theorique Tableau des centièmes
Tableau des centièmes Partie intérieure de la terre
Partie intérieure de la terre System planowania potrzeb materiałowych
System planowania potrzeb materiałowych Zone ventre
Zone ventre Les races de dauphins
Les races de dauphins Fonction en escalier
Fonction en escalier Partie fixe du moteur
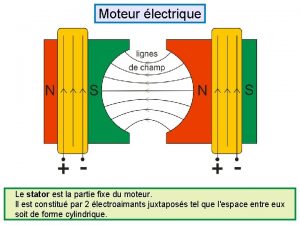
Partie fixe du moteur Partie de poisson
Partie de poisson Chimie partie 1
Chimie partie 1 Partie de campagne renoir
Partie de campagne renoir Partie prenante management
Partie prenante management Exemple de projet de cantine scolaire pdf
Exemple de projet de cantine scolaire pdf Une preparation microscopique
Une preparation microscopique Une question claire
Une question claire Ncnu moodle
Ncnu moodle Varice
Varice Tracer une ellipse
Tracer une ellipse Coefficient de hazen williams
Coefficient de hazen williams République du sénégal un peuple un but une foi
République du sénégal un peuple un but une foi Diagonale isométrique
Diagonale isométrique Une personne exceptionnelle
Une personne exceptionnelle Lakimi i peremrit deftor i ketille
Lakimi i peremrit deftor i ketille Une dictée sans ou 100 fautes
Une dictée sans ou 100 fautes Conduite à tenir devant une morsure de chien ppt
Conduite à tenir devant une morsure de chien ppt Croquis l'eau en espagne une ressource rare sous pression
Croquis l'eau en espagne une ressource rare sous pression Nous avons effectué une visite
Nous avons effectué une visite Schema de principe ciseaux
Schema de principe ciseaux Patricia place ses 24 pions sur une grille
Patricia place ses 24 pions sur une grille Tracer une ellipse
Tracer une ellipse Proposition relative
Proposition relative Une action antérieure
Une action antérieure Une bit
Une bit Une petite histoire de l'informatique
Une petite histoire de l'informatique Les étapes de la démarche de soins infirmiers
Les étapes de la démarche de soins infirmiers Moodle cagliari
Moodle cagliari Comportement d'une suite
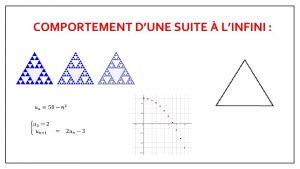
Comportement d'une suite Zero un deux trois quatre
Zero un deux trois quatre Taille moyenne d'une cellule animale
Taille moyenne d'une cellule animale Donne moi une suite au ritz
Donne moi une suite au ritz