KUANTUM SAYILARI Atomlarn iindeki elektronlarn dalga karakterinin matematik











![Elektronların element atomlarındaki yerleşimleri aşağıdaki gibidir; [1 H] = 1 s 1 [2 Elektronların element atomlarındaki yerleşimleri aşağıdaki gibidir; [1 H] = 1 s 1 [2](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-13.jpg)



![Sonra Geçiş elementlerinin ikinci sırası gelir. Geçiş elementlerinin genel özellikleri gözlenmeye başlar. [39 Y] Sonra Geçiş elementlerinin ikinci sırası gelir. Geçiş elementlerinin genel özellikleri gözlenmeye başlar. [39 Y]](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-17.jpg)
![Sonra 4 p orbitallerine elektronlar yerleşmeye başlar: [49 In] = [Kr] 4 d 10 Sonra 4 p orbitallerine elektronlar yerleşmeye başlar: [49 In] = [Kr] 4 d 10](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-18.jpg)

![[63 Eu] = [Xe] 4 f 7 6 s 2 [64 Gd] = [Xe] [63 Eu] = [Xe] 4 f 7 6 s 2 [64 Gd] = [Xe]](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-20.jpg)
![Sonra p orbitallerine elektronlar girer: [81 Tl] = [Xe] 4 f 14 5 d Sonra p orbitallerine elektronlar girer: [81 Tl] = [Xe] 4 f 14 5 d](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-21.jpg)


![Alkali metallerde, son yörüngelerdeki s orbitallerinde birer elektron vardır: [3 Li] = [He] 2 Alkali metallerde, son yörüngelerdeki s orbitallerinde birer elektron vardır: [3 Li] = [He] 2](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-24.jpg)















- Slides: 39

KUANTUM SAYILARI Atomların içindeki elektronların dalga karakterinin matematik incelenmesinden her elektronun kuvantum sayıları denen dört sayıyla temsil edileceği ortaya çıkmıştır. 1. Baş kuantum sayısı (n): Temel enerji seviyelerini gösterir. “n” ile ifade edilir ve tam sayılardır (n= 1, 2, 3…) (K, L, M, …. ile de gösterilir; n=1, K tabakasını; n=2, L tabakasını; n=3, M tabakasını gösterir)

2. Yan kuantum sayısı (Orbital kuantum sayısı) ( l ): Bu sayı alt enerji seviyerlerini ifade eder, ana enerji seviyesinden elektrik alanı ile ayrılan alt enerji seviyelerini gösterir ve “l” ile ifade edilir. Bu alt enerji seviyeleri s, p, d, f dir. Elektriki alanda bu ayrılmaya Stark efekti denir.

Ana enerji seviyelerinin alabileceği alt enerji seviyeleri aşağıda gösterilmiştir: n=1 l=s n=2 l= s, p n=3 l= s, p, d n=4 l= s, p, d, f Orbitaller için orbital kuvantum sayısı l = n – 1 dir. Örneğin; n = 1 de l = n – 1 = 1 – 1 = 0 dır. Yani sadece s alt enerji seviyesi bulunabilir. n = 2 de l = n – 1 = 2 – 1 = 1 dir. Yani s ve p alt enerji seviyesi bulunabilir. n = 3 de l = n – 1 = 3 – 1 = 2 dir. Yani s, p, d alt enerji seviyesi bulunabilir. n = 4 de l = n – 1 = 4 – 1 = 3 dir. Yani s, p, d, f alt enerji seviyesi bulunabilir.



4. Spin kuantum sayısı (ms ): • Kuantum sayıları, elektronların orbitallerdeki yerleşimlerini gösterir. Bu bir elektronu tarif etmek gibidir.

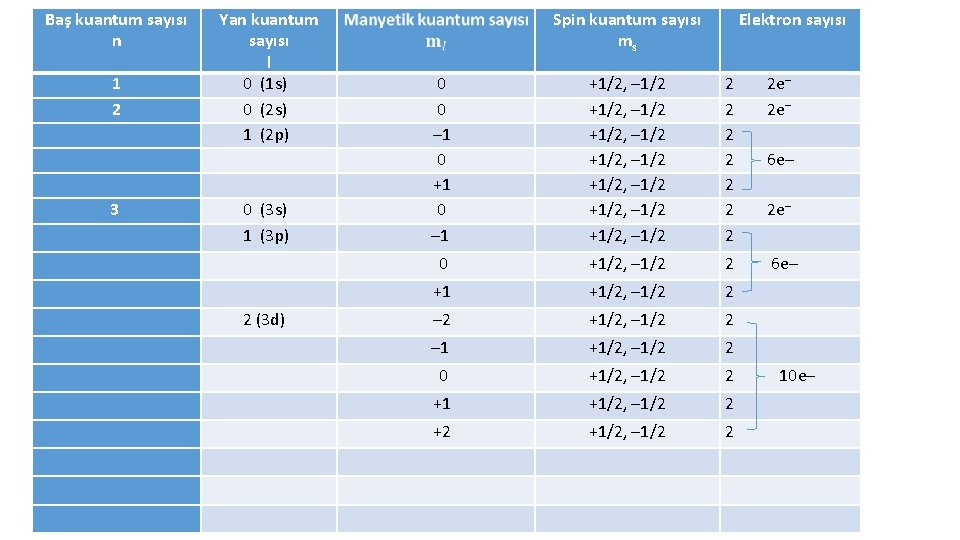
Baş kuantum sayısı n 1 2 3 Yan kuantum sayısı l 0 (1 s) 0 (2 s) 1 (2 p) 0 (3 s) 1 (3 p) Spin kuantum sayısı ms Elektron sayısı 0 0 – 1 0 +1 0 – 1 +1/2, – 1/2 +1/2, – 1/2 2 2 e– 2 2 6 e– 2 2 2 e– 2 0 +1/2, – 1/2 2 6 e– +1 +1/2, – 1/2 2 2 (3 d) – 2 +1/2, – 1/2 2 – 1 +1/2, – 1/2 2 0 +1/2, – 1/2 2 10 e– +1 +1/2, – 1/2 2 +2 +1/2, – 1/2 2

ELEKTRONLARIN ORBİTALLERE YERLEŞMELERİ Atomlar meydana gelirken elektronlar çekirdek etrafında belli kurallara göre çeşitli enerji seviyelerine yerleşmişlerdir. Pauli prensibi: Bir atomda 4 kuvantum sayısı aynı olan 2 elektron bulunamaz. En azından elektronların spinleri farklıdır. Ayrıca bir orbirale 2 den fazla elektron giremez. Pauli 'ye göre, bir orbitale spini +1/2 olan bir elektron yerleşmişse, aynı orbitale yerleşen ikinci elektronun spini mutlaka ters yönde, yani -1/2 olmalıdır. Aksi takdirde elektronlar bir arada bulunamazlar.

Hund kuralı: Elektronların orbitallere yerleşirken önce birer, daha sonra ikinci elektronların girmesi gerektiğini belirtir. Örneğin p orbitalinde spinleri farklı 6 elektron vardır. Yani bir orbitale 1 elektron girdikten sonra elektronlar çiftleşmeye başlar. Çünkü aynı orbitalde bulunan 2 elektronun birbirini itmesi ile kazanılan enerji genellikle bir üst alt tabakanın baş orbitali ile olan enerji farkından daha düşük olmaktadır. Aufbau prensibi: (Building up prensibi): Elektronlar orbitallere yerleşirken önce baş kuvantum (n) ve orbital kuvantum (l) sayıları toplamı küçük olan gruba girerler. Eğer bu toplam eşit ise önce elektronlar baş kuvantum sayısı küçük olan orbitale yerleşir. Eğer toplamlar eşit ise öncelikle n ‘si küçük olana girer.

Örneğin; 3 d ve 4 s orbitalleri boşsa elektron önce hangisine girer? 3 d için n + l = 3 + 2 = 5 4 s için n + l = 4 + 0 = 4 olur ve elektron önce 4 s ‘e girer. Örneğin; 3 d, 4 p ve 5 s orbitalleri boşsa elektron önce hangisine girer? 3 d için n + l = 3 + 2 = 5 4 p için n + l = 4 + 1 = 5 5 s için n + l = 5 + 0 = 5 olur ve üçü de eşit olduğu için elektron öncelikle n‘i küçük olan 3 d‘ye girer.

Bu prensibe göre elektronların enerji seviyelerine yerleşimi grafik halinde aşağıdaki gibi görülebilir

Orbitaldeki elektron sayısını belirtir Baş kuantum sayısını belirtir Açısal momentum kuantum sayısını belirtir
![Elektronların element atomlarındaki yerleşimleri aşağıdaki gibidir 1 H 1 s 1 2 Elektronların element atomlarındaki yerleşimleri aşağıdaki gibidir; [1 H] = 1 s 1 [2](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-13.jpg)
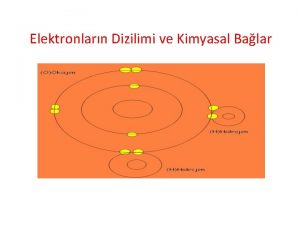
Elektronların element atomlarındaki yerleşimleri aşağıdaki gibidir; [1 H] = 1 s 1 [2 He] = 1 s 2 [3 Li] = 1 s 2 2 s 1 [5 B] = 1 s 2 2 p 1 [6 C] = 1 s 2 2 p 2 [9 F] = 1 s 2 2 p 5 [10 Ne] = 1 s 2 2 p 6 [11 Na] = [Ne] 3 s 1 [12 Mg] = [Ne] 3 s 2 [13 Al] = [Ne] 3 s 2 3 p 1 [14 Si] = [Ne] 3 s 2 3 p 2 [18 Ar] = [Ne] 3 s 2 3 p 6 [19 K] = [Ar] 4 s 1 [20 Ca] = [Ar] 4 s 2

Geçiş elementlerinde; 21 numaralı Skandiyum ile başlayan ve 10 arlı üç sıra halinde periyodik sistemde yer alan geçiş elementlerinde elektronlar öncelikle üst seviyelerine girmiş daha sonra alt enerji seviyelerine girmiştir. Geçiş elementlerinin 1. sırasında bulunan elementlerin atomlarında elektronlar önce 4 s yörüngesine girmiş ve doldurmuş daha sonra 3 d orbitallerine elektronlar girmeye başlamışlardır: [21 Sc] = [Ar] 4 s 2 3 d 1 [23 V] = [Ar] 4 s 2 3 d 3 [24 Cr] = [Ar] 4 s 1 3 d 5 olur, [Ar] 4 s 2 3 d 4 olmaz. Çünkü d orbitallerin herbirisinde 1 er elektron olması yarı kararlı hali oluşturur. Atom yarı kararlı hale gelmeyi tercih eder.

Sonraki elektron öncelikle 4 s ‘e girer ve 4 s dolmuş olur. Mn atomu böyledir: [25 Mn] = [Ar] 4 s 2 3 d 5 Sonra elektronlar d orbitallerine girmeye devam eder; [26 Fe] = [Ar] 4 s 2 3 d 6 [28 Ni] = [Ar] 4 s 2 3 d 8 [29 Cu] = [Ar] 4 s 1 3 d 10 olur, [Ar] 4 s 2 3 d 9 olmaz. Çünkü d orbitallerin herbirisinde 2 şer elektron olması tam kararlı hali oluşturur. Atom bu hale gelmeyi tercih eder.

Sonraki elektron öncelikle 4 s‘e girer ve 4 s dolmuş olur. Geçiş elementlerinin birinci sırasındaki son element çinkonun atomik yapısı böyledir: [30 Zn] = [Ar] 4 s 2 3 d 10 Sonra 4 p orbitallerine elektronlar yerleşmeye başlar: [31 Ga] = [Ar] 4 s 2 3 d 10 4 p 1 [32 Ge] = [Ar] 4 s 2 3 d 10 4 p 2 [36 Kr] = [Ar] 4 s 2 3 d 10 4 p 6 [37 Rb] = [Kr] 5 s 1 [38 Sr] = [Kr] 5 s 2
![Sonra Geçiş elementlerinin ikinci sırası gelir Geçiş elementlerinin genel özellikleri gözlenmeye başlar 39 Y Sonra Geçiş elementlerinin ikinci sırası gelir. Geçiş elementlerinin genel özellikleri gözlenmeye başlar. [39 Y]](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-17.jpg)
Sonra Geçiş elementlerinin ikinci sırası gelir. Geçiş elementlerinin genel özellikleri gözlenmeye başlar. [39 Y] = [Kr] 4 d 1 5 s 2 [40 Zr] = [Kr] 4 d 2 5 s 2 [41 Nb] = [Kr] 4 d 4 5 s 1 ([41 Nb] = [Kr] 4 d 3 5 s 2 olmaz) sonra d ye girer: [42 Mo] = [Kr] 4 d 5 5 s 1 [43 Tc] = [Kr] 4 d 5 5 s 2 [44 Ru] = [Kr] 4 d 7 5 s 1 ([44 Ru] = [Kr] 4 d 6 5 s 2 olmaz) sonra d ye girer: [45 Rh] = [Kr] 4 d 8 5 s 1 [46 Pd] = [Kr] 4 d 10 [47 Ag] = [Kr] 4 d 10 5 s 1 [48 Cd] = [Kr] 4 d 10 5 s 2
![Sonra 4 p orbitallerine elektronlar yerleşmeye başlar 49 In Kr 4 d 10 Sonra 4 p orbitallerine elektronlar yerleşmeye başlar: [49 In] = [Kr] 4 d 10](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-18.jpg)
Sonra 4 p orbitallerine elektronlar yerleşmeye başlar: [49 In] = [Kr] 4 d 10 5 s 2 5 p 1 [50 Sn] = [Kr] 4 d 10 5 s 2 5 p 2 [53 I] = [Kr] 4 d 10 5 s 2 5 p 5 [54 Xe] = [Kr] 4 d 10 5 s 2 5 p 6 [55 Cs] = [Xe] 6 s 1 [56 Ba] = [Xe] 6 s 2 [57 La] = [Xe] 6 s 2 5 d 1

Bundan sonra Lantanidler (iç geçiş elementleri) başlar ve 72 numaralı Hf ‘a kadar devam eder (14 lü sıra). f yörüngelerine elektronlar girmeye başlar: [58 Ce] = [Xe] 4 f 1 5 d 1 6 s 2 [59 Pr] = [Xe] 4 f 3 6 s 2 ([59 Pr] = [Xe] 4 f 2 5 d 1 6 s 2 olmaz) [60 Nd] = [Xe] 4 f 4 6 s 2 [62 Sm] = [Xe] 4 f 6 6 s 2
![63 Eu Xe 4 f 7 6 s 2 64 Gd Xe [63 Eu] = [Xe] 4 f 7 6 s 2 [64 Gd] = [Xe]](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-20.jpg)
[63 Eu] = [Xe] 4 f 7 6 s 2 [64 Gd] = [Xe] 4 f 7 5 d 1 6 s 2 ([64 Gd] = [Xe] 4 f 8 6 s 2 olmaz) [65 Tb] = [Xe] 4 f 9 6 s 2 [66 Dy] = [Xe] 4 f 10 6 s 2 [71 Lu] = [Xe] 4 f 14 5 d 1 6 s 2 Sonra Geçiş elementlerinin 3. sırası başlar: [72 Hf] = [Xe] 4 f 14 5 d 2 6 s 2 [77 Ir] = [Xe] 4 f 14 5 d 7 6 s 2 [78 Pt] = [Xe] 4 f 14 5 d 9 6 s 1 ([78 Pt] = [Xe] 4 f 14 5 d 8 6 s 2 olmaz) [79 Au] = [Xe] 4 f 14 5 d 10 6 s 1 [80 Hg] = [Xe] 4 f 14 5 d 10 6 s 2 olur ve geçiş elementlerinin 3. Sırası tamamlanır.
![Sonra p orbitallerine elektronlar girer 81 Tl Xe 4 f 14 5 d Sonra p orbitallerine elektronlar girer: [81 Tl] = [Xe] 4 f 14 5 d](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-21.jpg)
Sonra p orbitallerine elektronlar girer: [81 Tl] = [Xe] 4 f 14 5 d 10 6 s 2 6 p 1 [82 Pb] = [Xe] 4 f 14 5 d 10 6 s 2 6 p 2 [85 At] = [Xe] 4 f 14 5 d 10 6 s 2 6 p 5 [86 Rn] = [Xe] 4 f 14 5 d 10 6 s 2 6 p 6 Sonra 7 s orbitallerine elektronlar girer: [87 Fr] = [Rn] 7 s 1 [88 Ra] = [Rn] 7 s 2 [89 Ac] = [Rn] 6 d 1 7 s 2

Sonra Aktinidler (iç geçiş elementleri) başlar ve 104 numaralı Rf ‘ye kadar f orbitallerine elektronlar girer: [90 Th] = [Rn] 6 d 2 7 s 2 [91 Pa] = [Rn] 5 f 2 6 d 1 7 s 2 [92 U] = [Rn] 5 f 3 6 d 1 7 s 2 [94 Pu] = [Rn] 5 f 6 7 s 2 ([94 Pu] = [Rn] 5 f 5 6 d 1 7 s 2 olmaz) [95 Am] = [Rn] 5 f 7 7 s 2 [96 Cm] = [Rn] 5 f 7 6 d 1 7 s 2 ([96 Cm] = [Rn] 5 f 8 7 s 2 olmaz) [97 Bk] = [Rn] 5 f 9 7 s 2 ([97 Bk] = [Rn] 5 f 8 6 d 1 7 s 2 olmaz) [98 Cf] = [Rn] 5 f 10 7 s 2 [102 No] = [Rn] 5 f 14 7 s 2 [103 Lr] = [Rn] 5 f 14 6 d 1 7 s 2 [104 Rf] = [Rn] 5 f 14 6 d 2 7 s 2

Asal gazlarda En dış yörüngeleri elektronlar tarafından doldurulduğu için kararlı bir yapıya sahiptirler. Başka element atomları ile ortaklık yapma gereksinimleri yoktur. Dolayısıyla başka elementler ile bazı istisnalar dışında bileşik meydana getirmezler. Oktet kuralı (8 li) geçerlidir ve son yörüngelerinde 8 elektron bulunur (He hariç). [2 He] = 1 s 2 [10 Ne] = [He] 2 s 2 2 p 6 [18 Ar] = [Ne] 3 s 2 3 p 6 [36 Kr] = [Ar] 3 d 10 4 s 2 4 p 6 [54 Xe] = [Kr] 4 d 10 5 s 2 5 p 6 [86 Rn] = [Xe] 4 f 14 5 d 10 6 s 2 6 p 6
![Alkali metallerde son yörüngelerdeki s orbitallerinde birer elektron vardır 3 Li He 2 Alkali metallerde, son yörüngelerdeki s orbitallerinde birer elektron vardır: [3 Li] = [He] 2](https://slidetodoc.com/presentation_image_h/ac4b8714f4b6533542bef5760d316a03/image-24.jpg)
Alkali metallerde, son yörüngelerdeki s orbitallerinde birer elektron vardır: [3 Li] = [He] 2 s 1 [11 Na] = [Ne] 3 s 1 [19 K] = [Ar] 4 s 1 [37 Rb] = [Kr] 5 s 1 [55 Cs] = [Xe] 6 s 1 [87 Fr] = [Rn] 7 s 1

Toprak alkali metallerde 4 numaralı Be ile başlayıp aşağıya doğru 88 numaralı Radyum’a kadar dizilen bu grup elementlerin atomlarında; son yörüngelerdeki s orbitallerinde ikişer elektron vardır: [4 Be] = [He] 2 s 2 [12 Mg] = [Ne] 3 s 2 [20 Ca] = [Ar] 4 s 2 [38 Sr] = [Kr] 5 s 2 [56 Ba] = [Xe] 6 s 2 [88 Ra] = [Rn] 7 s 2

Halojenlerde 9 numaralı F ile başlayıp aşağıya doğru 85 numaralı Astatin’e kadar dizilen bu grup elementlerin atomlarında; son yörüngelerdeki p orbitallerinde beşer elektron vardır: [9 F] = [He] 2 s 2 2 p 5 [17 Cl] = [Ne] 3 s 2 3 p 5 [35 Br] = [Ar] 4 s 2 3 d 10 4 p 5 [53 I] = [Kr] 4 d 10 5 s 2 5 p 5 [85 At] = [Xe] 4 f 14 5 d 10 6 s 2 6 p 5

Atomik yapıdan elektron ayrıldığında yani iyonlaşma meydana geldiğinde; ayrılan elektronlar en dış yörüngedeki elektronlardır. Aufbau prensibine göre geçiş elementlerinde olduğu gibi iç enerji seviyelerinde boşluk varken elektronlar önce dış yörüngeye girmekte daha sonra iç enerji seviyelerine girmektedirler. Elektronlar ayrılırken öncelikle en dış yörüngede bulunan elektronlar ayrılır. Örneğin; Titanyum’un elektronik konfigürasyonu [22 Ti] = [Ar] 4 s 2 3 d 2 şeklindedir. Ti 2+ iyonu meydana gelirken ayrılan 2 elektron sonradan girdiği 3 d yörüngesinden değil en dış yörünge olan 4 s den ayrılmaktadır [Ti 2+] = [Ar] 3 d 2 olur.

ATOM YARIÇAPI Elektron bulutları keskin bir sınıra sahip değillerdir. Fakat atomlar katıları veya molekülleri oluşturmak üzere bir araya geldiklerinde, çekirdekleri arasında belli bir uzaklık bulunmaktadır. Bir elementin atom yarıçapı; komşu iki atomun çekirdekleri arasındaki uzaklığın yarısıdır. Atom yarıçapını oluşturan iki faktör vardır; - Elektronların enerji seviyelerine yerleşmesi - Elektron ile çekirdek arasındaki çekim kuvveti Peryodik sistemde atom yarıçapları soldan sağa doğru gidildikçe azalır, yukarıdan aşağıya doğru artar. Atom çapının sağa doğru azalması: hem (+) hem de (-) yüklerin miktarı arttığı için çekim kuvveti artar ve yarıçap normalden küçük olur.

�Yukarıdan aşağıya inildikçe atom yarıçapının artmasının nedeni, atom numaralarının artması nedeniyle aralarındaki farkın büyümesidir. �Dış enerji seviyelerine elektron yerleştikçe çekirdeğin en dış yörüngeye uygulayacağı çekim kuvveti daha azalır. Çünkü oradaki elektronlar engelleme özelliği gösterirler.

Atom numarası: Periyodik sistemde sağa doğru gidişte atom numarası teker artarken aşağıya doğru fazla sayıda artar. Atom numarasının artışı elektronların daha üst enerji seviyelerine girmesi anlamına gelmektedir. En dış yörüngedeki elektron ile çekirdek arasındaki mesafe sağa doğru azalırken aşağıya doğru daha fazla artacaktır. Çekirdek ile elektronlar arasındaki çekim: Atom numarasının artması atomdaki elektron sayısının ve çekirdekteki proton sayısının da artması demektir. Böylece çekirdeğin, en dış yörüngedeki elektrona uygulayacağı elektrostatik çekim gücü (yani + yük ile – yük arasındaki çekim gücü) ‘ün artması demektir.

�Ama çok fazla sayıda elektronun yörüngelere yerleşmesi daha iç enerji seviyelerinde elektronların fazla sayıda bulunması demektir. �Bu da en dıştaki elektrona çekirdeğin uyguladığı çekimin önünü kesecektir. �Bu sayılan faktörler ışığında; atom yarıçapının periyodik sistemde sağa doğru gidildikçe azalmasının nedeni: �Artan elektron ve proton sayısı nedeniyle aralarındaki elektrostatik çekim gücü nedeniyle son yörüngedeki elektronun çekirdeğe daha fazla çekilmesidir:

� 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne � 3 4 5 6 7 8 9 10 (Toplam elektron) � �Örneğin: � 3 Li …… 5 B . . …. 9 F �Yarıçap: 1. 23 Ao 0. 80 Ao 0. 72 Ao

� Atom yarıçapının periyodik sistemde aşağı doğru gidildikçe artmasının nedeni ise elektronların daha dış yörüngelere girmesi ve en dış yörüngedeki elektronun çekirdekten daha uzakta bulunmasıdır. �Ayrıca aynı yüklü elektronların birbirlerini itmesi de bu genişlemeye etki eden başka bir faktördür.

Lantanit büzülmesi: �Lantanitler sırasındaki elementlerde gözlenir. �İç geçiş elementlerinde (n-2)f elektronları, bu orbitaller daha dağınık olduğundan, ns elektronlarını etkin şekilde perdeleyemez ve bu nedenle yarıçaplarında düzenli bir küçülme olur ve buna lantanit büzülmesi adı verilir.

Ao olarak: La Ce Pr Nd Pm Sm Eu Gd Tb 1. 69 1. 65 1. 64 – 1. 66 1. 85 1. 61 1. 59 Dy Ho Er Tm Yb Lu 1. 59 1. 58 1. 57 1. 56 1. 70 1. 50

İYONLAŞMA POTANSİYELİ (ENERJİSİ) � Temel haldeki bir atomdan bir elektronun uzaklaştırılabilmesi için verilmesi gerekli enerjiye denir. � İyonlaşma potansiyeli genellikle e. V olarak ölçülür. Bu potansiyelin (1 e. V) değeri atom başına 3, 829 x 10 -20 kaloridir. Atom gram başına ise; 6, 02 x 1023 x 3, 829 x 10 -20 = 23, 06 Kcal dir. İyonlaşma potansiyeli peryodik sistemde sağa doğru gidildikçe artar. Aşağıya doğru inildikçe azalır.

1. Elektronların enerji seviyelerine yerleşmesi 2. Çekirdek ile en dış yörüngedeki elektronlar arasındaki çekim kuvveti azalır 3 Li (5. 4 e. V) artar 10 Ne (21. 6 e. V) 11 Na (5. 1 e. V) 18 Ar (15. 8 e. V) 55 Cs (3. 9 e. V) 86 Ra (10. 7 e. V)

Elektron Affinitesi (Elektron ilgisi) • Atomların elektron alabilme özelliğidir. Nötral bir atom bir elektron aldığı zaman açığa çıkardığı enerjiye elektron ilgisi denir. • Örneğin halojenürler için elektron ilgi değerleri F- 3. 6 Cl- 3. 75 Br- 3. 53 I- 3. 2

• Peryodik sistemde sağa doğru gidildikçe elektron ilgisi artar. Bu artmanın nedeni proton sayısının artmasıdır. • Yukarıdan aşağıya inildikçe kabuk sayısının artması nedeniyle elektron ilgisi azalır.
 Kuantum sayıları çıkmış sorular
Kuantum sayıları çıkmış sorular Otozomal resesif pedigri
Otozomal resesif pedigri Herkes karakterinin gereğini sergiler
Herkes karakterinin gereğini sergiler Yarım dalga kontrolsüz doğrultucu
Yarım dalga kontrolsüz doğrultucu Balmer serisi dalga boyu hesaplama
Balmer serisi dalga boyu hesaplama Salınımlı su sütunu
Salınımlı su sütunu Kare dalga inverter
Kare dalga inverter Tam dalga
Tam dalga Sonar boyuna dalga mı
Sonar boyuna dalga mı Kısa dalga boylu gözle görülmeyen ışık
Kısa dalga boylu gözle görülmeyen ışık Lantanit büzülmesi
Lantanit büzülmesi Light ray chart
Light ray chart Retmen
Retmen Iki diyotlu tam dalga doğrultma devresi
Iki diyotlu tam dalga doğrultma devresi Ali kuşçu
Ali kuşçu Elektronun kinetik enerjisi
Elektronun kinetik enerjisi 3 fazlı kontrollü tam dalga doğrultucu matlab
3 fazlı kontrollü tam dalga doğrultucu matlab Kounin modeli dalga etkisi
Kounin modeli dalga etkisi Cra laguna dalga
Cra laguna dalga Dalga çeşitleri
Dalga çeşitleri 3 6 12 24 örüntüsünün kuralı
3 6 12 24 örüntüsünün kuralı Gerçek sayılar kümesi
Gerçek sayılar kümesi Kareköklü sayılarda çarpma işlemi
Kareköklü sayılarda çarpma işlemi Uyuşan sayıları kullanma
Uyuşan sayıları kullanma Dört veya daha çok basamaklı sayıların yazımı
Dört veya daha çok basamaklı sayıların yazımı Mutlak değeri sıfıra eşit olan tam sayı
Mutlak değeri sıfıra eşit olan tam sayı Asal saylar
Asal saylar Rasyonel sayıları sayı doğrusunda gösterme
Rasyonel sayıları sayı doğrusunda gösterme Paydayı ters çevirme
Paydayı ters çevirme Doğru orantı
Doğru orantı Uyuşan sayıları kullanma
Uyuşan sayıları kullanma Organellerin zar sayıları
Organellerin zar sayıları Panjang gelombang de broglie
Panjang gelombang de broglie Atom yarıçapı nasıl artar
Atom yarıçapı nasıl artar Model atom
Model atom Bilangan kuantum 20ca
Bilangan kuantum 20ca Zordur
Zordur Kelebihan dan kekurangan model atom mekanika kuantum
Kelebihan dan kekurangan model atom mekanika kuantum Pengisian elektron menurut aufbau adalah
Pengisian elektron menurut aufbau adalah Democratus ruinus
Democratus ruinus