3 ATOMUN ELEKTRON YAPISI Dalga mekanii Kuantum saylar





































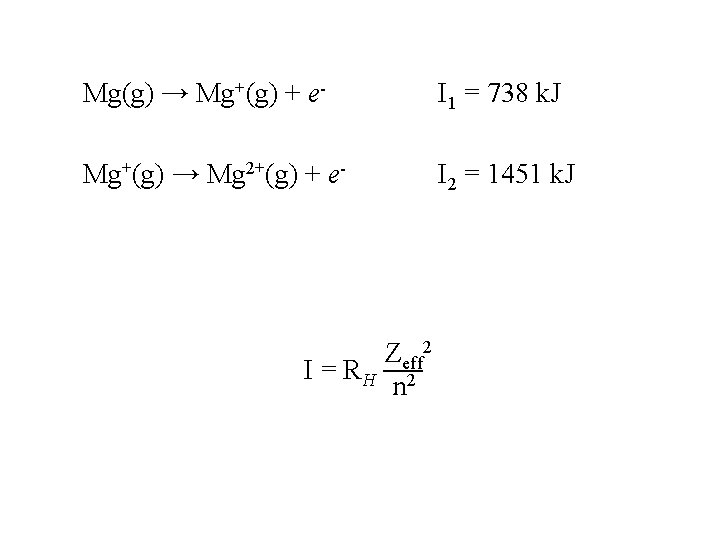







- Slides: 59

3 -ATOMUN ELEKTRON YAPISI Dalga mekaniği, Kuantum sayıları (baş kuantum sayısı, açısal kuantum sayısı, manyetik kuantum sayısı, elektron spin kuantum sayısı), Atomik orbitaller (s orbitalleri, p orbitalleri ve d orbitalleri). Orbitallerin dolduruluşu ve hund kuralı, elementlerin elektronik yapıları, yarı dolmuş ve tam dolmuş alt kabuklar, Element türleri

Madde ve Dalga Modern kuantum mekaniği 1924 yılında Louis de Broglie’nin dalga-tanecik eşleşmesi kuralıyla başlar. Buna göre bütün hareketli taneciklere pilot dalga denilen bir dalga eşlik eder ve bu dalganın dalga boyu aşağıdaki bağıntıyla verilir:

Belirsizlik Kuralı 1927’de Heisenberg, elektronun çekirdek etrafında bulunacağı yerin Bohr’un önerdiği yörüngeler üzerinde kesinlikle bilinemeyeceğini bildirdi.

Schrödinger Denklemi Heisenberg’in belirsizlik kuralına göre elektronun atomun çekirdeği etrafında “nerede” bulunduğundan değil, “ne kadar olasılıkla nerede”bulunduğundan sözedilebilir.

Schrödinger dalga denklemi

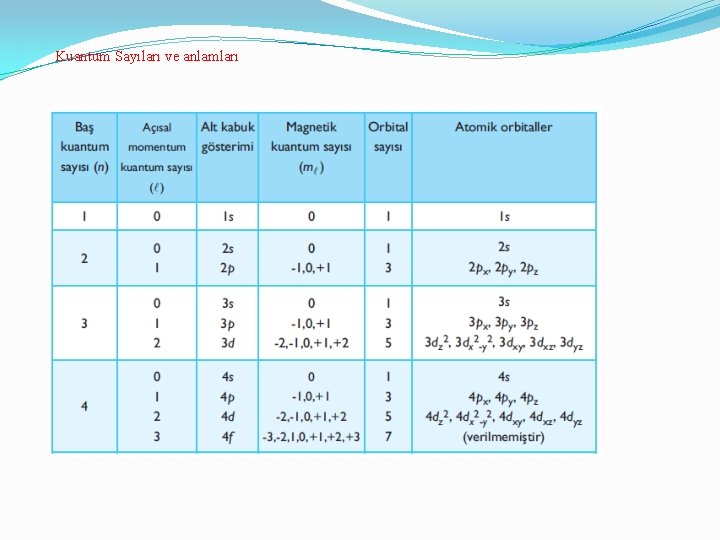
Kuantum Sayıları Schrödiner denklemi polar koordinatlara göre çözüldüğü zaman eşitliğin sol tarafı radyal (çapla ilgili) fonksiyon, sağ tarafı açısal fonksiyona eşit olur. Radyal fonksiyonun çözümünden baş kuantum sayısı (n) ve açısal fonksiyonun çözümünden de alt kabuk (azümütal) (l) ve orbital magnetik, ml kuantum sayıları elde edilir.

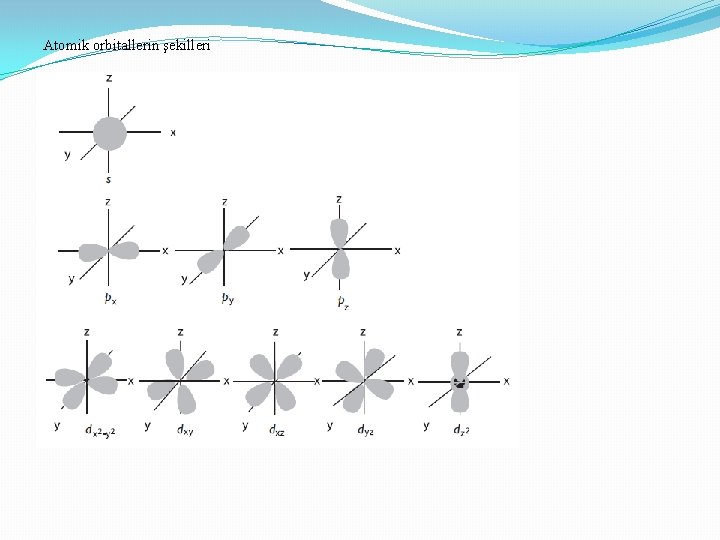
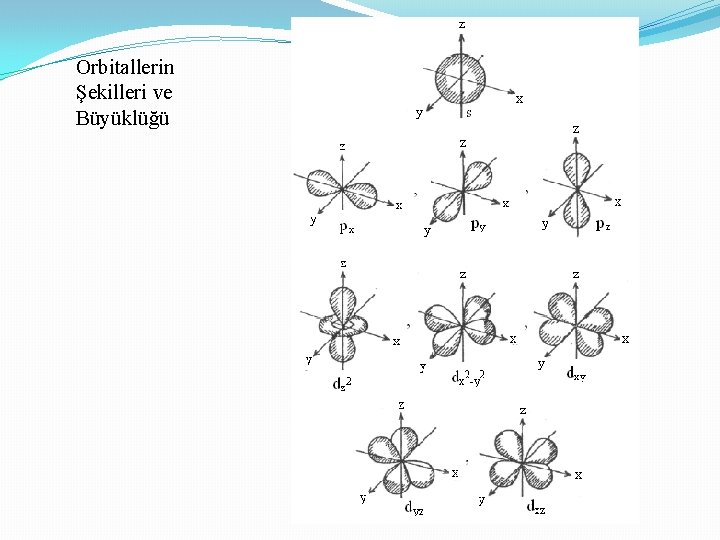
1 - Baş kuantum sayısı (n), tabaka (kabuk, yörünge) numarasını belirleyen sayıdır. 1, 2, 3, 4, . . . gibi sayı değerlerini alabilir. 2 -İkincil kuantum sayısı, (açısal momentom kuantum sayısı, azimuthal kuantum sayısı (l) n-1 değerini alır 0, 1, 2, . . . , Orbitalin şeklini belirler l =0 s orbitali l =1 p orbitali l =2 d orbitali l = 3 f orbitali 3 -Manyetik kuantum sayısı ml l ye bağlıdır -l den + l ye kadar değerleri alır 4 - Spin kuantum sayısı (s) 1/2 veya -1/2 değerini alır (ektronun kendi ekseni etrafında dönüşünü ifade eder.

Kuantum Sayıları ve anlamları


Atomik orbitallerin şekilleri

Orbitallerin Şekilleri ve Büyüklüğü

Elektronların Orbitallere Yerleşim Düzeni


Hund Kuralı Aynı enerji seviyeli orbitallerin her biri birer elektrona sahip olmadan önce orbitallerden herhangi biri iki elektrona sahip olamaz. Pauli Dışarlama (exclusion) Kuralı Bir atomda 4 kuantum sayısı aynı olan iki elektron olamaz. En az bir kuantum sayısının farklı olması gerekir. Bir okulda, fakültesi, bölümü numarası adı soyadı aynı olan iki öğrenci olamaz. .


Elektron dağılımının sayılarla gösterimi: C: 1 s 2 2 p 2 6 Elektron dağılımının sayılarla gösterimi:







Magnetik Özellikler Çiftleşmemiş elektronlara sahip maddelerin gösterdiği manyetik alana doğru çekilme özelliğine paramagnetizma denir. Bunun zıddı özellik diamagnetizmadır. Yani bütün elektronları çiftleşmiş maddelerin gösterdiği magnetik alan tarafından itilmesi özelliğine diamagnetizma denir. Paramagnetizma sadece dışarıdan bir magnetik alan uygulandığı zaman gözlenen bir özelliktir. Birde kobalt, nikel, demir gibi metallerin dışarıdan bir magnetik alan uygulanmadığı halde kendiliğinden magnetik özellik göstermesi özelliği vardır ki buna da ferromagnetizma denir.

Prentice-Hall © 2002 General Chemistry: Chapter 10 Slide 24 of 35

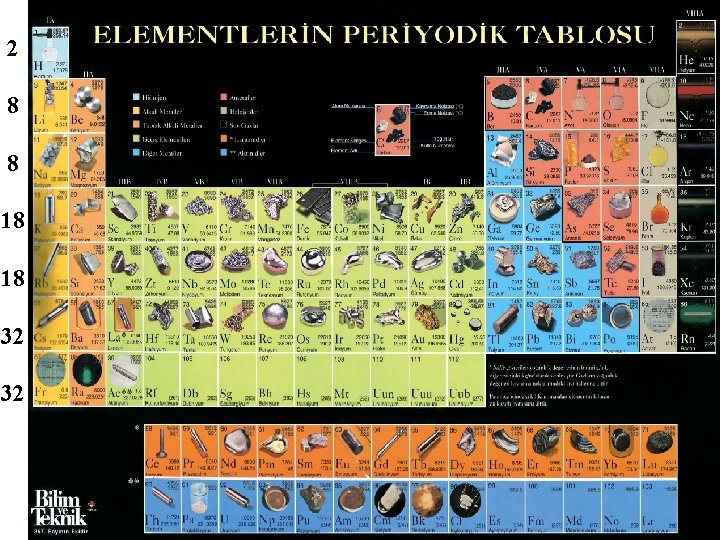
Atom Nnumarası ve Periyodik Tablo (Elementlerin Düzenli Sıralanışı) Elementlerin özelliklerini daha kolay incelemek için sınıflandırma ve düzenleme ihtiyacı hissedilmiştir. Bir coğrafyacı için harita ne ise kimyacı için de periyodik cetvel aynıdır. Bir bölgenin haritadaki yeri bilinirse, özellikleri, iklimi, ulaşımı, rakımı, vb özellikleri tahmin edilir. Elementlerin periyodik cetveldeki yeri bilinirse özellikleri daha kolay anlaşılır.

Elementleri belli bir düzen içerisinde ilişkilendirebilmek için 1817 -1829 yılları arasında Johann W. Döbereiner elementlerin “triadlar” (üçerli guruplar) adı verilen seriler halinde sınıflandırılabileceğini ileri sürdü. Burada her seri birbirine benzeyen özelliklerdeki elementlerden oluşup, serilerdeki ikinci elementin atom ağırlığı yaklaşık olarak serideki diğer iki elementin ağırlıkları ortalamasına eşittir. Fakat çok geçmeden bu sistemin bir çok elemente uymadığı görülmüş ve terk edilmiştir.

1863 -1866 yılları arasında John A. R. Newlands müzik notalarından yola çıkarak “oktavlar yasası” adı altında bir sistem önerip geliştirdi. Bu yasaya göre elementler ağırlıkları artış sırasına göre dizildiklerinde sekizinci element birinciye, dokuzuncu element ikinciye vs. benziyor ve bu durum müzikteki oktavlar şeklinde böylece devam ediyordu. Fakat gerçekte ilişki bu kadar basit değildi ve o zamana kadar bir çok element daha bulunmamıştı. Newlands’ın çalışmaları dayanıksız bulunmuş ve çok ciddiye alınmamıştır.

Elementlerin modern periyodik sınıflandırılması Almanya’dan J. Lothar Meyer (1869) ve özellikle de Rusya’dan Dimitri Mendeleev’in (1869) yaptığı çalışmalara dayanmaktadır. Mendeleev, elementleri atom ağırlıklarındaki artışa göre incelediğinde özelliklerindeki benzerliklerin periyodik olarak tekrarlandığını gördü. Benzer elementleri Grup adı verilen dikey sütunlarda topladı. Henüz bulunmamış elementler için boş yer bıraktı ve bunlardan üçünün özelliklerini daha keşfedilmeden yazdı. Hemen sonra Mendeleev’in öngördüğü özelliklerin çoğuna sahip olan skandiyum, galyum ve germanyum elementlerinin keşfedilmesi periyodik sistemin doğru olduğunu tezini kuvvetlendirmiştir. Asal gazların varlığı Mendeleev tarafından öngörülmediği halde bu elementler 1892 -1898 yılları arasında bulunduğunda, periyodik sistemdeki yerlerine kolayca yerleşmişlerdir.

Mendeleev’in en önemli ve en doğru yaklaşımı, elementleri atom ağırlığı sırasına göre dizdiğinde, eğer kimyasal özellikleri uyuşmuyorsa o elementi özelliklerinin benzediği bir guruba dahil etmesidir. Bu yaklaşım o yıllara kadar keşfedilmemiş elementlerin keşfini hızlandırmıştır. Periyodik sınıflandırma daha sonraki yıllarda bir çok araştırmacı tarafından ayrıntılarıyla incelenmiş ve periyodik özelliğin atom ağırlığından çok farklı bir temel özelliğe dayandığı anlaşılmıştır.

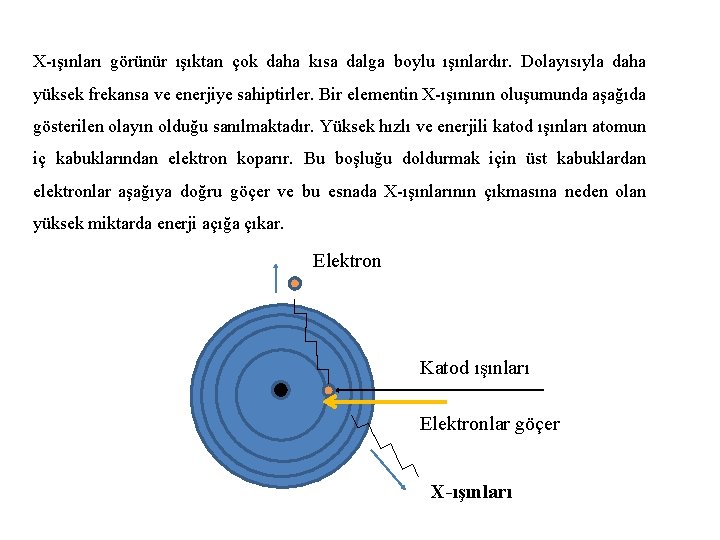
1913 -1914 yılları arasında Henry G. J. Moseley yaptığı çalışmalarla bu problemi tamamen çözmüştür. Moseley yüksek hızlı katod ışınlarını, hedef olarak koyduğu metallere odaklamış ve X-ışınları elde etmiş ve bu ışınları prizma yardımıyla bileşenlerine ayırmış ve fotografik olarak kaydetmiştir. Hedef metali değiştirdikçe elde ettiği X-ışınlarının çizgi spektrumlarının özelliklerinin değiştiğini gözleyen Moseley, bir elementten elde edilen X-ışınının frekansının karekökünün, o elementin atom numarası ile orantılı olarak değiştiğini keşfetmiştir. Moseley atom numarası 13 olan alüminyum ile 79 olan altın arasında bulunan 38 elementin X -ışınları spektrumunu incelemiş ve elementlerin doğru atom numaralarını tayin edebilmiştir. Ayrıca, keşfedilmeyen 4 elementin atom numaralarını da belirlemiştir. Moseley’in çalışmalarına dayanarak periyodik yasa yeniden tanımlanmıştır.

Bu tanıma göre, Periyodik yasa “Elementlerin fiziksel ve kimyasal özellikleri atom numaralarının periyodik fonksiyonudur“ şeklinde değiştirilmiştir. 1887 -1915


X-ışınları görünür ışıktan çok daha kısa dalga boylu ışınlardır. Dolayısıyla daha yüksek frekansa ve enerjiye sahiptirler. Bir elementin X-ışınının oluşumunda aşağıda gösterilen olayın olduğu sanılmaktadır. Yüksek hızlı ve enerjili katod ışınları atomun iç kabuklarından elektron koparır. Bu boşluğu doldurmak için üst kabuklardan elektronlar aşağıya doğru göçer ve bu esnada X-ışınlarının çıkmasına neden olan yüksek miktarda enerji açığa çıkar. Elektron Katod ışınları Elektronlar göçer X-ışınları

2 8 8 18 18 32 32

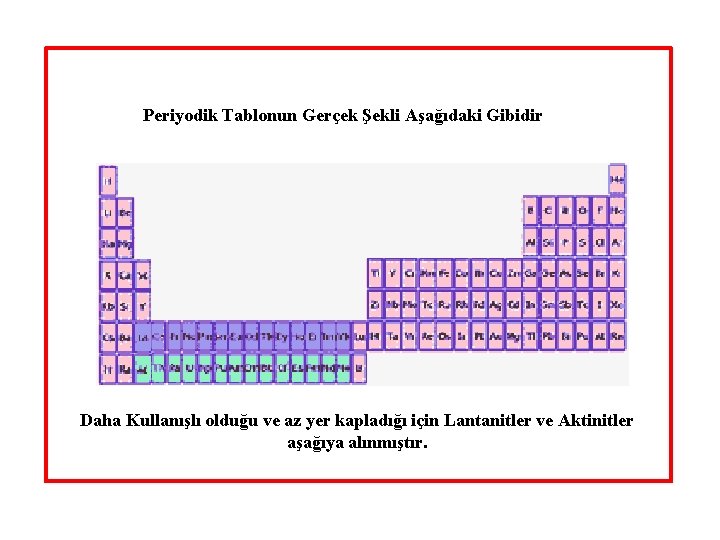
Periyodik Tablonun Gerçek Şekli Aşağıdaki Gibidir Daha Kullanışlı olduğu ve az yer kapladığı için Lantanitler ve Aktinitler aşağıya alınmıştır.

Periyodik tabloda yatay şekilde dizilen elementlerin oluşturduğu satırlara periyodlar, benzer fiziksel ve kimyasal özelliklere sahip olan elementlerin oluşturduğu sütunlara ise gurup adı verilir. Bu çizelgede lantan ve aktinyumun bulunduğu periyotların 32 element içermesi gerekmektedir. Bu sırada bulunması gereken elementler periyodik tablonun şeklini değiştirdiğinden bu elementler periyodik tablonun altında lantanitler (58 -71) ve aktinitler (90 -103) olarak iki sıra halinde verilmiştir. Aktinitler henüz tamamlanmamıştır. 1. Periyod dışında tamamlanmış olan her periyod çok aktif, hafif ve gümüş renkli bir metal olan alkali metalle başlar ve renksiz, etkin olmayan bir asal gaz ile sona erer. Tamamlanmış her periyodun asal gazdan önceki üyesi aktif bir ametal olan halojendir. Periyodik tabloda kimyasal özellikler bir elementten diğerine geçtikçe değişir.

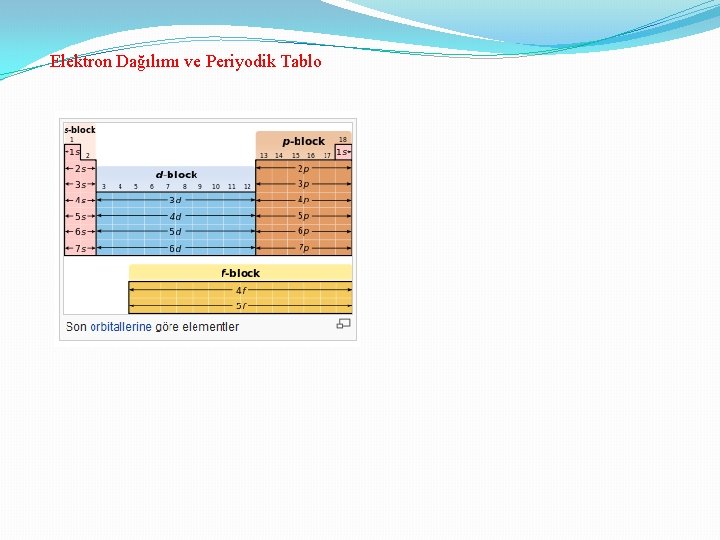
Elektron Dağılımı ve Periyodik Tablo

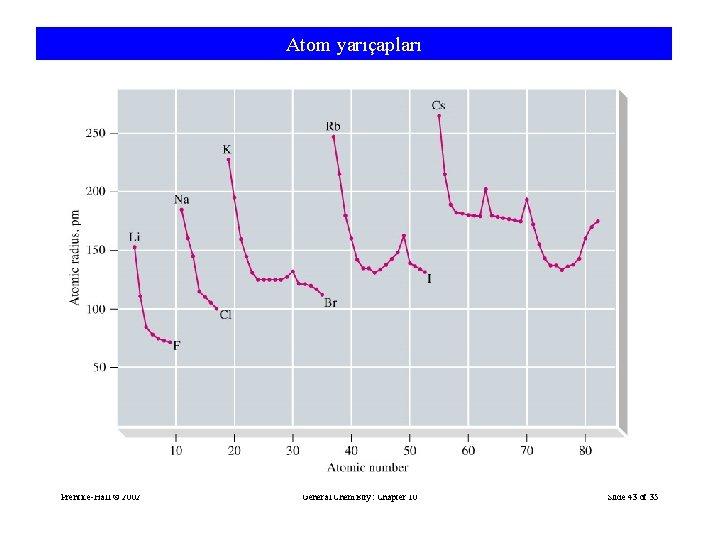
Periyodik özellikler: 1 -Atomik ve iyonik çap Atomik büyüklüğe etki eden nedenler: a- Tabaka sayısı: tabaka (kabuk) sayısı arttıkça atom çapı artar

b- Çekirdek yükü: çekirdek yükü arttıkça atom çapı azalır

Periyodik cetvelde atom çapı değişimi:


Geçiş elementlerinde atom yarıçapının değişimi Geçiş elementlerinde elektronlar daha içteki d orbitallerine girerler. Artan çekirdek yükünün çekme etkisi, içteki d orbitalleri tarafından perdelenir. Bu nedenle soldan sağa doğru atom yarıçapının azalma hızı yavaşlar. Serinin sonuna doğru d orbitallerinin dolması tamamlanırken bu kez yarıçap artmaya başlar. İç geçiş elementlerinde (Lantanitler ve aktinitler) atom yarıçapının değişimi İç geçiş elementlerinden Lantanitlerin (58 -71) atom yarıçaplarında lantanit büzülmesi adı verilen yavaş fakat düzenli bir küçülme görülür. Bu elementlerin elektronları 4 f orbitaline girerler. Bu 4 f elektronları çekirdek yükü artışını perdelerler, ama bu perdeleme en dıştaki 6 s elektronları için çok etkin değildir, bu nedenle atom yarıçapı az ama düzenli olarak azalır.

Atom yarıçapları Prentice-Hall © 2002 General Chemistry: Chapter 10 Slide 43 of 35

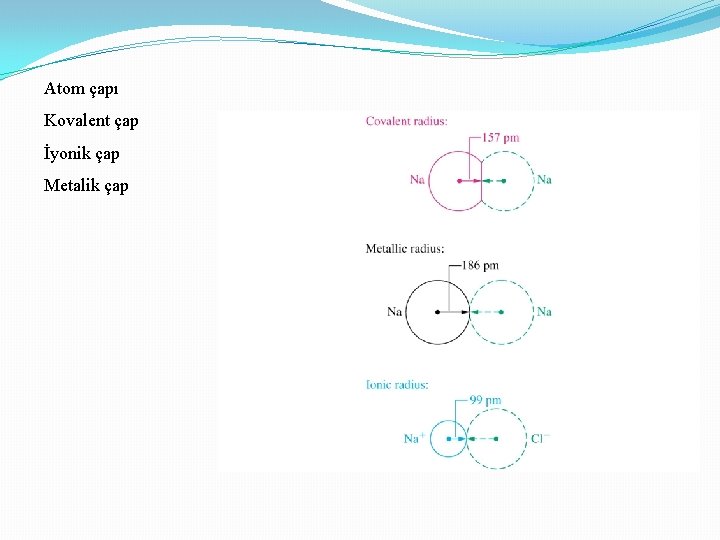
Atom çapı Kovalent çap İyonik çap Metalik çap


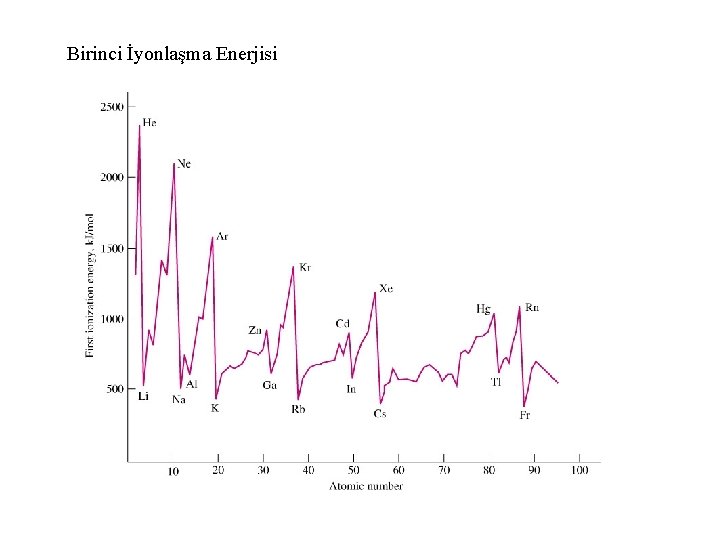
2 -İyonlaşma enerjisi Gaz halindeki bir atomdan en dıştaki elektronu (en yüksek enerjiye sahip olan elektron) çıkarabilmek için gerekli minimum enerjiye iyonlaşma enerjisi denir. İyonlaşma enerjisine: a- atom yarıçapı ↑ iyonlaşma enerjisi ↓ b-etkin çekirdek yükü ↑ iyonlaşma enerjisi ↑ c- küresel ve yarı küresel yük dağılımı ↑ iyonlaşma enerjisi ↑
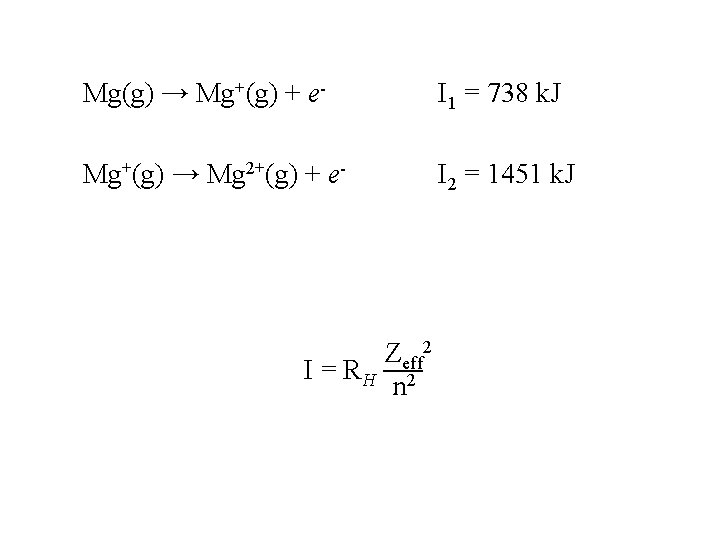
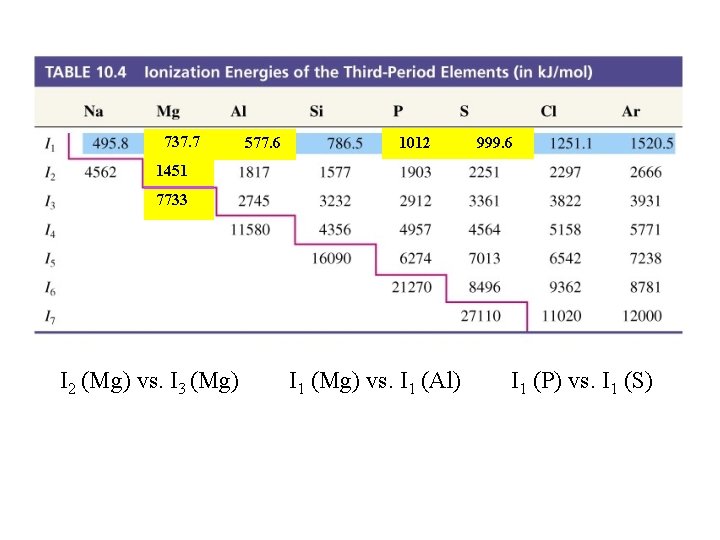
Mg(g) → Mg+(g) + e- I 1 = 738 k. J Mg+(g) → Mg 2+(g) + e- I 2 = 1451 k. J Zeff 2 I = RH 2 n

Birinci İyonlaşma Enerjisi

Table 10. 4 Ionization Energies of the Third-Period Elements (in k. J/mol) 737. 7 577. 6 1012 999. 6 1451 7733 I 2 (Mg) vs. I 3 (Mg) I 1 (Mg) vs. I 1 (Al) I 1 (P) vs. I 1 (S)

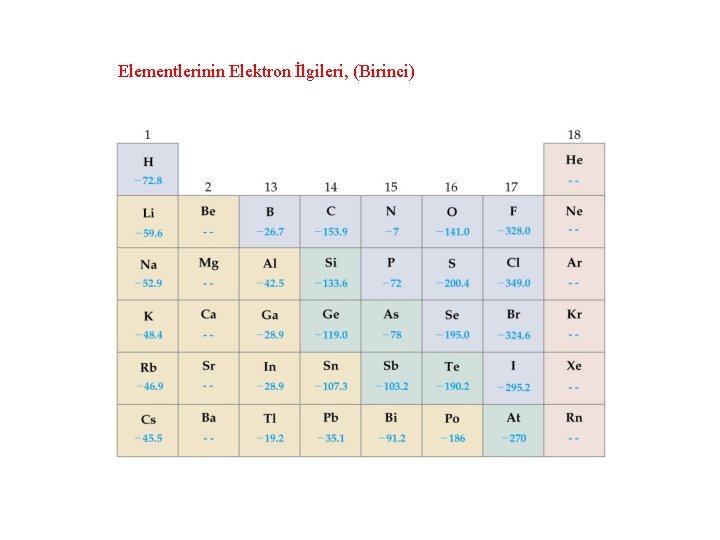
3 - Elektron ilgisi enerjisi İyonlaşma olayının aksine, gaz halindeki bir atomun bir elektronu yakalaması ile açığa çıkan enerjiye elektron ilgisi denir. Atom çapı Çekirdek yükü Küresel yük dağılımı

F(g) + e- → F-(g) EA = -328 k. J F(1 s 22 p 5) + e- → F-(1 s 22 p 5) Li(g) + e- → Li-(g) Prentice-Hall © 2002 General Chemistry: Chapter 10 EA = -59. 6 k. J Slide 51 of 35

Elementlerinin Elektron İlgileri, (Birinci)

İkinci Elektron İlgisi O(g) + e- → O-(g) EA = -141 k. J O-(g) + e- → O 2 -(g) EA = +744 k. J

• 4 - Metalik özellik • Metaller • – Elektrik ve ısıyı iletirler. – Dövülebilir, tel haline getirilebilir. – Yüksek erime noktasına sahiptirler. Ametaller – Elektrik ve ısıyı iletmezler. – Katı, kırılgandırlar. – Bazıları oda sıcaklığında gazdır. – İyonlaşma enerjileri düşük – Değerlik elektron sayısı << değerlik orbital sayısı Slide 54 o 35

Metaller elektron verme eğilimindedir.

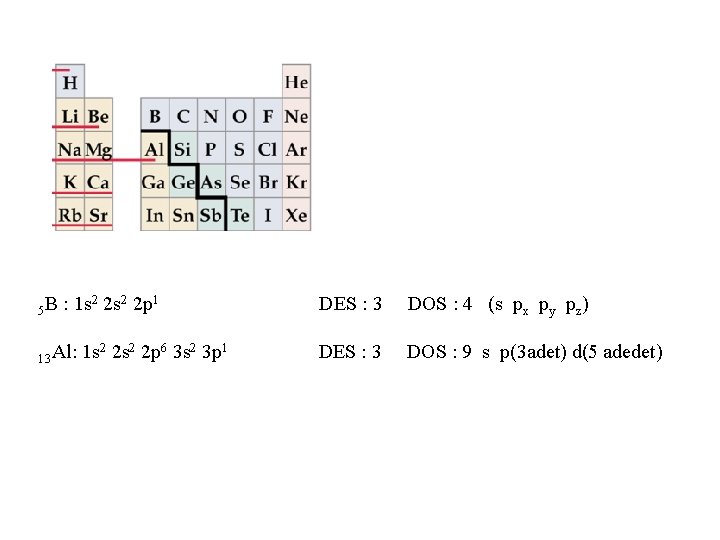
5 B : 1 s 2 2 p 1 13 Al: 1 s 2 2 p 6 3 s 2 3 p 1 DES : 3 DOS : 4 (s px py pz) DES : 3 DOS : 9 s p(3 adet) d(5 adedet)

5 - Element Oksitlerin Asit Baz Yapıları Metal oksitlerin sulu çözeltileri baz, ametal oksitlerin sulu çözeltileri asidik karakterlidir. Li 2 O(s) + H 2 O(l) → 2 Li+(aq) + 2 OH-(aq) (baz) SO 2 (g) + H 2 O(l) → H 2 SO 3(aq) (asit) O halde asit baz karakteri metalik karakter dikkate alınarak açıklanabilir

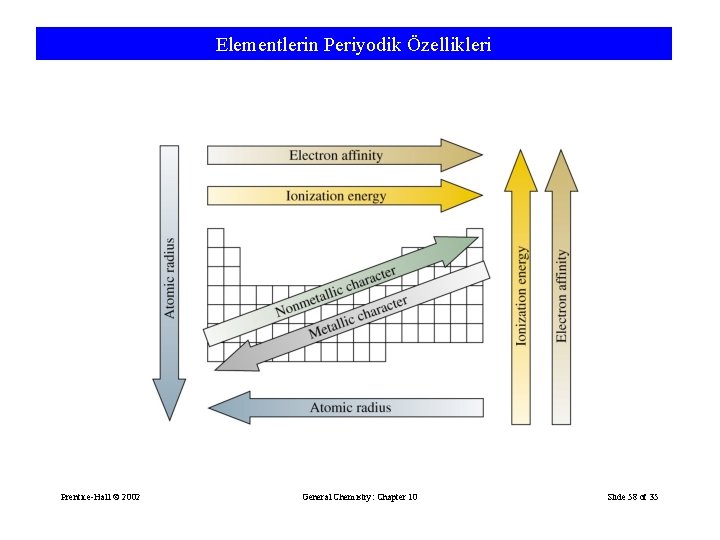
Elementlerin Periyodik Özellikleri Prentice-Hall © 2002 General Chemistry: Chapter 10 Slide 58 of 35

Bir periyotta soldan sağa doğru gidildikçe, Proton, nötron sayıları ve kütle numarası artar. Atom numarası artar. Değerlik elektron sayısı artar. Elektron alma isteği (ametalik özellik) artar. Yörünge sayısı değişmez. Atom hacmi ve çapı azalır. Bir grupta yukarıdan aşağıya inildikçe, Proton, nötron sayıları ve kütle numarası artar. Atom numarası artar. Değerlik elektron sayısı değişmez (Bu nedenle aynı gruptaki elementlerin kimyasal özellikleri benzerdir). Elektron verme isteği (metalik karakter) artar. Yörünge sayısı artar. Atom hacmi ve çapı artar.
 Atomun yapısı
Atomun yapısı Kedudukan elektron
Kedudukan elektron Atom modelleri
Atom modelleri Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Asal saylar
Asal saylar Asal saylar
Asal saylar Maynard hill
Maynard hill Tam saylar
Tam saylar Tam saylar
Tam saylar Tam saylar
Tam saylar 3 fazlı kontrollü tam dalga doğrultucu matlab
3 fazlı kontrollü tam dalga doğrultucu matlab Kare dalga inverter
Kare dalga inverter Balmer serisi dalga boyu hesaplama
Balmer serisi dalga boyu hesaplama Osprey dalga enerjisi
Osprey dalga enerjisi Kısa dalga boylu gözle görülmeyen ışık
Kısa dalga boylu gözle görülmeyen ışık Yarım dalga kontrolsüz doğrultucu
Yarım dalga kontrolsüz doğrultucu Canter modeli
Canter modeli Sonar boyuna dalga mı
Sonar boyuna dalga mı Espectro electromagnetico
Espectro electromagnetico Fotoelektrik olay
Fotoelektrik olay Tam dalga
Tam dalga Kısa dalga telsizler uzay teknolojisi
Kısa dalga telsizler uzay teknolojisi Dalga
Dalga Dalga çeşitleri
Dalga çeşitleri Kounin modeli dalga etkisi
Kounin modeli dalga etkisi Iki diyotlu tam dalga doğrultma devresi
Iki diyotlu tam dalga doğrultma devresi Cra laguna dalga
Cra laguna dalga Kelebihan teori atom mekanika kuantum
Kelebihan teori atom mekanika kuantum Kuantum öğrenme soruları
Kuantum öğrenme soruları Jelaskan yang dimaksud dengan bilangan kuantum utama
Jelaskan yang dimaksud dengan bilangan kuantum utama Zordur
Zordur Katlı oranlar kanunu
Katlı oranlar kanunu Pengisian elektron menurut aufbau adalah
Pengisian elektron menurut aufbau adalah Modern atom teorisi soru çöz
Modern atom teorisi soru çöz Fotoelektrik olay formülleri
Fotoelektrik olay formülleri Kuantum öğrenme nedir
Kuantum öğrenme nedir Bloom öğrenme kuramı
Bloom öğrenme kuramı Tentukan bilangan kuantum 25mn
Tentukan bilangan kuantum 25mn Bilangan kuantum 4p6
Bilangan kuantum 4p6 Contoh soal fungsi eigen
Contoh soal fungsi eigen Cu küresel simetrik midir
Cu küresel simetrik midir Fisika kuantum
Fisika kuantum Model atom
Model atom Teori atom modern
Teori atom modern Elektron ilgisi denklemi
Elektron ilgisi denklemi Tahıl tanesinin yapısı
Tahıl tanesinin yapısı Sferik
Sferik Sülfatidler
Sülfatidler Işletim sisteminin mantıksal yapısı
Işletim sisteminin mantıksal yapısı Soluk alıp verme mekanizması
Soluk alıp verme mekanizması Gzle
Gzle Mannoz sekeri
Mannoz sekeri Ortokromatofilik eritroblast
Ortokromatofilik eritroblast Alfabetik dosyalama
Alfabetik dosyalama Korneanın kavislenmesi
Korneanın kavislenmesi Süt inme refleksi
Süt inme refleksi Flippaz nedir
Flippaz nedir Oktet kuralından sapmalar
Oktet kuralından sapmalar Uzun kemik yapısı
Uzun kemik yapısı Karma örgüt yapısı
Karma örgüt yapısı