KIM TRA MING Nu tnh cht ha hc


























- Slides: 29


• KIỂM TRA MIỆNG: • Nêu tính chất hóa học của muối. Viết PTPƯ minh họa

BÀI 10 - TIẾT 15:

A. NATRI CLORUA:

I. Trạng thái tự nhiên Nước biển Mỏ muối 5

Trong tự nhiên muối natri clorua (muối ăn) có ở đâu? 6

I. TRẠNG THÁI TỰ NHIÊN: Trong tự nhiên muối natri clorua (muối ăn) có trong nước biển, trong lòng đất (muối mỏ ).

Trong 1 m 3 nước biển hòa tan được 27 kg Na. Cl, 5 kg Mg. Cl 2, 1 kg Ca. SO 4, và một số muối khác.

II. CÁCH KHAI THÁC:

- Cách khai thác từ nước biển: Biển Làm bay hơi nước Muối kết tinh

- Cách khai thác từ mỏ muối: Muối mỏ Ba lan Muối mỏ Peru 11

II. CÁCH KHAI THÁC: - Người ta khai thác Na. Cl từ nước mặn ở biển hoặc hồ nước mặn bằng cách cho bay hơi từ từ, ta thu được muối kết tinh. - Ở những nơi có mỏ muối, khai thác bằng cách đào hầm hoặc giếng sâu qua các lớp đất, đá đến mỏ muối. Muối mỏ sau khi khai thác, được nghiền nhỏ và tinh chế để có muối sạch.

III. ỨNG DỤNG

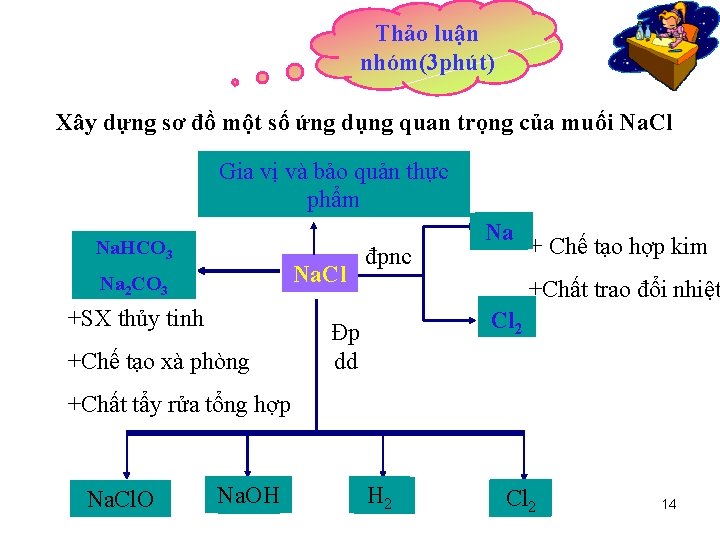
Thảo luận nhóm(3 phút) Xây dựng sơ đồ một số ứng dụng quan trọng của muối Na. Cl Gia vị và bảo quản thực (1) phẩm Na. HCO 3 (2) Na. Cl Na 2 CO 3 +SX thủy tinh +Chế tạo xà phòng đpnc (3) Na (4)2 Cl Đp dd + Chế tạo hợp kim +Chất trao đổi nhiệt +Chất tẩy rửa tổng hợp Na. Cl. O (5) Na. OH (6) H (7) 2 Cl (8)2 14

• Làm gia vị và bảo quản thực phẩm. • Dùng để sản xuất : Na; H 2; Cl 2; Na. OH; Na 2 CO 3; Na. HCO 3; Na. Cl. O. 15

Ø- Tác dụng tốt của muối ăn : Một gia vị không thể thiếu trong bữa ăn hằng ngày, bảo quản thực phẩm, làm nguyên liệu sản xuất Na. OH, Cl 2, HCl, . . . Ø- Ảnh hưởng xấu của muối ăn : Đất nông nghiệp bị nhiễm mặn làm cây trồng bị chết. Con người không thể sử dụng nước mặn trong sinh hoạt. . . . Tóm lại : Một chất bất kỳ có thể có ảnh hưởng tốt hoặc xấu hoàn toàn là do cách sử dụng của con người. 16

Mẹo vặt về muối: - Giữ cho gương sáng bóng: nếu cửa kính trong nhà bạn bị hoen ố, bạn chỉ cần lấy giẻ bọc một nhúm muối, nhúng nước cho hơi ướt, chà mạnh lên kiếng, rồi dùng khăn sạch lau khô lại, kiếng sẽ sáng loáng. - Tẩy vết khó chùi rửa ở xoong chảo: rắc muối lên chỗ dơ, để một giờ sau đó chùi rửa lại, xoong chảo sẽ sạch. 17

- Bảo quản đồ thủy tinh: khi mua về, bạn cho vào nồi nước có pha muối, nấu sôi lên. Sau đó để thật nguội rồi vớt ra và rửa lại bằng nước lã, đồ thủy tinh sẽ có thể chịu nhiệt tốt. - Tẩy quần áo dơ: vắt chanh tươi lên quần áo bị gỉ sắt, sau đó lấy muối bột rắc lên, để một đêm và giặt lại bằng xà phòng và nước lạnh. 18

III. ỨNG DỤNG - Làm gia vị và bảo quản thực phẩm. - Dùng để sản xuất : Na; H 2; Cl 2; Na. OH; Na 2 CO 3; Na. HCO 3; Na. Cl. O.

*Bài tập 1 trang 36 SGK : Có những muối sau : Ca. CO 3 ; Ca. SO 4 ; Pb(NO 3)2 ; Na. Cl. Muối nào nói trên : a) Không được phép có trong nước ăn vì tính Pb(NO 3)2 độc hại của nó ? . . b) Không độc nhưng cũng không được có trong Na. Cl nước ăn vì vị mặn của nó ? . . . c) Không tan trong nước, nhưng bị phân hủy ở Ca. CO 3 nhiệt độ cao ? . . d) Rất ít tan trong nước và khó bị phân hủy ở Ca. SO 4 nhiệt độ cao ? . .

* Bài tập 2 trang 36 SGK Hai dung dịch tác dụng với nhau, sản phẩm thu được có Na. Cl. Hãy viết 2 phương trình hóa học minh họa? Na. OH Ba. Cl 2 + + HCl Na 2 SO 4 Na. Cl + 2 Na. Cl + H 2 O Ba. SO 4 21

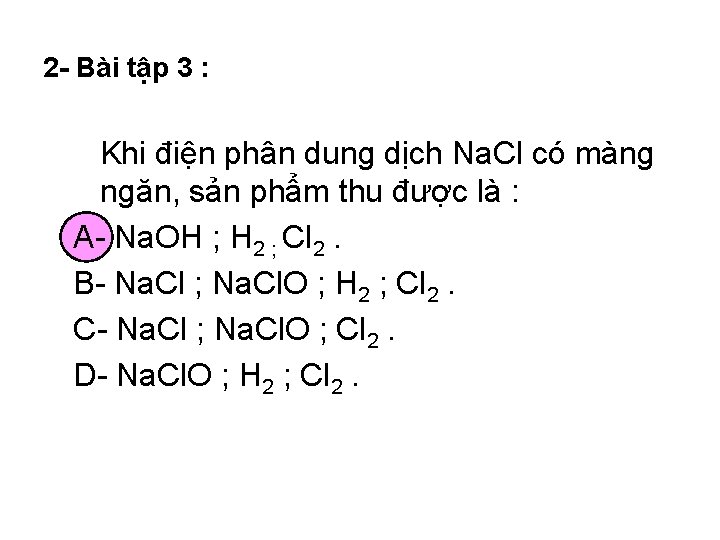
2 - Bài tập 3 : Khi điện phân dung dịch Na. Cl có màng ngăn, sản phẩm thu được là : A- Na. OH ; H 2 ; Cl 2. B- Na. Cl ; Na. Cl. O ; H 2 ; Cl 2. C- Na. Cl ; Na. Cl. O ; Cl 2. D- Na. Cl. O ; H 2 ; Cl 2.

B. PHẢN ỨNG TRAO ĐỔI

Nhận xét về các phản ứng hoá học của muối. Cu. SO 4 + Na. OH → Cu(OH)2 ↓ + 2 Na 2 SO 4 K 2 CO 3 + Ca. Cl 2 → Ca. CO 3 ↓ + 2 KCl Na 2 CO 3 + H 2 SO 4 → Na 2 SO 4 + CO 2↑ + H 2 O H 2 CO 3 *Khái niệm: Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.

Ø Các phản ứng trao đổi : Cu. SO 4 + 2 Na. OH Cu(OH)22 + Cu(OH) Na 2 SO 4 Ba. Cl 2 Ba. SO 44 Ba. SO + 2 Na. Cl Na 2 SO 4 CO 22 + CO + Na 2 SO 4 Na 2 CO 3 + H 2 SO 4 + H 2 O §iÒu kiÖn x¶y ra ph¶n øng trao ®æi lµ g×? Phản ứng trao đổi chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.

Lưu ý: Phản ứng trung hoà cũng thuộc lọai phản ứng trao đổi và luôn xảy ra.

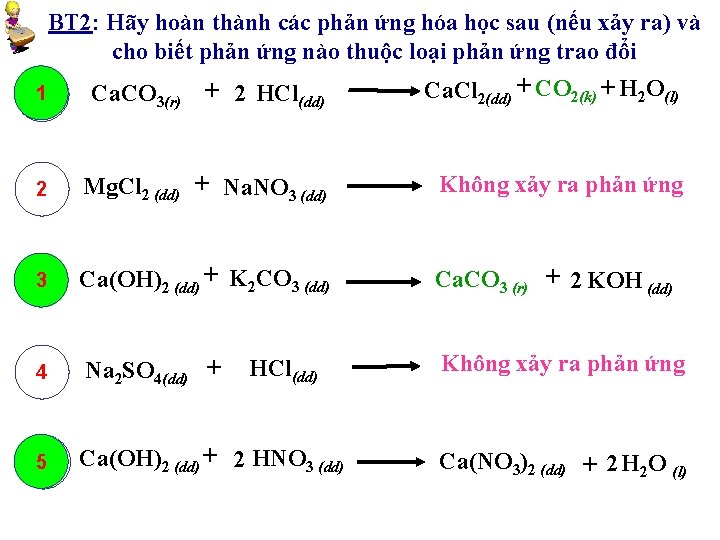
BT 2: Hãy hoàn thành các phản ứng hóa học sau (nếu xảy ra) và cho biết phản ứng nào thuộc loại phản ứng trao đổi Ca. Cl 2(dd) + CO 2(k) + H 2 O(l) + 2 HCl 1 Ca. CO 1 3(r) (dd) 2 Mg. Cl 2 (dd) + Na. NO 3 (dd) Không xảy ra phản ứng 33 Ca(OH)2 (dd) + K 2 CO 3 (dd) Ca. CO 3 (r) + 2 KOH (dd) 4 Na 2 SO 4(dd) + 5 5 Ca(OH)2 (dd) + 2 HNO 3 (dd) HCl(dd) Không xảy ra phản ứng Ca(NO 3)2 (dd) + 2 H 2 O (l)

Hướng dẫn BT 6 – sgk: a) Viết PTHH Ba. Cl 2(dd) + 2 Ag. NO 3(dd) → Ag. Cl(r) ↓ + Ca(NO 3)2 (dd) Hiện tượng quan sát được: Tạo chất rắn không tan màu trắng, lắng xuống đáy ống nghiệm, đó là Ag. Cl b) - Tính n. Ca. Cl 2 ; n. Ag. NO 3 ; lập tỉ lệ để xác định chất dư - Tính n. Ag. Cl (tính theo chất hết) => m. Ag. Cl c) - Các chất còn lại: Ca. Cl 2 dư và Ca(NO 3)2 tạo thành - Tính n. Ca. Cl 2 dư và n. Ca(NO 3)2 (tính theo chất hết) => CMCa. Cl 2 và CMCa(NO 3)2 (Vdd sau phản ứng = VCa. Cl 2 + VCa(NO 3)2 )

HƯỚNG DẪN HỌC TẬP - Học bài và làm bài tập: 3, 4 trang 36 SGK - Đọc phần : “Em có biết ? ” trang 36 SGK - Chuẩn bị bài “Phân bón hóa học” * Mỗi nhóm chuẩn bị một số mẫu phân hóa học. 29