Kemijske reakcije Spreminjanje snovi Snovi v naravi se

















- Slides: 19

Kemijske reakcije

Spreminjanje snovi Snovi v naravi se nenehno spreminjajo, zaradi prerazporejanja atomov, molekul ali ionov snovi. Med fizikalno spremembo se snov kemijsko ne spremeni oz. ne pride do nastanka nove snovi (npr. segrevanje ledu…). Če pri spremembi snovi nastane nova snov z novimi lastnostmi, rečemo, da je potekla kemijska sprememba (npr. gorenje lesa, peka kruha…). Kemijsko spremembo prepoznamo po tem, da je: v praviloma težko obrnljiva, v energija se lahko sprošča ali porablja, v nastane nova snov z novimi lastnostmi.

Zaznavanje kemijskih reakcij oz. sprememb Nastanek nove snovi spoznamo po: § spremembi barve in videza snovi, § povečanju mase (primer: snov reagira s plini iz zraka), § nastajanju saj, plina. . .

1. NASTANEK PLINA pri kemijski reakciji PECILNI PRAŠEK + KIS ZA VLAGANJE MEHURČKI (plin)

2. SPREMEMBA BARVE pri kemijski reakciji JOD (s) + ŽELEZO (s) ŽELEZOV JODID (s) Nastane ionska spojina, ki je drugačne barve (rdečerjave) in je topna v vodi. Jod in železo sta slabo topna v vodi. Reakcijo si lahko pogledate v učbeniku stran 78. Spajanje ali sinteza je kemijska reakcija, pri kateri iz dveh ali več snovi nastane ena nova snov: A + B → AB

3. NASTANEK OBORINE pri kemijski reakcijiji SVINČEV NITRAT(aq)+ KALIJEV JODID(aq) SVINČEV JODID(s) + KALIJEV NITRAT(aq) Ko se reaktanta raztapljata v vodi, nastane nova snov, ki je rumena in slabo topna v vodi, izločila se je OBORINA. Obarjanje je primer kemijske reakcije, pri kateri se iz dveh raztopin izloči (obori) trdna težko topna snov.

4. NASTANEK TRDNE SNOVI pri kemijski reakciji AMONIAK (g) + VODIKOV KLORID (g) AMONIJEV KLORID (s) Ko plina reagirata nastane oblaček belega dima, ki se čez čas usede v obliki bele trdne snovi.

5. KEMIJSKA REAKCIJA kot ENERGIJSKA SPREMEMBA Kemijska reakcija je SNOVNA in ENERGIJSKA SPREMEMBA (gorenje lesa, fotosinteza). Sprememba energije se pri kemijskih reakcijah lahko opazi kot: Ø zvok: pok, eksplozija, prasketanje. . . Ø svetloba: plamen, iskrenje. . . Ø toplota: segrevanje, ohlajanje.

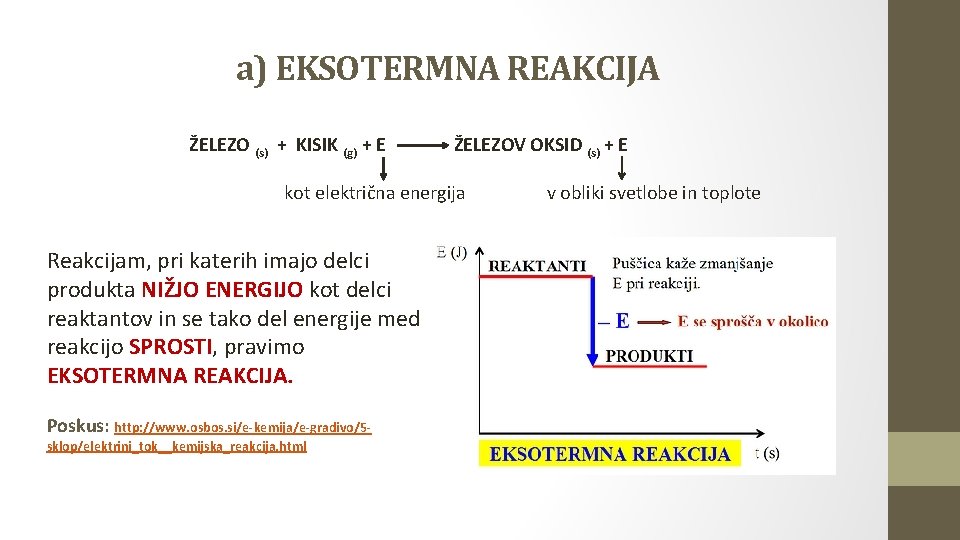
a) EKSOTERMNA REAKCIJA ŽELEZO (s) + KISIK (g) + E ŽELEZOV OKSID (s) + E kot električna energija Reakcijam, pri katerih imajo delci produkta NIŽJO ENERGIJO kot delci reaktantov in se tako del energije med reakcijo SPROSTI, pravimo EKSOTERMNA REAKCIJA. Poskus: http: //www. osbos. si/e-kemija/e-gradivo/5 sklop/elektrini_tok__kemijska_reakcija. html v obliki svetlobe in toplote

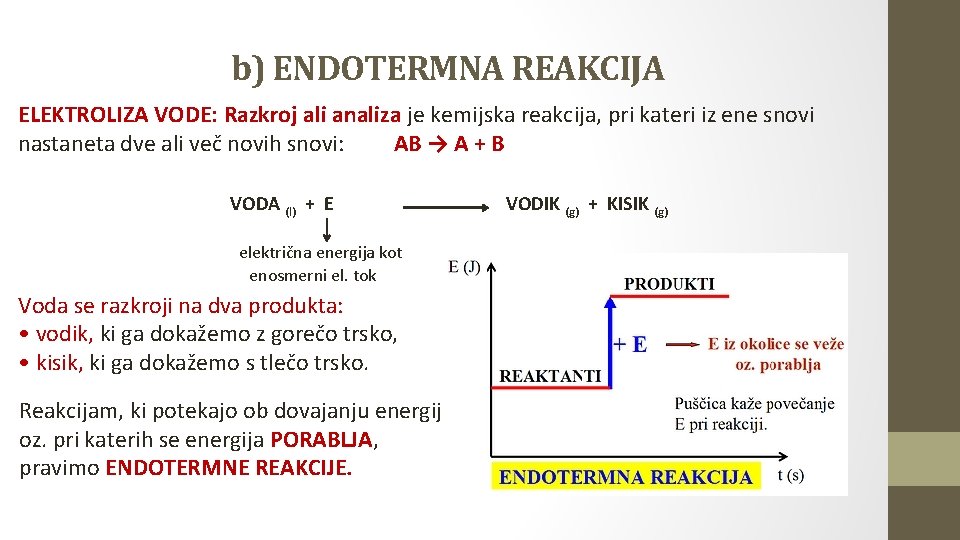
b) ENDOTERMNA REAKCIJA ELEKTROLIZA VODE: Razkroj ali analiza je kemijska reakcija, pri kateri iz ene snovi nastaneta dve ali več novih snovi: AB → A + B VODA (l) + E električna energija kot enosmerni el. tok Voda se razkroji na dva produkta: • vodik, ki ga dokažemo z gorečo trsko, • kisik, ki ga dokažemo s tlečo trsko. Reakcijam, ki potekajo ob dovajanju energije oz. pri katerih se energija PORABLJA, pravimo ENDOTERMNE REAKCIJE. VODIK (g) + KISIK (g)

Zapis kemijskih reakcij Kemijske reakcije lahko napišemo v obliki » stavkov «, to so KEMIJSKE ENAČBE: puščica pokaže smer reakcije (spremembe) LEVA STRAN katere snovi vstopajo v nastanejo kemijsko reakcijo REAKTANTI DESNA STRAN katere snovi pri kemijski reakciji PRODUKTI

Vrste zapisov kemijskih reakcij

Zakon o ohranitvi mase Francoski kemik A. L. Lavoisier je ob koncu 19. stol. iz opazovanj kemijskih poskusov ugotovil, da je masa snovi, ki vstopajo v kemijsko reakcijo enaka masi snovi, ki nastanejo pri reakciji. To ugotovitev imenujemo Zakon o ohranitvi mase. To je temeljni zakon kemije. Zaradi veljavnosti zakona o ohranitvi mase moramo kemijske enačbe urediti.

Urejanje kemijskih enačb PRAVILO: Kemijska enačba je urejena, ko je število atomov določenega elementa na obeh straneh enačbe ENAKO. Če sestaviš modele delcev določene snovi, ugotoviš, da število atomov kisika na levi strani ni enako številu atomov na desni strani enačbe → enačba ni urejena! NA LEVI: 2 atoma vodika 2 atoma kisika NA DESNI: 2 atoma vodika 1 atom kisika Da izenačimo število atomov kisika, morata nastati dve molekuli vode. V tem primeru potrebujemo tudi na levi strani še eno molekulo vodika.

Urejanje kemijskih enačb NA LEVI: 4 atomi vodika 2 atoma kisika NA DESNI: 4 atomi vodika 2 atoma kisika Kemijske enačbe urejamo tako, da število delcev, ki med seboj reagirajo, zapišemo pred kemijsko formulo/simbol. Formule spojin pri tem ne spreminjamo.

Masa atomov Relativna atomska masa Majhne mase atomov so za vsakdanjo uporabo okorne in posameznih atomov ne moremo tehtati, zato jih rajši podajamo primerjalno glede na maso nekega izbranega atoma. Znanstveniki so za osnovo vzeli 1/12 mase najbolj pogostega atoma elementa ogljika, izotopa. Na ta način izraženi masi atoma kateregakoli elementa rečemo relativna atomska masa Ar elementa. Pove nam, kolikokrat je masa nekega atoma elementa večja od 1/12 mase omenjenega izotopa ogljika. !!! Relativne atomske mase so navedene v periodnem sistemu elementov in nimajo enote.

Relativna molekulska masa Za spojine podajamo relativno molekulsko maso Mr. To dobimo tako, da seštejemo relativne atomske mase vseh atomov elementov, iz katerih je molekula oziroma spojina sestavljena. Pri tem pa moramo upoštevati tudi število atomov v molekuli. Primer: Mr(H 2 O) = 2 · Ar(H) + 1 · Ar(O) = 2 · 1, 01 + 1 · 16, 00 = 18, 02

Masni delež elementov v spojinah Pri analizi spojin kemiki velikokrat uporabljajo podatke o masnem deležu nekega elementa v spojini. Masni delež označimo s črko w in nima enote. w(vseh elementov v spojini) = 1

Primer izračuna: S kemijsko analizo so ugotovili, da je v 25, 0 g vode 15 g kisika. Izračunaj masni del elementa vodika in kisika v vodi. Povedano drugače: V vodi je 60 % elementa kisika in 40 % elementa vodika. 60 % O + 40 % H = 100 % H 2 O
 Znaki za nevarnost snovi
Znaki za nevarnost snovi Snovi v naravi
Snovi v naravi Kroženje snovi v naravi
Kroženje snovi v naravi Kroženje snovi v naravi
Kroženje snovi v naravi Brzina kemijske reakcije 8 razred
Brzina kemijske reakcije 8 razred Brzina kemijske reakcije 8 razred
Brzina kemijske reakcije 8 razred Voda v naravi
Voda v naravi V naravi opazujemo pojave
V naravi opazujemo pojave Kemijske jednadžbe
Kemijske jednadžbe Kemija 7 razred 1 ispit znanja
Kemija 7 razred 1 ispit znanja Obloga iz trde umetne snovi
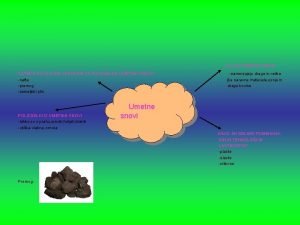
Obloga iz trde umetne snovi Nekatere snovi lahko pretakamo
Nekatere snovi lahko pretakamo Zgradba snovi
Zgradba snovi Zgradba snovi
Zgradba snovi Snovi in njihove lastnosti
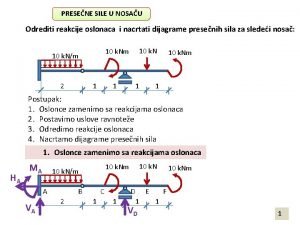
Snovi in njihove lastnosti Reakcije u osloncima
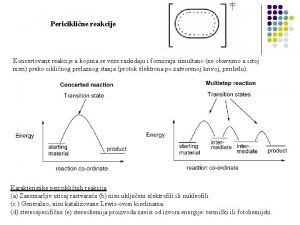
Reakcije u osloncima Porodica reakcije
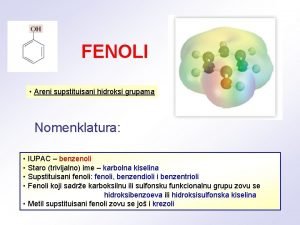
Porodica reakcije номенклатура фенола
номенклатура фенола Srebrno bela kovina
Srebrno bela kovina Termoliza
Termoliza