KARIIMLARIN SINIFLANDIRILMASI HAZIRLAYAN FEHM GR KARIIMLARIN SINIFLANDIRILMASI Karmlar

























- Slides: 35

KARIŞIMLARIN SINIFLANDIRILMASI HAZIRLAYAN FEHMİ GÜR

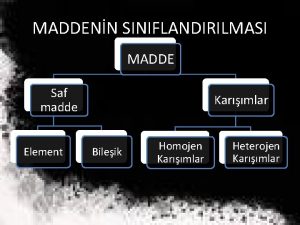
KARIŞIMLARIN SINIFLANDIRILMASI üKarışımlar hangi özelliklerine göre sınıflandırılır? üKarışımların sınıflandırılmasında belirleyici olan faktörler nelerdir? üFarklı maddelerin çözünürlükleri aynı mıdır? üÇözünürlüğü neler etkiler? İçerik: q. Heterojen ve homojen karışımlar q. Sıcaklığın ve basıncın çözünürlüğe etkisi q. Farklı maddelerin çözünürlüklerinin karşılaştırılması qÇözünürlük maddenin kimlik özelliği midir? q. Karışımların bileşimleri değiştikçe fiziksel özellikleri değişir mi?

KARIŞIMLAR q Meyve salatası değişik meyvelerden oluşan bir karışımdır. Saf su ve tuzlu su görünüş olarak birbirinden farksızdır. Doğadaki maddelerin çoğu saf halde bulunmaz. Çevremizde gördüğümüz maddeler genellikle karışım halindedir. Soluduğumuz hava, yediğimiz çikolata, kek, içtiğimiz meyve suyu, süt hatta kullandığımız maddeni para değişik türde maddelerin karışımıdır. Tüm karışımlar aynı özellikte midir? q Meyve salatası ve tuzlu suyun farkı nedir? q Süt bir karışımdır, homojenize edilmiş süt ne anlama gelir? q Karışım iki ya da daha fazla maddenin kimyasal özelliklerini kaybetmeden oluşturdukları fiziksel sistemledir. Karışımı oluşturan maddelerin her birine bileşen denir.

KARIŞIMLAR q Karışımı oluşturan maddeler karışım içinde dağılma şekillerine göre; homojen ve heterojen karışım olarak ikiye ayrılır. HOMOJEN KARIŞIM Tuzlu su, şekerli su, alkol – su, gazoz ve hava gibi birbiri içerisinde her bölümünde eşit şekilde dağılmış olan karışımlara homojen karışım denir. Homojen karışımlara aynı zamanda çözelti denir. HETEROJEN KARIŞIM Sis, meyve salatası, duman, köpük vb. karışımlar ise her bölümünde eşit dağılmadığı için heterojen karışım olarak adlandırılır. Heterojen karışımlar kendi aralarında süspansiyon, emülsiyon, aerosol ve koloit vb. olmak üzere gruplara ayrılır.

KARIŞIMLAR Süt Sis Su + Zeytinyağı HETEROJEN KARIŞIMLAR Bir katının sıvı içerisinde çözünmeyip dağılmasıyla oluşan karışımlara süspansiyon denir. Örneğin tebeşir tozu su karışımı bir süspansiyondur. Çözünmeyen iki sıvının birbiri içerisinde heterojen dağılmasıyla oluşan karışımlara emülsiyon denir. Zeytinyağı – su karışımı emülsiyona örnektir. Bir sıvının veya bir katının gaz içinde dağılmasıyla oluşan heterojen karışımlara aerosol denir. Duman ve sis örnek verilebilir. Bir maddenin sıvı içerinde “asılı” kalmasıyla oluşan heterojen karışımlara koloit karışımlar denir. Süt bir koloit karışımdır.

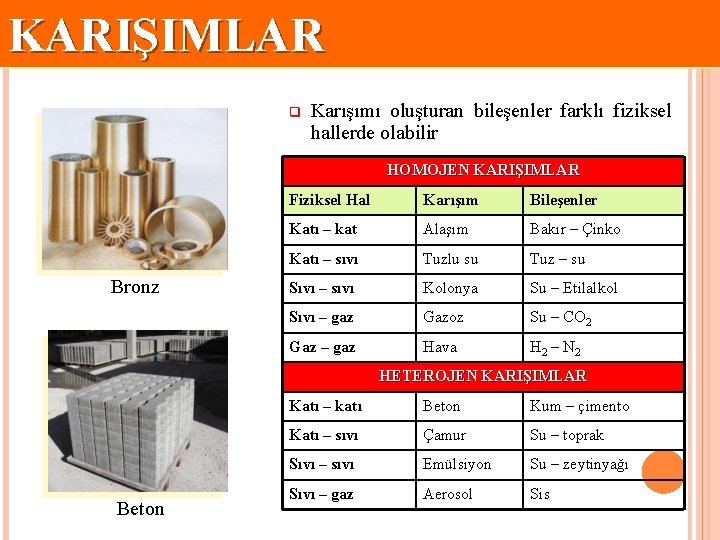
KARIŞIMLAR q Karışımı oluşturan bileşenler farklı fiziksel hallerde olabilir HOMOJEN KARIŞIMLAR Bronz Fiziksel Hal Karışım Bileşenler Katı – kat Alaşım Bakır – Çinko Katı – sıvı Tuzlu su Tuz – su Sıvı – sıvı Kolonya Su – Etilalkol Sıvı – gaz Gazoz Su – CO 2 Gaz – gaz Hava H 2 – N 2 HETEROJEN KARIŞIMLAR Beton Katı – katı Beton Kum – çimento Katı – sıvı Çamur Su – toprak Sıvı – sıvı Emülsiyon Su – zeytinyağı Sıvı – gaz Aerosol Sis

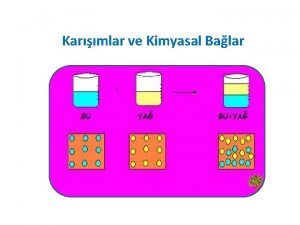
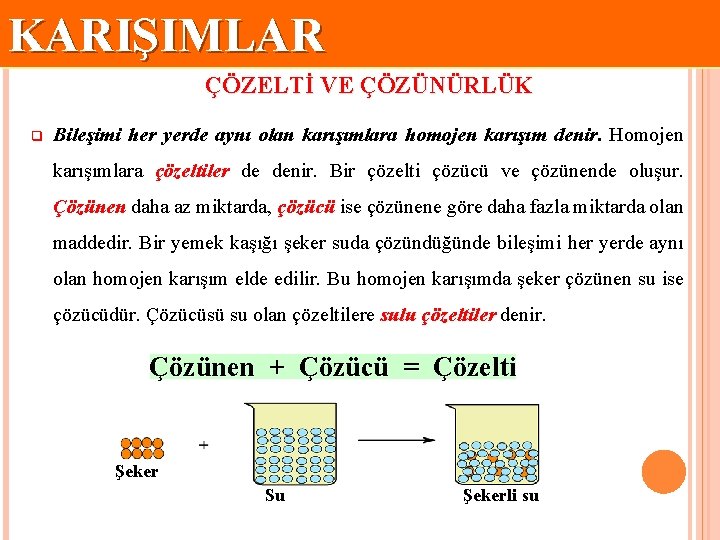
KARIŞIMLAR ÇÖZELTİ VE ÇÖZÜNÜRLÜK q Bileşimi her yerde aynı olan karışımlara homojen karışım denir. Homojen karışımlara çözeltiler de denir. Bir çözelti çözücü ve çözünende oluşur. Çözünen daha az miktarda, çözücü ise çözünene göre daha fazla miktarda olan maddedir. Bir yemek kaşığı şeker suda çözündüğünde bileşimi her yerde aynı olan homojen karışım elde edilir. Bu homojen karışımda şeker çözünen su ise çözücüdür. Çözücüsü su olan çözeltilere sulu çözeltiler denir. Çözünen + Çözücü = Çözelti Şeker Su Şekerli su

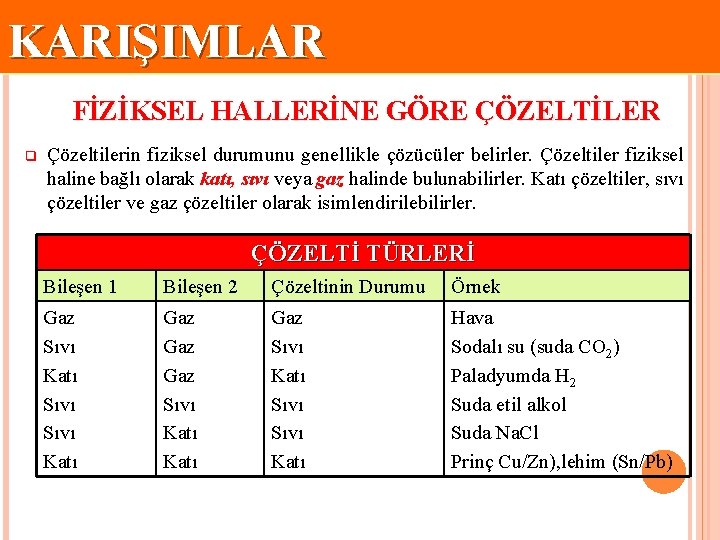
KARIŞIMLAR FİZİKSEL HALLERİNE GÖRE ÇÖZELTİLER q Çözeltilerin fiziksel durumunu genellikle çözücüler belirler. Çözeltiler fiziksel haline bağlı olarak katı, sıvı veya gaz halinde bulunabilirler. Katı çözeltiler, sıvı çözeltiler ve gaz çözeltiler olarak isimlendirilebilirler. ÇÖZELTİ TÜRLERİ Bileşen 1 Bileşen 2 Çözeltinin Durumu Örnek Gaz Sıvı Katı Gaz Gaz Sıvı Katı Sıvı Katı Hava Sodalı su (suda CO 2) Paladyumda H 2 Suda etil alkol Suda Na. Cl Prinç Cu/Zn), lehim (Sn/Pb)

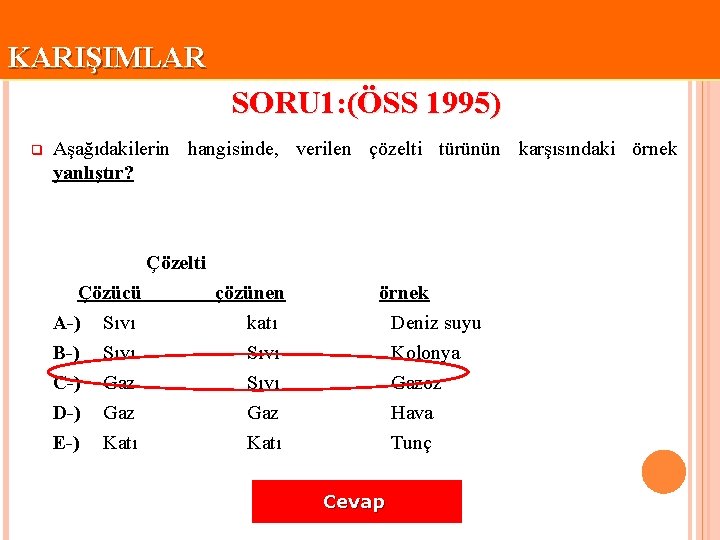
KARIŞIMLAR SORU 1: (ÖSS 1995) q Aşağıdakilerin hangisinde, verilen çözelti türünün karşısındaki örnek yanlıştır? Çözelti Çözücü A-) Sıvı B-) Sıvı C-) Gaz D-) Gaz E-) Katı çözünen katı Sıvı Gaz Katı örnek Deniz suyu Kolonya Gazoz Hava Tunç Cevap

KARIŞIMLAR ÇÖZÜNENİN ÇÖZÜNÜRLÜĞÜNE GÖRE q Kimyacılar çözeltileri bir katıyı çözme gücüne bağlı olarak karakterize ederler. Bunlar doymuş çözelti, belirli bir sıcaklıkta, söz konusu bir çözücü ortamında bir katının çözünebilen maksimum miktarını içerir. Doymamış çözelti ise çözebilme gücünden daha az miktarda katı içerir. Bir üçüncü tür aşırı doymuş çözelti ise, doymuş çözeltide mevcut olandan daha fazla katı içerir. Aşırı doymuş çözeltiler çok kararlı çözeltiler değildirler. Zamanla çözünen maddenin bir kısmı kristal olarak, aşırı doymuş çözeltiden ayrılırlar. Kristalleşme, çözünen katının çözeltiden ayrılıp, kristaller oluşturma işlemidir. q Örneğin; 20 o. C ta 100 m. L suda en fazla 36 gr. Na. Cl tuzu çözünebilir. Bu sıcaklıkta; q 100 m. L suya 36 gr. Na. Cl ekleyerek oluşturulan çözelti doymuş çözeltidir. q 100 m. L suya 36 gramdan daha az Na. Cl ekleyerek oluşturulan çözelti doymamış çözeltidir. q Özel koşullarda 100 m. L suya 36 gramdan daha fazla Na. Cl ekleyerek oluşturulan çözelti aşırı doymuş çözeltidir.

KARIŞIMLAR ÇÖZÜNENİN MİKTARINA GÖRE q Çözeltiler içerdikleri çözünen maddenin göreceli miktarlarına göre seyreltik ve derişik olmak üzere ikiye ayrılırlar. q Verilen bir çözelti için belirli miktar çözücüde çözünmüş madde miktarına Derişim denir. Derişimin düşük olduğu çözeltilere seyreltik çözeltiler, çözeltiler derişimin yüksek olduğu çözeltilere ise derişik çözeltiler denir. q Laboratuarlarda en çok asit çözeltilerinin kıyaslanmasında kullanılır. 100 m. L 0, 5 M HCl çözeltisi 100 m. L 1, 5 M HCl çözeltisi

KARIŞIMLAR ELEKTRİK İLETKENLİKLERİNE GÖRE q Suda çözünen tüm maddeler iki kategoriden birinde bulunurlar; elektrolit ve elektrolit olmayan Bir elektrolit suda çözündüğünde elektriği iletebilen çözelti oluşturabilen maddedir ve oluşan çözelti elektrolit çözeltidir. Elektrolit olmayan ise suda çözündüğünde elektriği iletmeyen maddedir. Oluşan çözelti ise elektrolit olmayan çözeltidir. Örnek: Na. Cl (k) + H 2 O Na + (aq) + Cl- (aq) (elektrolit çözelti) C 6 H 12 O 6 (k) + H 2 O C 6 H 12 O 6 (suda) (elektrolit olmayan çözelti) Elektriksel iletkenlik; İyonların derişimi ile doğru orantılıdır. Sıcaklıkla doğru orantılıdır. Çünkü iyonların hızını artırır.

KARIŞIMLAR ÇÖZÜNÜRLÜK q Belli sıcaklıkta, verilen miktardaki bir çözücüde çözünebilen maksimum madde miktarıdır. Çözünürlük verilen sıcaklıkta doymuş çözeltinin derişimi olarak ta tanımlanır. Kullanılan hacim 100 cm 3 ya da 100 mililitredir. Genellikle kimyada çözücü sudur. Çözünürlüğü aşağıdaki formülle ifade edebiliriz Çözünürlük Çözünenin Kütlesi (gram) = 100 gr. Su q Doygun bir çözeltideki çözünen maddenin oranı aşağıdaki formülle edilebilir. Doygun çözeltideki çözünen maddenin oranı (%) = Çözünen Maddenin Kütlesi Çözelti Kütlesi X 100 ifade

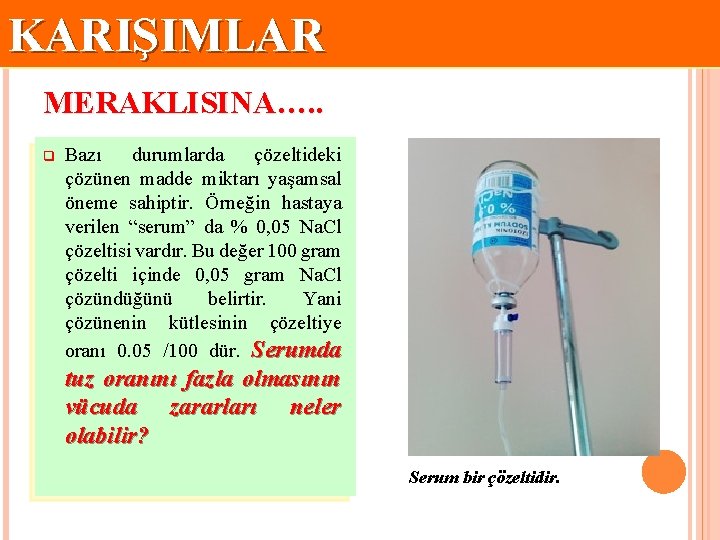
KARIŞIMLAR MERAKLISINA…. . q Bazı durumlarda çözeltideki çözünen madde miktarı yaşamsal öneme sahiptir. Örneğin hastaya verilen “serum” da % 0, 05 Na. Cl çözeltisi vardır. Bu değer 100 gram çözelti içinde 0, 05 gram Na. Cl çözündüğünü belirtir. Yani çözünenin kütlesinin çözeltiye oranı 0. 05 /100 dür. Serumda tuz oranını fazla olmasının vücuda zararları neler olabilir? Serum bir çözeltidir.

KARIŞIMLAR Örnek 1: Sodyum klorunun 20 o. C ta çözünürlüğü 36 gr/100 ml sudur. Buna göre Çözeltideki tuz yüzdesi nedir? Çözüm:

KARIŞIMLAR Örnek 2: 30 gr şekerin 120 gr suda çözünmesiyle oluşan çözeltide çözünen şekerin kütlece yüzdesi nedir? Çözüm:

KARIŞIMLAR Örnek 3: Kütlece % 20 lik 400 gr şeker çözeltisinde kaç gram şeker çözünmüştür? Çözüm:

KARIŞIMLAR Örnek 4: 192 gr su ve 48 gr tuz ile hazırlanan çözelti kütlece yüzde kaçlıktır? Çözüm:

KARIŞIMLAR Örnek 5: Potasyum sülfatın 50 o. C’taki çözünürlüğü 16, 5 gr/ 100 gr sudur. Bu sıcaklıkta 200 gr su ile hazırlanan doymuş çözeltinin kütlesi kaç gramdır? Çözüm:

KARIŞIMLAR ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER q Uzun süre buzdolabında bekletilen reçelin kristalleşmesinden halk arasında “reçel şekerlendi” şekerlendi diye söz ederiz. Reçel ısıtılırsa eski haline döner. Peki reçelin neden şekerlendiğini hiç düşündünüz mü? q Isıtma nasıl bir etki yaparak reçeli eski haline getirir? q Sıcaklık şekerin çözünürlüğünü nasıl etkiler? q ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER Çözücüve veçözünenincinsi Sıcaklık Basınç Ortakiyonetkisi ÇÖZÜCÜ VE ÇÖZÜNENİN CİNSİ Polar maddeler genellikle polar çözücülerde, apolar maddeler genellikle apolar çözücülerde çözünürler. Şeker ve tuz gibi maddeler suda iyi çözünürken yağlı boya ise apolar çözücü olan benzende çözünürler.

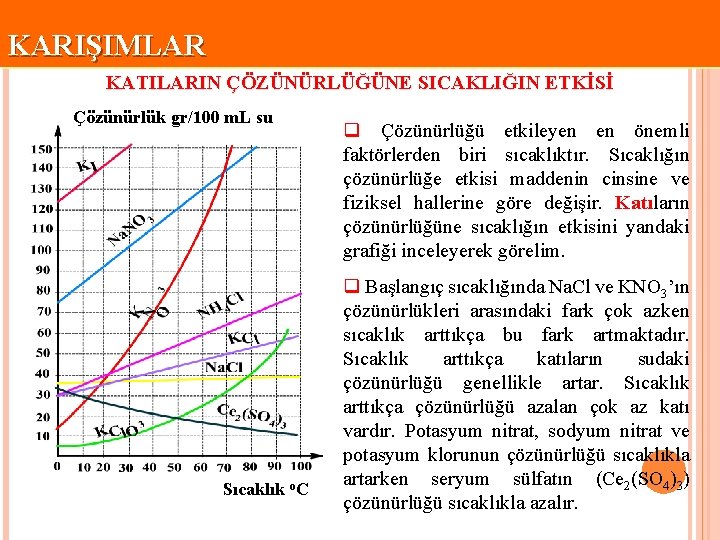
KARIŞIMLAR KATILARIN ÇÖZÜNÜRLÜĞÜNE SICAKLIĞIN ETKİSİ Çözünürlük gr/100 m. L su Sıcaklık o. C q Çözünürlüğü etkileyen en önemli faktörlerden biri sıcaklıktır. Sıcaklığın çözünürlüğe etkisi maddenin cinsine ve fiziksel hallerine göre değişir. Katıların çözünürlüğüne sıcaklığın etkisini yandaki grafiği inceleyerek görelim. q Başlangıç sıcaklığında Na. Cl ve KNO 3’ın çözünürlükleri arasındaki fark çok azken sıcaklık arttıkça bu fark artmaktadır. Sıcaklık arttıkça katıların sudaki çözünürlüğü genellikle artar. Sıcaklık arttıkça çözünürlüğü azalan çok az katı vardır. Potasyum nitrat, sodyum nitrat ve potasyum klorunun çözünürlüğü sıcaklıkla artarken seryum sülfatın (Ce 2(SO 4)3) çözünürlüğü sıcaklıkla azalır.

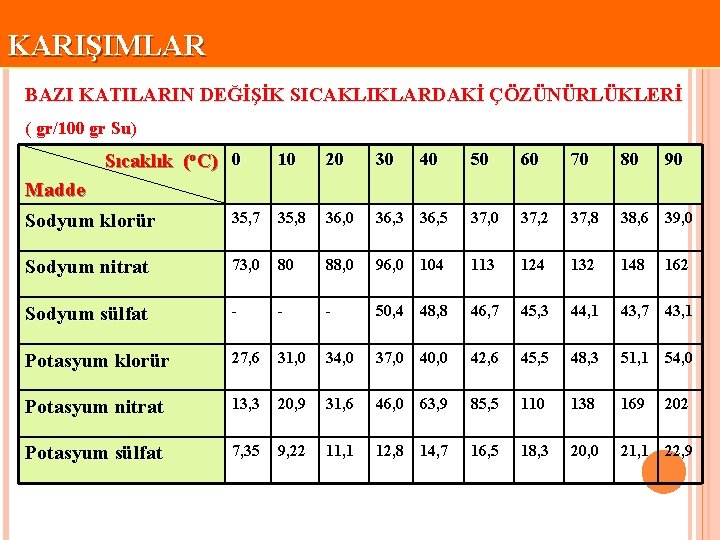
KARIŞIMLAR BAZI KATILARIN DEĞİŞİK SICAKLIKLARDAKİ ÇÖZÜNÜRLÜKLERİ ( gr/100 gr Su) Sıcaklık (o. C) 0 10 20 30 40 50 60 70 80 90 Madde Sodyum klorür 35, 7 35, 8 36, 0 36, 3 36, 5 37, 0 37, 2 37, 8 38, 6 39, 0 Sodyum nitrat 73, 0 80 88, 0 96, 0 104 113 124 132 148 Sodyum sülfat - - - 50, 4 48, 8 46, 7 45, 3 44, 1 43, 7 43, 1 Potasyum klorür 27, 6 31, 0 34, 0 37, 0 40, 0 42, 6 45, 5 48, 3 51, 1 54, 0 Potasyum nitrat 13, 3 20, 9 31, 6 46, 0 63, 9 85, 5 110 138 169 Potasyum sülfat 7, 35 9, 22 11, 1 12, 8 14, 7 16, 5 18, 3 20, 0 21, 1 22, 9 162 202

KARIŞIMLAR Örnek 6: çözülebilir. Çözüm: 60 o. C sıcaklıkta 200 gr suda kaç gr KNO 3

KARIŞIMLAR Örnek 7: 10 o. C’ta 300 gr suya 270 gr Na. NO 3 eklendiğinde kaç gram Na. NO 3 çözünmeden kalır? Çözüm:

KARIŞIMLAR Örnek 8: 90 o. C sıcaklıkta 462 gr doymuş KCl çözeltisi 40 o. C’a kadar soğutulursa kaç gram KCl çöker. Çözüm:

KARIŞIMLAR Örnek 9: 30 o. C sıcaklıkta 400 gr suya 150 gr KCl eklendiğinde, kaç gr KCl çözünmeden kalır. Çözüm:

KARIŞIMLAR Örnek 10: 60 o. C’ta 200 gr suya 275 gr KNO 3 atıldığında çöken KNO 3’ı çözmek için kaç gram su gerekir? Çözüm:

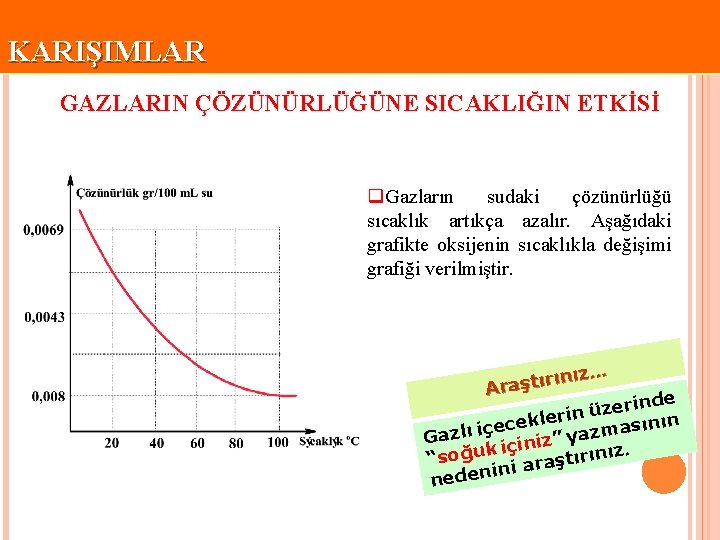
KARIŞIMLAR GAZLARIN ÇÖZÜNÜRLÜĞÜNE SICAKLIĞIN ETKİSİ q. Gazların sudaki çözünürlüğü sıcaklık artıkça azalır. Aşağıdaki grafikte oksijenin sıcaklıkla değişimi grafiği verilmiştir. nız… ı r ı t ş a Ar inde r e z ü klerin e ının c s e a ç i ı m l z z Ga z” ya i n i ç i. k “soğu i araştırınız in neden

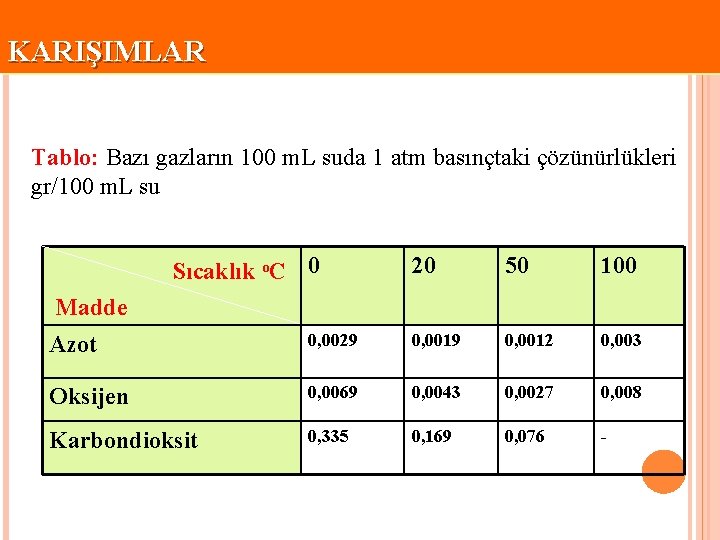
KARIŞIMLAR Tablo: Bazı gazların 100 m. L suda 1 atm basınçtaki çözünürlükleri gr/100 m. L su Sıcaklık o. C 0 20 50 100 Madde Azot 0, 0029 0, 0012 0, 003 Oksijen 0, 0069 0, 0043 0, 0027 0, 008 Karbondioksit 0, 335 0, 169 0, 076 -

KARIŞIMLAR Meraklısına… q. Suda yaşayan canlılar yaşamlarını sürdürebilmek için suda çözünmüş oksijen gazına ihtiyaç duyarlar. Yaz günlerinde, havanın azalması, derinliği az olan sularda daha az balık yaşamasına neden olur. Derinlere inildikçe sıcaklık azalacağından çözünmüş oksijen gazı miktarı da artar. Bu nedenle balıklar, sıcak havalarda derin sulara gider.

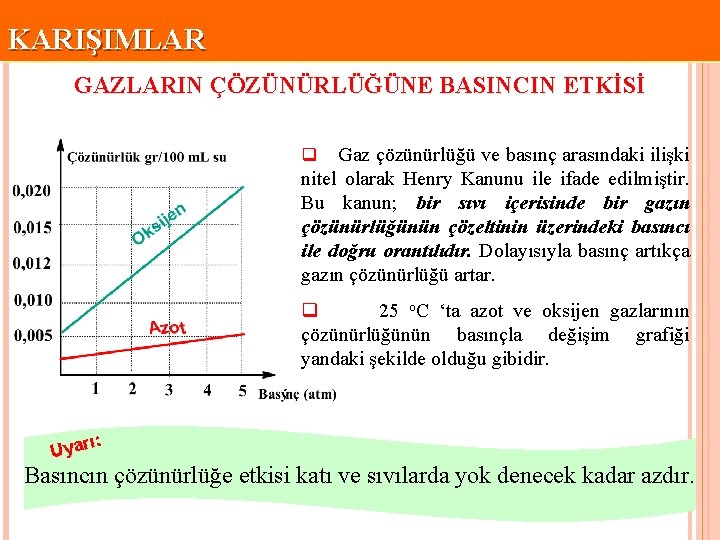
KARIŞIMLAR GAZLARIN ÇÖZÜNÜRLÜĞÜNE BASINCIN ETKİSİ Gaz çözünürlüğü ve basınç arasındaki ilişki nitel olarak Henry Kanunu ile ifade edilmiştir. Bu kanun; bir sıvı içerisinde bir gazın çözünürlüğünün çözeltinin üzerindeki basıncı ile doğru orantılıdır. Dolayısıyla basınç artıkça gazın çözünürlüğü artar. q q 25 o. C ‘ta azot ve oksijen gazlarının çözünürlüğünün basınçla değişim grafiği yandaki şekilde olduğu gibidir. ı: Uyar Basıncın çözünürlüğe etkisi katı ve sıvılarda yok denecek kadar azdır.

KARIŞIMLAR q Çözünürlük maddenin kimlik özelliği midir? Çözünürlük tabloları incelendiğinde hem katıların hem de gazların aynı sıcaklıkta farklı maddelerin çözünürlüklerinin de farklı olduğu görülür. O halde çözünürlük maddenin kimlik özelliklerindendir. q Örneğin deneysel ölçümler sonucunda bir maddenin 20 o. C’taki sudaki çözünürlüğü 11, 1 gr/100 m. L su olarak belirlemişsek bu maddenin Potasyum sülfat (K 2 SO 4) olduğunu çözünürlük tablosuna bakarak söyleyebiliriz. q Ancak bir maddenin yalnızca bir özelliğine bakarak hangi madde olduğunu söylemek doğru olmaz. Başka fiziksel özelliklerinin de bilinmesi gerekir. q

KARIŞIMLARIN FİZİKSEL ÖZELLİKLERİ q Makarna için koyduğumuz su tencerede kaynarken tuz atıldığında kaynamanın durduğu ve bir müddet sonra tekrar kaynamanın başladığı görülür. v q Tuzlu su bir karışım olduğuna, karışımların bileşenleri değiştikçe kaynama noktası, yoğunluk gibi fiziksel özellikleri nasıl değişir? Deniz suyu çeşitli tuzların çözünmüş olarak bulunduğu bir karışımdır. Farklı denizlerde bu tuz oranı farklı değerlerdedir. Bu farklılığın çeşitli nedenlerinden biri sıcaklık diğeri de o bölgedeki denizi besleyen akarsuların fazlalığıdır. Dünyada en tuzlu deniz İsrail ile Ürdün sınırındaki ölü denizdir. Ülkemizde Akdeniz’in suyu, Karadeniz’e göre neden daha tuzludur? v Ölü Deniz’de yüzmek diğer denizlere göre daha kolaydır. Neden? v

KARIŞIMLARIN FİZİKSEL ÖZELLİKLERİ q Saf maddelerin onları tanımamızı sağlayan kimlik özellikleri vardır. Karışımların ise bu tür kimlik özellikleri yoktur. Karışımların yoğunluk, kaynama noktası gibi özellikleri karışımı meydana getiren bileşenlerin birleşme oranına göre değişir. q Örneğin suyun kaynama noktası 1 atm basınçta 100 o. C iken glikolun kaynama noktası 198 o. C’tur. Glikol – su karışımın kaynama noktası ise suyun kaynama noktasından yüksek, glikolun kaynama noktasından düşüktür. Kaynama noktası suyun kaynama noktasından yüksek olan glikolun donma noktası da suyun donma noktasından düşüktür. q Glikol, suyun donma noktasında alçalmaya, kaynama noktasında yükselmeye neden olur. v Motorlu araçların radyatörlerindeki suya kış aylarında neden glikol karıştırılır?

KARIŞIMLARIN FİZİKSEL ÖZELLİKLERİ q Suda çözünen tuzlar da suyun kaynama noktası alçalmasına neden olur. Suyun donma noktası alçalması ve kaynama noktası yükselmesi çözünen tuzun miktarına bağlıdır. v Kışın buzlanan yollara neden tuz atılır? Özet… §Karışımı oluşturan maddeler her oranda karışır. §Karışımı oluşturan maddeler kendi özelliklerini kaybetmez. §Karışımın erime noktası ve kaynama noktası gibi özellikleri, karışımı oluşturan maddelerin karışma oranına göre değişir. §Karışımlar fiziksel yöntemlerle bileşenlerine ayrılır. §Karışımların belirli bir formülü yoktur. §Karışımların oluşması ya da ayrılmasında bileşiklere göre daha az enerji değişimi olur.
 Rnesans
Rnesans öncül davranış sonuç örnekleri
öncül davranış sonuç örnekleri Vulvutis
Vulvutis Lojistik faaliyetlerinin sınıflandırılması
Lojistik faaliyetlerinin sınıflandırılması Osazon kristalleri
Osazon kristalleri Wash ölçü tekniği
Wash ölçü tekniği Egrelti otu ökaryot mu
Egrelti otu ökaryot mu Içten yanmalı motorların sınıflandırılması
Içten yanmalı motorların sınıflandırılması ülkemizde kullanılan triaj renk kodlaması
ülkemizde kullanılan triaj renk kodlaması Genel kuvvet nedir
Genel kuvvet nedir Ilaçların sınıflandırılması
Ilaçların sınıflandırılması Fonetik sanat ne demek
Fonetik sanat ne demek Ikmal maddelerinin sınıflandırılması
Ikmal maddelerinin sınıflandırılması Ismet boz
Ismet boz Hiperkalorik enteral ürünler
Hiperkalorik enteral ürünler Canlıların sınıflandırılması basitten gelişmişe
Canlıların sınıflandırılması basitten gelişmişe Polimer özellikleri
Polimer özellikleri Yağ asitlerinin sınıflandırılması
Yağ asitlerinin sınıflandırılması Metinlerin sınıflandırılması
Metinlerin sınıflandırılması Hastanelerin sınıflandırılması
Hastanelerin sınıflandırılması Enolleşme
Enolleşme Denatüre ne demek
Denatüre ne demek What parasite
What parasite Sellobioz
Sellobioz Protez kennedy sınıflaması
Protez kennedy sınıflaması Manavgat ram anket
Manavgat ram anket 2411 meslek kodu
2411 meslek kodu Itme çekme stratejisi
Itme çekme stratejisi Psikolojik testlerin sınıflandırılması
Psikolojik testlerin sınıflandırılması Ateşsiz silahların sınıflandırılması
Ateşsiz silahların sınıflandırılması Anormal davranışların sınıflandırılması
Anormal davranışların sınıflandırılması Sıfatların sınıflandırılması
Sıfatların sınıflandırılması Sterinler
Sterinler Katıların sınıflandırılması
Katıların sınıflandırılması Sekonder metabolitlerin sınıflandırılması
Sekonder metabolitlerin sınıflandırılması Zyafet
Zyafet