PROTENLER 2 Peptitler ki veya daha fazla sayda


































































- Slides: 72

PROTEİNLER 2

Peptitler � İki veya daha fazla sayıda aa’in peptit bağları ile bağlanması sonucu oluşur. � İki amino asitten dipeptit, � Üç amino asitten tripeptit, � Dört aminoasitten tetrapeptid, � Beş aminoasitten pentapeptid, � <10 aminoasitten oligopeptid, � <100 aminoasit : Polipeptid � >100 aminoasit : PROTEİN � Proteinler, yüzlerce amino asitten oluşan polipeptitlerdir.

Peptidler Aminoasit Protein Polipeptid Aminoasitlerin birinin α-karboksil grubu ile diğer aminoasidin α-amino grubu arasında bir mol su ayrılmasıyla oluşan kovalent bağa peptid bağı denir.

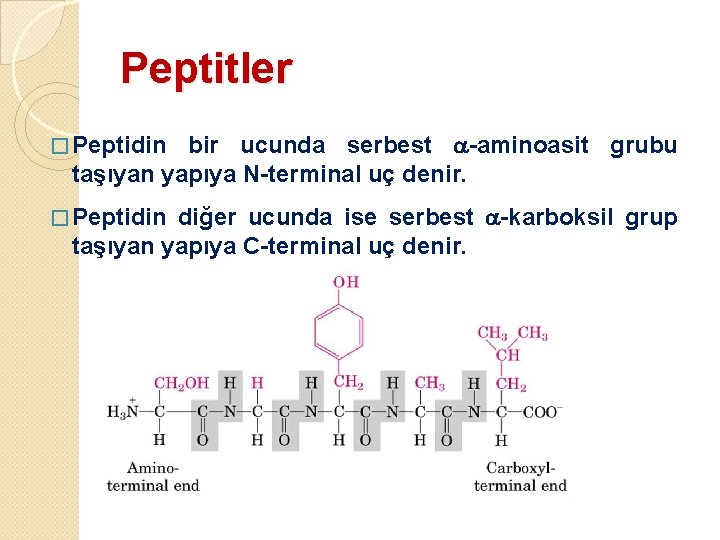
Peptitler bir ucunda serbest -aminoasit grubu taşıyan yapıya N-terminal uç denir. � Peptidin diğer ucunda ise serbest -karboksil grup taşıyan yapıya C-terminal uç denir. � Peptidin

Proteinler � Proteinlerde aynı AA bir yada daha fazla sayıda tekrarlanarak zincirin yapısında yer alabilir. � Protein çoğu tek bir polipeptid zincirinden oluşur. Örn: miyoglobin. � Bu 3 boyutlu yapının oluşmasında; Primer yapı Sekonder yapı Tersiyer yapı Kuarterner yapı Her proteinde primer yapı bulunur. Ancak bazı proteinler sekonder bazıları tersiyer veya kuarterner yapıdadır

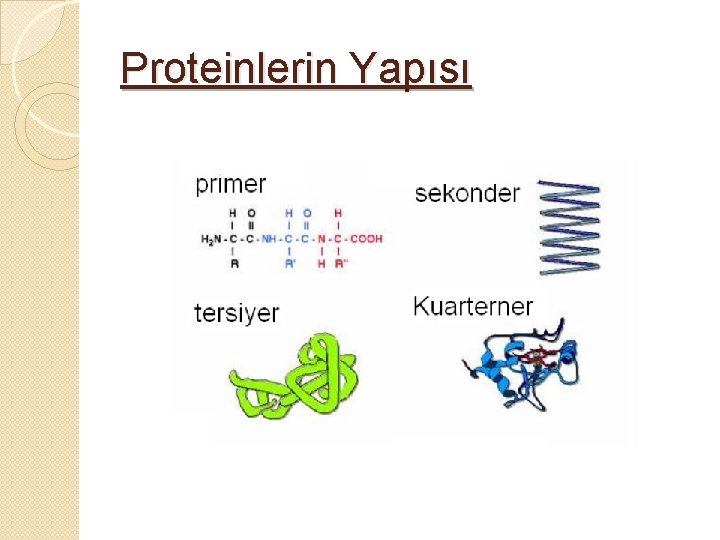
Proteinlerin Yapısı

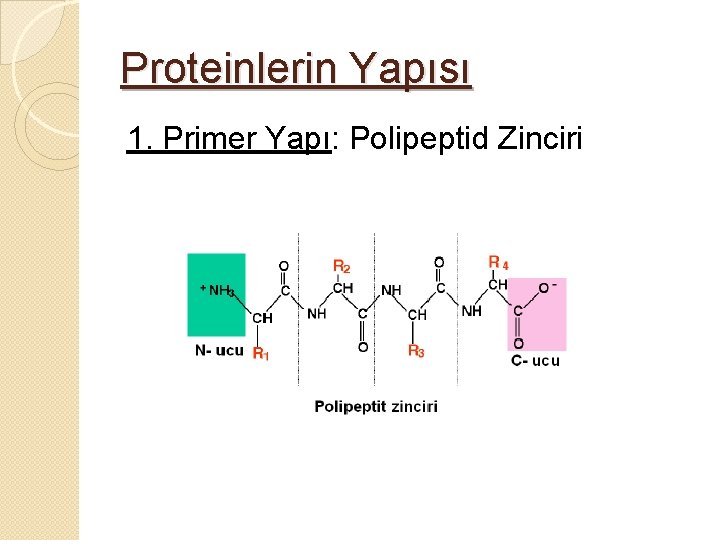
Proteinlerin Yapısı 1. Primer Yapı: Polipeptid Zinciri

1. Primer yapı; Birincil yapı �Bir protein molekülünü oluşturan polipeptid zinciri veya zincirdeki AA sıralanışı proteinlerin primer yapısını oluşturur. �Bu düz zincirde yer alan AA kalıntılarının hepsi Lkonfügürasyonundadır. �n sayıda AA kalıntısı içeren proteinde n-1 sayıda peptid bağı vardır.

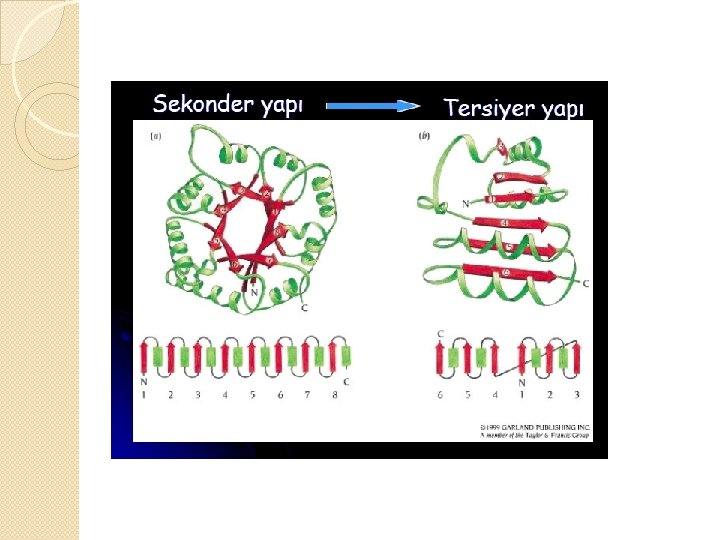
Proteinlerin Yapısı 2. Sekonder yapı: 1) Peptid zincirinin helezonlaşması 2) Helezon yapının H bağları ve –S-Sbağları ile sabit tutulması

2. Sekonder yapı; İkincil yapı � Primer yapıdaki belli bölgelerde zincir içi ve/veya zincirler arası bağların oluşmasıyla ortaya çıkar. � Primer yapı, pozitif ve negatif yüklü alanlara sahiptir. Bu yükler bir başka molekül ile etkileşime geçerek H bağlarını oluşturur.

2. Sekonder yapı; İkincil yapı � Bu H bağları sonucu 2 çeşit yapı ortaya çıkar. 1. Heliks yapılar; en çok rastlanan ve çok stabil olan α-heliks yapıdır. Bu yapı amfilik karakter 2. Yayılmış β-pilili tabaka=β-plakalı yapı; Polipeptid yapı α-heliksdeki gibi sarmal şekilde değil, yayılmış durumdadır. Kırmalı Tabaka Yapı α-heliks yapı

Proteinlerin Yapısı 3. Tersiyer yapı 1) Helezonlaşmış peptid zinciri birçok katlanma ile yumak şeklini alır. 2) Molekül üç boyutlu şeklini kazanır.


3. Tersiyer yapı � Bu yapı; Non-kovalent bağlar � Kovalent bağlar � Bu proteinler tersiyer yapıları ile 3 boyutlu şekillerine kavuşur. � Tersiyer yapı genellikle globüler proteinlerde görülür.

Proteinlerin Yapısı 4. Kuaterner Yapı: - Tersiyer yapıya sahip monomer ünitelerin polimerleşmesi - Mol. ağır. ↑

4. Kuarterner yapı=Dördüncül yapı �Üç yapıya sahip monomer birimlerin bir araya gelerek polimerleşmesidir. �Proteinlerin molekül ağırlıkları artar. �Proteinler; sadece primer yapıdaki AA diziliminden dolayı değil, 3 boyutlu yapıdaki diğer kıvrımlardan dolayı da farklılık gösterirler


Proteinlerin Yapısı

Proteinlerin Sınıflandırılması 1. Kimyasal Yapılarına Göre Proteinler Basit proteinler 1. Çözünen basit proteinler Bileşik proteinler 1. Fosfoproteinler 2. Lipoproteinler 2. Çözünmeyen basit proteinler 3. Proteolipidler 4. Glikoproteinler ve mukoproteinler 5. Nükleoproteinler 6. Kromoproteinler 7. Metaloproteinler

Proteinlerin Sınıflandırılması Kimyasal Yapılarına Göre Proteinler Basit Proteinler 1. Çözünen proteinler (Globüler protein) 2. Çözünmeyen proteinler (Skleroprotein & Fibröz Protein) � Albuminler � Kollajenler � Globülinler � Keratin � Glutelinler � Fibrin � Prolaminler � Miyosin � Protaminler � Elastin � Histonlar � Epidermin

1. Kimyasal yapılarına göre proteinler Basit proteinler; � Hidrolize olduklarında sadece α-amino asitleri ve türevlerini veren proteinlerdir. � Bunlar çözünürlük bakımından alt gruplara ayrılabilir. 1. Çözünen basit proteinler 2. Çözünmeyen basit proteinler A.

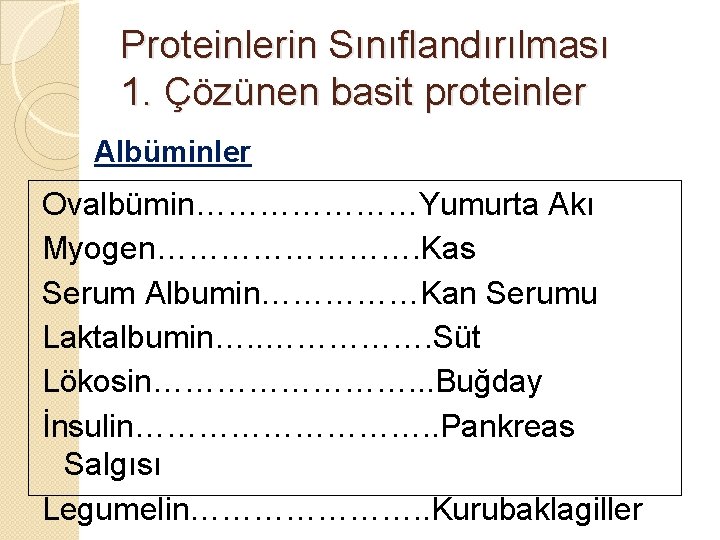
Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Albuminler � İnsan, hayvan ve bitkilerde bulunur. � MA < 100. 000 � İzo elektrik noktası p. H = 4. 5 -5. 0 � İçerdiği kükürt miktarı yüksektir. � Zayıf alkali özelliktedirler.

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Albüminler � Kuvvetli asitler Ağır metal tuzları Isı ile koagüle olurlar, pıhtılaşır

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Albüminler Ovalbümin…………………Yumurta Akı Myogen…………. Kas Serum Albumin……………Kan Serumu Laktalbumin…. . ……………. Süt Lökosin…………. . . Buğday İnsulin……………. . Pankreas Salgısı Legumelin…………………. . Kurubaklagiller

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Globulinler � İnsan, hayvan ve bitkilerde bulunur � Suda çözünmezler � Asit karakterindedir. Kuvvetli bazlar ile tuzların nötral çözeltilerinde çözünürler. � Isı işlem ile 60 -700 C’de koagüle olurlar. � İzo elektrik noktası p. H = 5. 5 -6. 5

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Globulinler α-β-γ Globulin, fibrinojen………. . . Serum Laktoglobulin………. . . . . …. Süt Ovoglobulin…………. . . Yumurta Miyosin………………. . . . …. Kas Edestin…………………. . . . . Tahıllar (buğday) Glycinin…………………. . . . Soya Fasulyesi Fibrojen…………………. . . . Plazma Legümin………………. . . . . Bezelye, mercimek Amandin………………. . . . . Badem

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Glutelinler (Glutenin) � Yalnız bitkilerde ve özellikle tahıllarda bulunurlar. � Tahıllarda Gliadinlerle birlikte bulunuşu ekmek kalitesini olumlu yönde etkiler. � MA: 40. 000 -20. 000 � Saf su ve tuz çözeltilerinde çözünmez. � Seyreltik asit ve alkalilerde kolay çözünürler. � Yüksek sıcaklıkta koagüle olurlar.

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Glutelinler (Glutenin) Glutenin…………………Buğday Hordenin………………. . . Arpa Avenin…………………. . . Yulaf Orizenin…………………. Pirinç Zeanin…………Mısır Sekalinin…………………Çavdar

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Prolaminler (Gliadinler) � Genellikle tohumlarda bulunan bitkisel proteinlerdir. Pirinçte bulunmazlar. � Absolü alkolde, suda ve diğer nötr çözücülerde çözünemez. � %70 -80’lik alkolde çözünürler. Bu nedenle alkolde çözünen proteinler adını alırlar. � Bol miktarda prolin ve glutamik asit içerir. � Lizin içermezler. Veya çok az içerirler. Arjinin ve histidin içerikleri de düşüktür.

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Prolaminler (Gliadin) Gliadin……………. Buğday, çavdar Hordein……………Arpa Zein……………. . . Mısır Balnin……………Malt Sekalin. . . Çavdar Orizin. . . Pirinç Kafirin. . . Darı

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Protaminler � En basit doğal proteinlerdir. � Yapılarında 14 -20 peptid bağı vardır. � Fazla miktarda arginin (%70 -80) içerdiklerinden kuvvetli baziktirler. � Yapılarında kükürtlü aminoasit, tirozin ve triptofan yok. � Mol. Ağırlığı küçük: 4000 -8000 � Suda ve seyreltik amonyak, asit ve baz çözeltilerinde çözünürler. � Yüksek sıcaklıklarda koagüle olmazlar. � Pepsinden etkilenmezler.

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Protaminler �Birçok protamin tıpta kullanılmaktadır. Salmin………………. . Som balığı Skembrin……………. Uskumru balığı Klupein………………. Ringa balığı Struin. . . . mersin balığı

Proteinlerin Sınıflandırılması 1. Çözünen basit proteinler Histonlar � Bazı hayvan dokularında bulunur, bitkilerde bulunmaz. � Suda ve çok seyreltik asitlerde çözünürler, seyreltik amonyak çözeltisinde çözünmezler. � Yapılarında bol miktarda arginin ve lizin amino asitleri bulunur. � Triptofan içermezler. � Isı ile denatüre ve koagüle olurlar. � Hücrelerin içinde nükleik asitlerle bileşik halde bulunur.

Proteinlerin Sınıflandırılması 2. Çözünmeyen basit proteinler Sikleroprotein = Fibröz Protein � Su, tuzlu su, sulu alkol, seyreltik asit ve seyreltik alkalide erimez. � Enzim hidrolizine dayanıklıdır. � Bir eksen boyunca uzanmış bir polipeptit ya da birbirine paralel olarak yerleşmiş polipeptit zincirlerinden ibaret, çubuk şeklinde proteinlerdir. � Molekül ağırlığı çok yüksektir. Sağlam bir yapıya sahiptirler.

Proteinlerin Sınıflandırılması 2. Çözünmeyen basit proteinler Kollojenler � Bağ dokusu, kemik, kıkırdak, tendon ve deride bulunan proteinler genelde kollojen içerir. � Memelilerin total proteininin %30’u kollojendir. � Sindirim enzimlerinden etkilenmez. � Soğuk suda erimez. � Sıcak suda, sulu asit ve alkalilerde kaynatılırsa jelatin oluşur.

Jelatin � Soğuk suda şişer, sıcak su ile yüksek kıvamlı çözelti verir. Bu soğuyunca pelte olur. � Bol miktarda glisin, prolin, hidroksiprolin ve arjinin içerir. � Triptofan ve tirozin içermez. � Kolaylıkla çözünür ve sindirilebilir. Bu özelliği ile kollojen ve keratinden ayrıcalık gösterir. � α-heliks yapısı yoktur.

Jelatin � İnce uzun bir şekilde bulunan polipeptid moleküllerinin birbiriyle gelişigüzel bağlanmaları jel ve fom oluşumunda kolaylık sağlar. � Jelatin jeli oluşumunda; *Jelatin konsantrasyonu…%4 -6 *Ortam sıcaklığı…… 350 C altına düşmemeli *Jelatin MA…. . MA <15 bin olursa…yumuşak jel; MA 60 bin-250 bin…sert jel *Şeker jölelere yumuşaklık verir, jelin olgunluğunu arttırır. * Az şeker, jel oluşma zamanını kısaltır; fazla şeker, jel oluşma zamanını uzatır.

Jelatin �Fom oluşturur (Kolloid sol durumda iken yüzey gerilimi çok düşük)

Proteinlerin Sınıflandırılması 2. Çözünmeyen basit proteinler Elastin � Sarı elastik dokunun karakteristik bir proteini. Tendonlarda, arterlerde ve diğer elastik dokularda bulunur. � Suda çözünmez. � Suda veya seyreltik asitlerde kaynatmakla, jelatin gibi suda çözümlenebilen bir şekle dönüşmez. � Saf halde soluk sarı renktedir. � Lösin, isolösin, glisin, prolin, valin içerir. � İçerdiği S miktarı az.

Proteinlerin Sınıflandırılması 2. Çözünmeyen basit proteinler Fibrin �Kanın pıhtılaşmasında etkili olan bir fibröz proteindir. Myosin �Kaslarda hücre içinde bulunur. �Sindirimi kolay bir proteindir. �Suda çözünmez.

Proteinlerin Sınıflandırılması II. Bileşik proteinler a. Fosfoproteinler b. Lipoproteinler c. Proteolipidler d. Glikoproteinler ve mukoproteinler e. Nükleoproteinler f. Kromoproteinler g. Metaloproteinler

II. Bileşik Proteinler Konjuge proteinler, heteroproteinler �Basit protein ve buna zayıf veya çok sağlam bir şekilde bağlanmış protein olmayan bazı maddelerden oluşmuşlardır. �Protein olmayan kısım “prostetik grup” adını alır. �Prostetik grupların pek çoğu proteine tuz benzeri bir bağlanma gösterirler

Proteinlerin Sınıflandırılması II. Bileşik proteinler a. Fosfoproteinler � Fosforik asit içeren proteinlerdir � Fosforik asitten dolayı asit karakter özelliği kazanır. � Fosfoproteinler suda hemen hiç çözünmezler � Süt, yumurta sarısı, havyar gibi besinlerde bulunur. � Sütte…kazein; yumurta sarısında…ovovitelin

Proteinlerin Sınıflandırılması II. Bileşik proteinler b. Lipoproteinler � Bileşiminde lipid bulunan proteinlerdir. � Bu proteinlerin lipid kısımları; TG (nötral yağ) serbest kolesterol ester kolesterol fosfatid yağ asitleridir

Proteinlerin Sınıflandırılması II. Bileşik proteinler c. Glikoproteinler; Mukoproteinler �CHO içeren bileşik proteinlerdir �Yaygın olarak bulunurlar �Glikoproteinler deride, kıkırdakta, kemiklerde, bağ dokuda, yumurta akında, kan serumunda, idrarda, tükürükte, mide sıvısında, gözde, vb. yerlerde bulunur.

Proteinlerin Sınıflandırılması II. Bileşik proteinler d. Nükleoproteinler �Nükleik asitlerle (DNA veya RNA) basit bazik proteinlerin (protaminler veya histonlar) yaptıkları bileşiklerdir. �Hücre çekirdeğinin temel elemanlarıdır. e. Kromoproteinler �Prostetik grup düşük molekül ağırlıklı pigment veya pigment benzeri maddelerdir. �Genelde bu pigmentler porfirin (hem, klorofil) yapıdadır.

Proteinlerin Sınıflandırılması II. Bileşik proteinler f. Metaloproteinler �Prostetik grup olarak metal bağlanmış proteinlerdir �Metal iyonları protein molekülüne sıkı bir şekilde bağlıdır. �Metal olarak, demir, bakır, çinko, kalsiyum gibi metaller bulunmaktadır.

Proteinlerin Sınıflandırılması Konfigürasyon Tipine Göre Proteinler Küresel (top şeklinde) ↓ Suda çözünür ↓ Globüler proteinler ↓ Myoglobin Uzunlamasına (bükülmüş ip şeklinde) ↓ Suda çözünmez ↓ Fibröz proteinler ↓ Kollajen

2. Konfigürasyon tipine göre proteinler A. � � Fibröz proteinler, Skleroproteinler; Suda çözünmezler Basit proteinlerdir Bir eksen boyunca uzanmış bir polipeptid yada birbirine paralel olarak yerleşmiş polipeptit zincirlerinden ibaret, çubuk şeklinde proteinlerdir. Yüksek organizmalarda bağ dokusunun temel elemanlarıdırlar.

2. Konfigürasyon tipine göre proteinler B. Globüler proteinler: �Bu tür proteinler toplu halde ve hemen yuvarlak bir yapıdadır. �Büyük bir kısmı sulu sistemlerde çözünür.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 1. 2. 3. 4. 5. 6. Proteinlerin molekül ağırlıkları Proteinlerin iyonlaşma özelliği Proteinlerin çözünürlük özelliği Proteinlerin optik aktiviteleri Proteinlerin çökelme özellikleri Proteinlerin denatürasyonu ve koagülasyonu

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 1. Proteinler yüksek MA sahip Makro moleküller. � MA, proteinlerin çeşidine göre 20. 000 -100. 000 dalton arasında değişir. � Polimerlerin genel özelliklerini gösterirler. � Moleküler yapının büyüklüğü nedeniyle kolloidal sol halinde bulunurlar.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 2. Proteinlerin iyonlaşma özelliği � AA’ler gibi amfoterik karaktere sahiptirler � Ortam p. H’sına göre katyon, anyon veya zwitterion oluştururlar. � İyonlaşabilen fonksiyonel grupların pek çoğu yan zincirlerden kaynaklanır. � Her proteinin kendine özgü izoelektirik p. H noktası vardır.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 3. Proteinlerin Çözünürlük Özelliği �Proteinlerin çözündüğü ortamlar genellikle su, gliserol veya formik asit gibi kuvvetli polar çözücülerdir. �Çözünürlük, proteinlerin yapısındaki hidrofilik ve hidrofobik gruplara bağlı olarak değişmektedir. �Çözünürlük özelliği göstermeyen proteinlerde şişme görülür.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 3. Proteinlerin Çözünürlük Özelliği � Amonyum sülfat gibi nötral tuzlar protein çözünürlüğü üzerinde 2 farklı etkiye sahiptir. Ø (salting-in etkisi) Ø (salting-out etkisi)

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 4. Proteinlerin Optik Aktiviteleri � Sulu çözeltilerde proteinler, proteinin yapısına bağlı olarak polarize ışığı -300 ile -600 arasında sola döndürürler. � Rotasyonun büyüklüğü proteinin yapısına göre değişir.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 5. Proteinlerin Çökelme Özellikleri � Proteinlerin bir çözücü içinde yük ve protein-çözücü etkileşimi tarafından kararlı halde tutulurlar. � Bu kararlı durum proteinin yapısında bulunan AA’lerin ve çözücü sistemin özelliklerine göre değişir.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 5. Proteinlerin Çökelme Özellikleri 5. 1. Proteinlerin izoelektrik noktada çöktürülmesi � Proteinler AA’ler gibi amfolit karakterdedir. � Asit çözeltilerde karışık katyonlar halinde bulunurlar. � Bu özellikteki çözelti alkali ile muamele edilirse, H+ iyonlarını vererek önce zwitterion şekli oluşur. � 5. 2. Ağır metal tuzları ile çöktürülmesi � Alkali koşullarda Hg+2, Pb+2, Cu+2, Ag+, Au+ gibi pozitif ağır metal iyonları ve tuzları proteinleri çöktürür.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 5. 3. Asit ile çöktürme � HCI, asetik asit, sülfürik asit, nitrik asit gibi asitler sulu çözelti halinde proteinleri çöktürürler. � Çöktürme işlemi ısı ile hızlanmaktadır.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 5. 4. Nötral tuzlarla çöktürme � Protein çözeltilerine amonyum sülfat, sodyum sülfat, magnezyum sülfat gibi nötral tuzların eklenmesi sonucu proteinler çökelirler. � Yüksek tuz konsantrasyonu, protein molekülünün etrafındaki su moleküllerine etki ederek çözünürlükten sorumlu elektrostatik güçleri değiştirir. � Tuz ile çöktürme ortamın p. H ve tuz konsantrasyonundan etkilenir.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 5. 5. Organik çözücülerde çöktürme � Protein çözeltilerine etil alkol ve aseton gibi bazı organik çözücüler eklenmesi ile proteinleri çökeltir. � Çökelme, proteinin izoelektrik noktasında çok kolay olur. � Çökelmede genellikle denatürasyon görülmez. 5. 6. Polimerlerle çöktürme � Polietilaminler, polietilenglikoller gibi polimerlerden yararlanılırlar. � Polimerlerle çöktürmenin prensibi, proteinlerin organik çözcülerle çöktürülmesine dayanmaktadır.

Proteinlerin Fiziksel, Fizikokimyasal ve Kimyasal Özellikleri 6. Proteinlerin denatürasyonu ve koagülasyonu � Denatürasyon sürecinde proteinlerin primer yapısında yer alan peptid bağları zarar görmeden kuarterner, tersiyer ve sekonder yapısındaki bağlar parçalanır.

Proteinlerin Genel Özellikleri 6. Proteinlerin denatürasyonu ve koagülasyonu DENATÜRASYON Üç boyutlu protein yumağı açılır ↓ Polipeptid zinciri kırılmaz. Yapı kısmen değişir. ↓ KISMEN GERİ DÖNÜŞLÜ


6. Proteinlerin denatürasyonu ve koagülasyonu KOAGÜLASYON Kolloid solüsyonlarda dağılan kısmın dağılma özelliği azalır ↓ Dağıtan kısımdan ayrılır ↓ Çok katı olmayan bir yapı oluşur ↓ Kolloid sistemlerde açılan polipeptid zinciri üzerinde iyonize olabilen gruplar açığa çıkar ↓ Bu gruplar yeni bağlar oluştururlar ↓ Polipeptid zinciri doğal haline göre değişik ve gelişigüzel bir şekilde sıkılaşır. ↓ Koagülasyon ↓ Geri dönüş yok

Denatürasyona yol açan önemli etkenler; Isıl işlemler; �Proteinlerin denatürasyonunda en önemli fiziksel etken ısıl işlemlerdir. �Denatürasyonun hızı; ısıl işlemin şiddetine (sıcaklık derecesi ve uygulama süresi) bağlıdır. �Sıcaklık derecesindeki 100 C’lik artış denatürasyon hızını 2 kat arttırır.

Denatürasyona yol açan önemli etkenler; Soğuk işlemler; �Soğuk uygulamalar bazı proteinlerin denatürasyona uğramasına neden olabilmektedir. �Bazı enzimler oda sıcaklığında stabil oldukları halde, 00 C’de bu özelliklerini yitirirler. �Bazı proteinler soğukta bırakıldığında veya dondurulduklarında agregasyona yada presitipasyona uğrardıklarından çözünürlük özelliklerini kaybederler.

Denatürasyona yol açan önemli etkenler; Mekanik işlemler; �Çalkalama, karıştırma, parçalama, yoğurma, dövme vb. mekanik işlemler neden olur. �Denatürasyon bu işlemlerin şiddetine bağlıdır. �Denatürasyon, hava kabarcıklarının birleşmesi ve protein moleküllerinin hava-sıvı yüzey arasına adsorbsiyonu sonucu oluşur. �Hamurun yoğrulması, açılması proteinlerin büzüşme kuvvetleri nedeniyle denatüre olmalarına neden olur. �Yumurta akının çırpılması sırasında mekanik etki proteinlerin kısmı bir koagülasyonuna neden olur.

Denatürasyona yol açan önemli etkenler; Asitler ve Bazlar; �Ortam p. H’sı protein denatürasyonunda etkilidir. �Protein izoelektrik p. H noktasında denatürasyona daha dirençlidirler. �p. H değerleri çok uç değerlere ulaştığında molekül içindeki iyonize grupların uğradığı çok kuvvetli elektrostatik itme proteinlerin denatürasyonuna neden olur.

Denatürasyona yol açan önemli etkenler; Metaller; �Alkali metaller (Na, K iyonları) bazı proteinler ile rxn girerken, �Toprak alkalileri (Ca, Mg) proteinlere karşı daha reaktiftir. Enzimler; �Enzimler protein denatürasyon nedenidir. Organik çözücüler; �Organik çözücüler ortamın dielektrik sabitini düşürerek proteinlerin stabilitesini sağlayan elektrostatik gücün azalmasına neden olurlar.

Bazı özel durumlarda protein denatürasyonu istenen bir özelliktir. Daha iyi sindirilebilir. • Daha iyi köpürme özelliği kazanır. • Daha iyi emülsifiye edici özellik kazanır. •

Protein denatürasyonu sonucu; �Hidrofobik grupların maskelenmesinin bir sonucu olarak çözünürlük azalır �Su bağlama kapasitesi düşer �Sülfidril ve fenol grupları artar �Biyolojik aktiviteleri kaybolur �Proteaz etkisine duyarlılık artar �Ürüne özgü viskozite artar �Kristalize olma özelliği kaybolur �Rotasyon ve difüzyon stabilitelerinde değişiklikler olur
 üleştirme sayıların yazımı
üleştirme sayıların yazımı Protenler
Protenler Proteinler kaça ayrılır
Proteinler kaça ayrılır Protenler
Protenler Protenler
Protenler Emel emregül
Emel emregül Matrisin tersi nasıl alınır
Matrisin tersi nasıl alınır Detrusor kası
Detrusor kası Geometrik şekillerin simetrik doğruları
Geometrik şekillerin simetrik doğruları Karl gross oyun kuramı
Karl gross oyun kuramı Bir karakterin birden fazla allele bulunabilir
Bir karakterin birden fazla allele bulunabilir Olumlu izlenim bırakacak beden dili hareketleri
Olumlu izlenim bırakacak beden dili hareketleri Rahatlama ve dinlenme kuramı
Rahatlama ve dinlenme kuramı Rüzgarın etkili olduğu yerler
Rüzgarın etkili olduğu yerler Bir modeme en fazla kaç kişi bağlanabilir
Bir modeme en fazla kaç kişi bağlanabilir Nutrena enteral
Nutrena enteral Samimiyet
Samimiyet Gereğinden az genelleme örnekleri
Gereğinden az genelleme örnekleri Dersn
Dersn Den daha az sıklıkları bulma
Den daha az sıklıkları bulma Daha iyiye en ileriye
Daha iyiye en ileriye Nota sesi bilgisi
Nota sesi bilgisi Bu konuyu bir daha açmayacağım
Bu konuyu bir daha açmayacağım Nota alfabesi
Nota alfabesi Dal yaprak grafiği hesaplama
Dal yaprak grafiği hesaplama Sarı ve cyan filtreler
Sarı ve cyan filtreler Niçin güneşi aydan daha küçük görürüz
Niçin güneşi aydan daha küçük görürüz Senden bir tane daha yok
Senden bir tane daha yok Excel aritmetik işlem operatörü
Excel aritmetik işlem operatörü Duygu tndgn mesaj
Duygu tndgn mesaj Okul veya mezuniyet derecesi uygunsuz
Okul veya mezuniyet derecesi uygunsuz Bir kişiye maddeye cihaza işe veya iş yürütümüne
Bir kişiye maddeye cihaza işe veya iş yürütümüne Bir kişiye maddeye cihaza işe veya iş yürütümüne
Bir kişiye maddeye cihaza işe veya iş yürütümüne Bir pist veya alanda yapılan
Bir pist veya alanda yapılan Snr değerleri
Snr değerleri Lgl kolesterol
Lgl kolesterol Matematikte bölme işareti olarak kullanılır
Matematikte bölme işareti olarak kullanılır Bir kişiye maddeye cihaza işe veya iş yürütümüne
Bir kişiye maddeye cihaza işe veya iş yürütümüne Kuduz aşısını edison bulmuştur
Kuduz aşısını edison bulmuştur Geometrik şekil resim sembol piktogram
Geometrik şekil resim sembol piktogram Yurtları veya yurt duyguları aynı olanlardan her biri
Yurtları veya yurt duyguları aynı olanlardan her biri Arduino delay komutu
Arduino delay komutu Desobel sirop
Desobel sirop Bir pist veya alanda yapılan
Bir pist veya alanda yapılan Kılavuzsuz yük nedir
Kılavuzsuz yük nedir