Jay Phelan Maria Cristina Pignocchino Le scienze naturali






















- Slides: 28


Jay Phelan, Maria Cristina Pignocchino Le scienze naturali I modelli della chimica e della genetica 2

Capitolo 1 Un modello per l’atomo 3 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 1 Dall’osservazione ai modelli 4 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

1. La scienza indaga: macromondo e micromondo Per studiare le relazioni tra micromondo e macromondo è necessario elaborare metodi e strumenti capaci di superare i limiti dell’osservazione diretta e costruire modelli per rappresentare i fenomeni. 5 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

2. I modelli sono utili ma non definitivi I modelli sono rappresentazioni semplificate e provvisorie di fenomeni complessi. Devono essere sottoposti a verifica sperimentale e non sono mai definitivi: possono essere modificati, corretti o abbandonati. 6 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 2 La sorprendente natura dell’atomo 7 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

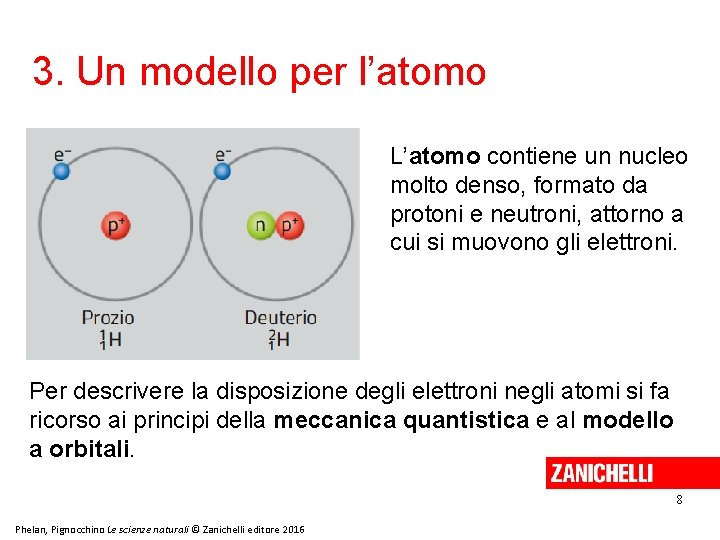
3. Un modello per l’atomo L’atomo contiene un nucleo molto denso, formato da protoni e neutroni, attorno a cui si muovono gli elettroni. Per descrivere la disposizione degli elettroni negli atomi si fa ricorso ai principi della meccanica quantistica e al modello a orbitali. 8 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

4. Una logica nuova: non si può determinare la traiettoria di un elettrone Secondo il principio di indeterminazione, è impossibile misurare precisamente e contemporaneamente sia la posizione sia la velocità di una particella piccola e leggera come l’elettrone. Infatti è impossibile studiare l’elettrone senza fornirgli energia, alterando di conseguenza la sua velocità o la sua posizione. 9 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

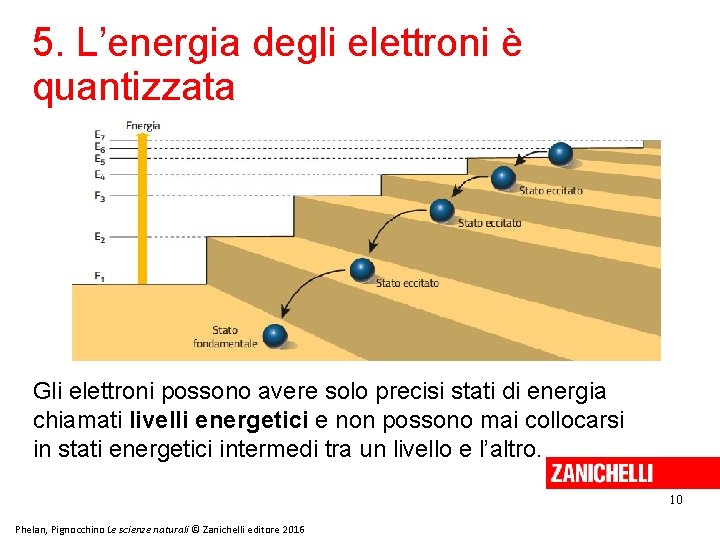
5. L’energia degli elettroni è quantizzata Gli elettroni possono avere solo precisi stati di energia chiamati livelli energetici e non possono mai collocarsi in stati energetici intermedi tra un livello e l’altro. 10 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 3 Dagli orbitali alle configurazioni elettroniche 11 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

6. L’orbitale: dove è probabile trovare l’elettrone Ogni elettrone nell’atomo può essere descritto da un modello matematico, chiamato orbitale. L’orbitale rappresenta uno stato energetico possibile dell’elettrone e identifica la regione dello spazio entro cui si ha una probabilità del 90% di trovare l’elettrone stesso. 12 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

7. Ogni orbitale è identificato da tre numeri quantici /1 Il numero quantico principale (n) definisce il livello energetico a cui appartiene l’orbitale; n può assumere solo un valore intero positivo: 1, 2, 3… Chiamiamo livello energetico l’insieme di tutti gli elettroni che hanno il medesimo valore di n. 13 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

7. Ogni orbitale è identificato da tre numeri quantici /2 Il numero quantico secondario (l) definisce la forma dell’orbitale e il sottolivello energetico; l assume solo valori interi, positivi, compresi tra 0 e (n-1). 14 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

7. Ogni orbitale è identificato da tre numeri quantici /3 Il numero quantico magnetico (m) definisce il diverso orientamento nello spazio degli orbitali con lo stesso valore di l; m assume tutti i valori interi compresi tra –l e +l (zero incluso). 15 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

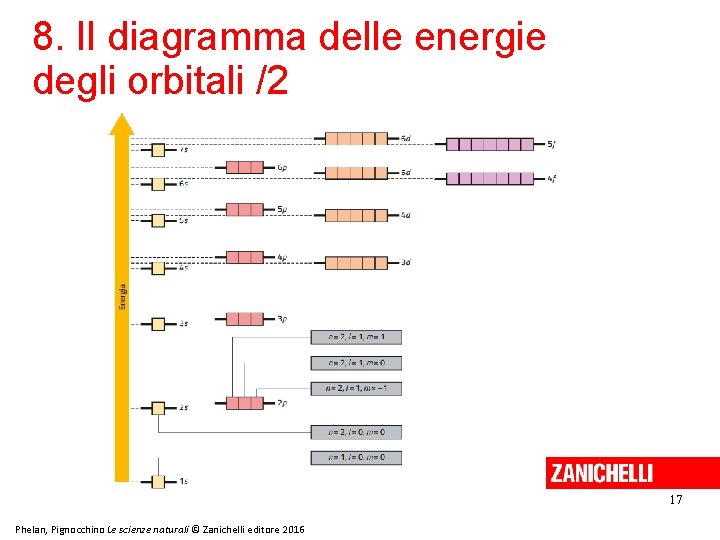
8. Il diagramma delle energie degli orbitali /1 È possibile costruire un diagramma in cui gli orbitali siano disposti in ordine crescente. Questo diagramma segue l’ordine dei livelli energetici fino al sottolivello 3 p. 16 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

8. Il diagramma delle energie degli orbitali /2 17 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

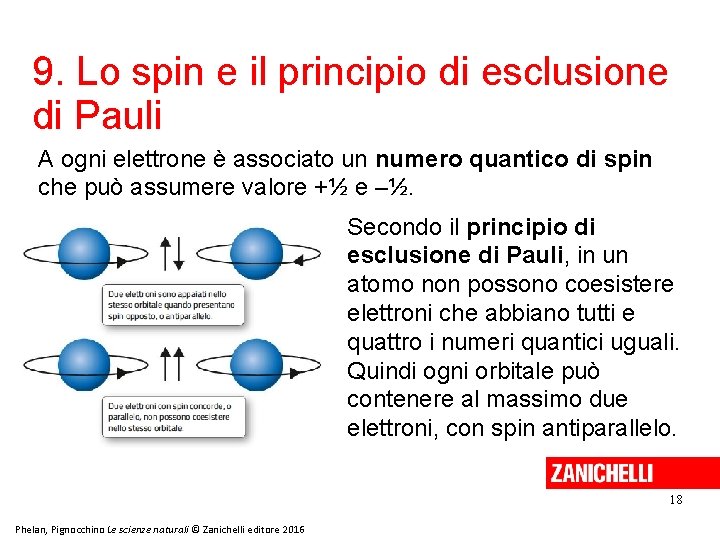
9. Lo spin e il principio di esclusione di Pauli A ogni elettrone è associato un numero quantico di spin che può assumere valore +½ e –½. Secondo il principio di esclusione di Pauli, in un atomo non possono coesistere elettroni che abbiano tutti e quattro i numeri quantici uguali. Quindi ogni orbitale può contenere al massimo due elettroni, con spin antiparallelo. 18 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

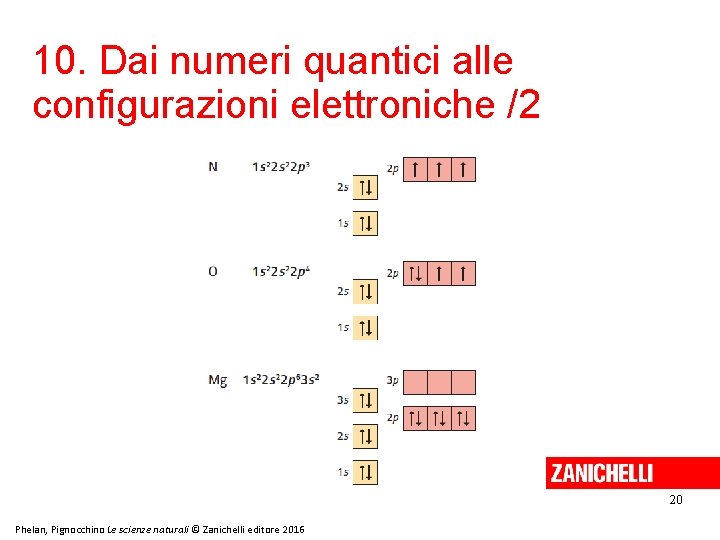
10. Dai numeri quantici alle configurazioni elettroniche /1 La configurazione elettronica di un atomo si scrive tenendo conto che: 1. gli orbitali si riempiono in ordine di energia crescente; 2. ogni orbitale può essere occupato al massimo da due elettroni con spin antiparallelo; 3. in ogni sottolivello gli elettroni si dispongono in modo da occupare il maggior numero possibile di orbitali e tendono, se non accoppiati, ad avere spin parallelo. 19 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

10. Dai numeri quantici alle configurazioni elettroniche /2 20 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 4 Gli elettroni di valenza e le proprietà degli elementi 21 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

11. Ogni atomo ha un core e un livello di valenza Gli elettroni del livello più esterno di un atomo sono detti elettroni di valenza; tutti gli altri costituiscono il suo core. La distribuzione degli elettroni nel livello più esterno è chiamata configurazione elettronica esterna. Gli elementi di un gruppo hanno la medesima configurazione elettronica esterna. 22 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

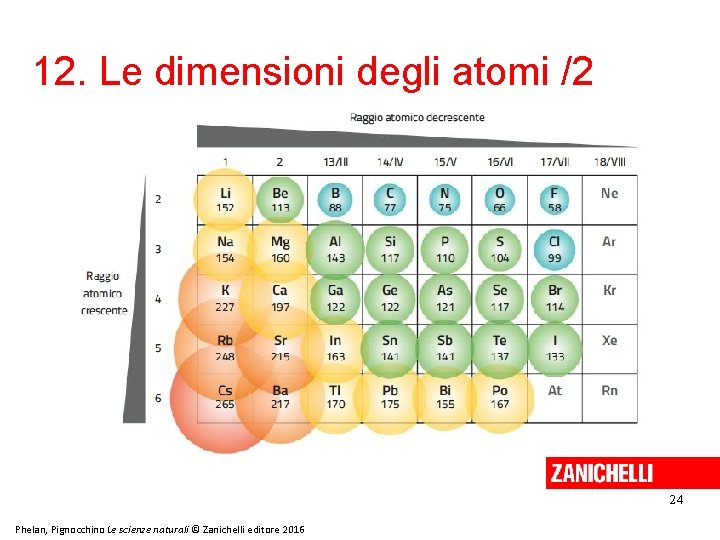
12. Le dimensioni degli atomi /1 Il raggio atomico misura la distanza media di un nucleo dagli elettroni più esterni ed è la metà della distanza tra due nuclei di atomi uguali legati tra loro. Nella tavola periodica, in modo non sempre regolare il raggio atomico diminuisce nei periodi da sinistra verso destra e aumenta lungo i gruppi dall’alto verso il basso. 23 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

12. Le dimensioni degli atomi /2 24 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

13. Energia di ionizzazione e affinità elettronica /1 L’energia di prima ionizzazione è l’energia necessaria per allontanare un elettrone da un atomo neutro allo stato gassoso, espressa in k. J/mol. Nella tavola periodica, i valori di questa grandezza crescono lungo ogni periodo e decrescono in ogni gruppo. 25 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

13. Energia di ionizzazione e affinità elettronica /2 L’affinità elettronica è l’energia emessa o assorbita quando si aggiunge un elettrone a un atomo neutro allo stato gassoso, trasformandolo in uno ione negativo. Nella tavola periodica, i valori di questa grandezza crescono lungo ogni periodo e decrescono in ogni gruppo. 26 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

13. Energia di ionizzazione e affinità elettronica /3 27 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

14. Dagli atomi agli ioni Gli atomi dei gas nobili hanno una configurazione elettronica particolarmente stabile, che li rende inerti dal punto di vista della reattività chimica. I metalli formano facilmente cationi con la configurazione elettronica del gas nobile che li precede nella tavola periodica. I non metalli formano facilmente anioni con la configurazione elettronica del gas nobile che li segue. 28 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016
 Scienze
Scienze Anno sidereo
Anno sidereo Phelan pignocchino biologia
Phelan pignocchino biologia Soluzioni il racconto della chimica
Soluzioni il racconto della chimica Dolly unimore scienze naturali
Dolly unimore scienze naturali Le proprietà delle soluzioni zanichelli capitolo 13
Le proprietà delle soluzioni zanichelli capitolo 13 Ciclo di calvin
Ciclo di calvin Soluzioni il racconto della chimica
Soluzioni il racconto della chimica Chimica più soluzioni capitolo 17
Chimica più soluzioni capitolo 17 Il racconto della chimica e della terra soluzioni
Il racconto della chimica e della terra soluzioni Scienze naturali campusnet
Scienze naturali campusnet Monumento a maria cristina d'austria
Monumento a maria cristina d'austria Dra maria cristina purini
Dra maria cristina purini Maria cristina purini
Maria cristina purini Monumento funebre di clemente xiv
Monumento funebre di clemente xiv Maria cristina girotti
Maria cristina girotti 15092009 color
15092009 color Seconda legge di newton
Seconda legge di newton Heinz hartmann biografia
Heinz hartmann biografia Maria cristina cataudella
Maria cristina cataudella Maria cristina cataudella
Maria cristina cataudella Paravidas cloud 9 letra
Paravidas cloud 9 letra Rick phelan
Rick phelan Lorraine phelan
Lorraine phelan Siobhan phelan
Siobhan phelan Indice ila
Indice ila Oración a chiquitunga para pedir un milagro
Oración a chiquitunga para pedir un milagro Rappresentazione numeri naturali
Rappresentazione numeri naturali L'incapacità legale
L'incapacità legale