Jay Phelan Maria Cristina Pignocchino Le scienze naturali


















- Slides: 22


Jay Phelan, Maria Cristina Pignocchino Le scienze naturali I modelli della chimica e della genetica 2

Capitolo 3 I composti inorganici 3 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 1 Le regole per scrivere le formule 4 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

1. Composti inorganici e organici I composti si suddividono in due categorie fondamentali: • i composti organici sono i composti del carbonio; • i composti inorganici sono i composti formati da tutti gli altri elementi e comprendono anche gli ossidi del carbonio e i loro derivati, i cianuri e i carburi. 5 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

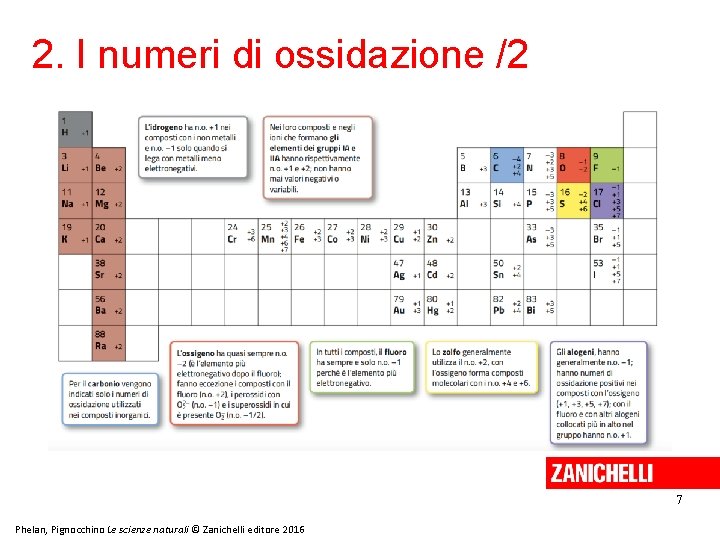
2. I numeri di ossidazione /1 Il numero di ossidazione (n. o. ) indica la carica reale o formale assegnata a ciascun atomo o ione nella formula di una sostanza. Il suo valore dipende dal numero di elettroni persi o acquistati. Nel caso di una sostanza molecolare, il numero di ossidazione indica la carica formale. 6 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

2. I numeri di ossidazione /2 7 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

3. Come si assegnano i numeri di ossidazione in una formula? • In un composto i numeri di ossidazione sono assegnati attribuendo gli elettroni di legame all’atomo più elettronegativo. • In un elemento puro gli atomi hanno sempre numero di ossidazione zero. • Il numero di ossidazione di uno ione è uguale alla sua carica. 8 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

4. Dai numeri di ossidazione alle formule dei composti binari Per scrivere le formule dei composti binari: • si scrivono i simboli degli elementi indicando prima l’elemento meno elettronegativo, poi quello più elettronegativo; • se i numeri di ossidazione (n. o. ) sono diversi per valore e segno, a ogni elemento si assegno come indice il n. o. dell’altro elemento, senza segno. • se i n. o. sono anche multipli tra loro (per esempio – 2 e +6), devono essere semplificati 9 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 2 I composti binari 10 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

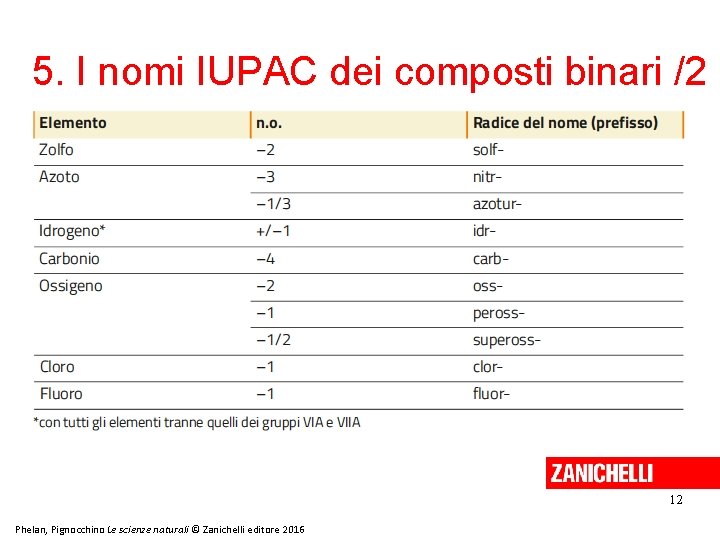
5. I nomi IUPAC dei composti binari /1 Secondo la nomenclatura IUPAC dei composti binari: • l’elemento scritto a destra è denominato prima di quello a sinistra; • quando nella formula compaiono più atomi per ciascun elemento, si utilizza un prefisso numerico. 11 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

5. I nomi IUPAC dei composti binari /2 12 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

6. Tre importanti classi di composti binari: sali, idruri e idracidi /1 I sali binari contengono uno o più atomi di un metallo uniti con uno o più atomi di un non metallo, prevalentemente zolfo o un alogeno. Nella nomenclatura tradizionale non si usano i prefissi dei numeri degli atomi presenti. 13 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

6. Tre importanti classi di composti binari: sali, idruri e idracidi /2 Gli idruri sono composti binari dell’idrogeno (con n. o. = – 1) tranne quelli che contengono elementi dei gruppi VIA e VIIA. Gli idracidi sono i composti dell’idrogeno (n. o. = +1) con gli alogeno e con gli elementi del gruppo VIA (tranne l’ossigeno). 14 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

7. Gli ossidi e i perossidi /1 Gli ossidi sono i composti che contengono ossigeno con numero di ossidazione – 2. La nomenclatura tradizionale distingue gli ossidi dei metalli dagli ossidi dei non metalli, chiamati anidridi. 15 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

7. Gli ossidi e i perossidi /2 I perossidi contengono due atomi di ossigeno uniti tra loro con un legame covalente semplice. L’ossigeno in questi composti ha n. o. – 1. 16 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 3 I composti ternari e quaternari 17 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

8. I composti ternari sono composti inorganici formati da tre elementi differenti. I più importanti sono composti che contengono ossigeno combinato con altri due elementi: • idrossidi (metallo + ossigeno + idrogeno); • ossiacidi (non metallo + ossigeno + idrogeno); • sali ossigenati (metallo + ossigeno + non metallo). 18 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

9. Gli idrossidi contengono un metallo (M) unito a uno o più gruppi ossidrile (–OH). La formula generale degli idrossidi è: Il numero di gruppi –OH nella formula è uguale al n. o. del metallo, privo di segno. 19 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

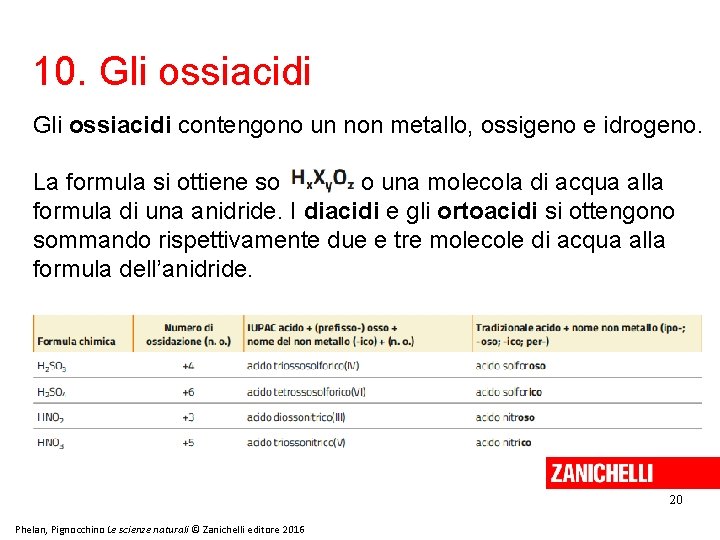
10. Gli ossiacidi contengono un non metallo, ossigeno e idrogeno. La formula si ottiene sommando una molecola di acqua alla formula di una anidride. I diacidi e gli ortoacidi si ottengono sommando rispettivamente due e tre molecole di acqua alla formula dell’anidride. 20 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

11. Gli anioni degli ossiacidi In acqua gli ossiacidi possono ionizzare i legami O–H liberando ioni H+ e formando anioni chiamati ossianioni. L’ossianione ha sempre una carica di segno opposto, ma di valore uguale al numero di ioni H+ che ha perso. Il numero di ioni H+ che si possono staccare dipende dal numero di gruppi –OH. 21 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

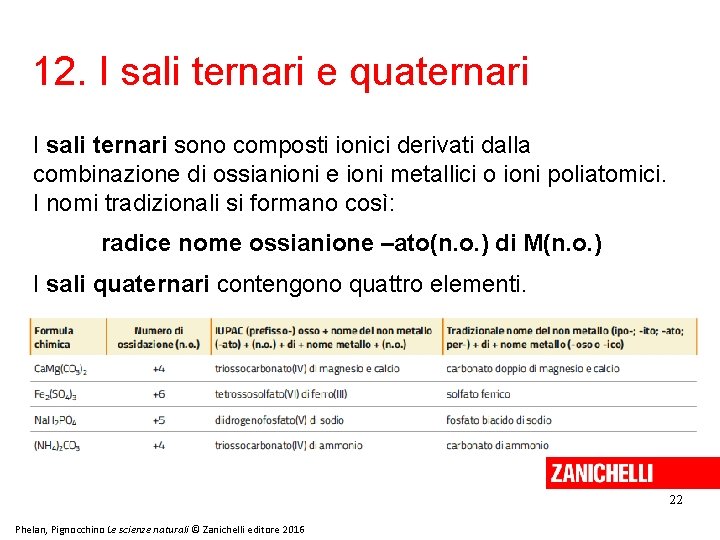
12. I sali ternari e quaternari I sali ternari sono composti ionici derivati dalla combinazione di ossianioni e ioni metallici o ioni poliatomici. I nomi tradizionali si formano così: radice nome ossianione –ato(n. o. ) di M(n. o. ) I sali quaternari contengono quattro elementi. 22 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016
 Scienze
Scienze Maria cristina pignocchino
Maria cristina pignocchino Phelan pignocchino biologia
Phelan pignocchino biologia Il racconto della chimica e della terra soluzioni
Il racconto della chimica e della terra soluzioni Scienze naturali campusnet
Scienze naturali campusnet Legge di proust
Legge di proust Dolly unimore scienze naturali
Dolly unimore scienze naturali Il racconto della chimica soluzioni
Il racconto della chimica soluzioni Racconto delle scienze naturali
Racconto delle scienze naturali Il racconto della chimica e della terra soluzioni
Il racconto della chimica e della terra soluzioni Soluzioni capitolo 17
Soluzioni capitolo 17 Maria cristina cataudella
Maria cristina cataudella Maria cristina cataudella
Maria cristina cataudella Rosa clotilde sabattini
Rosa clotilde sabattini Monumento funerario di clemente xiv
Monumento funerario di clemente xiv Maria cristina purini
Maria cristina purini Maria cristina purini
Maria cristina purini Monumento funebre di clemente xiv
Monumento funebre di clemente xiv Maria cristina girotti
Maria cristina girotti Color 15092009
Color 15092009 Seconda legge di newton
Seconda legge di newton Maria cristina hartmann
Maria cristina hartmann Indice de phelan
Indice de phelan