Jay Phelan Maria Cristina Pignocchino Le scienze naturali
















- Slides: 17


Jay Phelan, Maria Cristina Pignocchino Le scienze naturali I modelli della chimica e della genetica 2

Capitolo 4 Le reazioni dei composti inorganici 3 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 1 Impariamo a usare le equazioni 4 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

1. Equazioni e reazioni Nelle reazioni gli atomi e gli ioni rompono i legami che li uniscono e ne formano di nuovi, diversi da quelli iniziali per natura, polarità o numero. L’equazione bilanciata ci permette di conoscere: • i cambiamenti di composizione che avvengono nel sistema; • i rapporti numerici tra le particelle dei reagenti e dei prodotti. 5 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

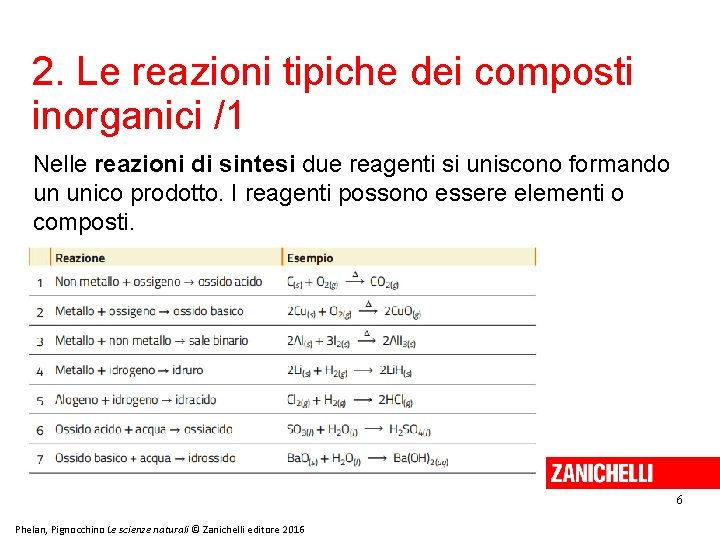
2. Le reazioni tipiche dei composti inorganici /1 Nelle reazioni di sintesi due reagenti si uniscono formando un unico prodotto. I reagenti possono essere elementi o composti. 6 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

2. Le reazioni tipiche dei composti inorganici /2 Nelle reazioni di decomposizione un composto viene scisso e dà origine a due o più prodotti. I prodotti di decomposizione possono essere elementi o composti. 7 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

2. Le reazioni tipiche dei composti inorganici /3 Nelle reazioni di spostamento (o scambio) un atomo o uno ione presente in un composto viene sostituito da un atomo o uno ione più reattivo. 8 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

2. Le reazioni tipiche dei composti inorganici /4 Nelle reazioni di doppio scambio due composti si scambiano atomi o ioni formando così composti diversi. In base ai prodotti che si ottengono, queste reazioni si distinguono in: • reazioni di precipitazione; • reazioni di neutralizzazione; • reazioni con formazione di gas. 9 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 2 Moli ed equazioni 10 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

3. Il significato dei coefficienti stechiometrici I coefficienti stechiometrici esprimono i rapporti numerici tra le particelle, le moli, le massi molari dei reagenti consumati e dei prodotti. N 2 + 3 H 2 → 2 NH 3 Conoscendo le masse molari e moltiplicandole per i coefficienti stechiometrici, si può risalire ai rapporti di combinazione in grammi tra reagenti e prodotti. 11 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

4. I calcoli stechiometrici sono le procedure matematiche adottate per calcolare il numero di moli o la massa di una sostanza che si consuma o si produce in una reazione. Per risolvere problemi stechiometrici, si utilizzano le relazioni tra il numero di moli, masse molari e masse delle sostanze coinvolte nella reazione. 12 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

5. Il reagente limitante A volte le masse dei reagenti non rispettano i rapporti indicati dai coefficienti stechiometrici. In questi casi il reagente in eccesso resta in parte inalterato, mentre si consuma totalmente solo il reagente limitante. Dal reagente limitante dipende la quantità di prodotto che si può ottenere. Per i calcoli stechiometrici bisogna utilizzare come riferimento il reagente limitante. 13 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

Lezione 3 I gas nelle reazioni 14 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

6. I gas e il principio di Avogadro Secondo il principio di Avogadro, volumi uguali di gas diversi, misurati nelle stesse condizioni di temperatura e pressione, contengono lo stesso numero di particelle. Il volume di un gas non dipende quindi dalla dimensione, composizione o massa delle particelle. 15 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

7. Il volume molare Alla condizione standard, con temperatura di 0° C e pressione di 1 atm, una mole di gas occupa un volume pari a 22, 414 L. Tale volume, chiamato Volume molare standard (Vms) è indipendente dal valore della massa molare della sostanza. Vms è di poco superiore al volume di un pallone da basket ed è quasi del tutto vuoto, anche se contiene un numero di particelle 1014 volte più grande della popolazione mondiale. 16 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016

8. I gas e i calcoli stechiometrici Ai prodotti e reagenti gassosi si applica il principio di Avogadro, quindi i coefficienti stechiometrici dell’equazione indicano anche i rapporti numerici tra i volumi molari dei gas. N 2 + 3 H 2 → 2 NH 3 17 Phelan, Pignocchino Le scienze naturali © Zanichelli editore 2016
 Phelan pignocchino le scienze naturali
Phelan pignocchino le scienze naturali Precessione degli equinozi zanichelli
Precessione degli equinozi zanichelli Phelan pignocchino biologia
Phelan pignocchino biologia Il racconto delle scienze naturali
Il racconto delle scienze naturali Klein soluzioni
Klein soluzioni Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Il racconto della chimica e della terra soluzioni
Il racconto della chimica e della terra soluzioni Scienze naturali campusnet
Scienze naturali campusnet Leggi ponderali della chimica zanichelli
Leggi ponderali della chimica zanichelli Dolly unimore scienze naturali
Dolly unimore scienze naturali Il racconto della chimica soluzioni
Il racconto della chimica soluzioni 15092009 color
15092009 color Seconda legge di newton
Seconda legge di newton Maria cristina hartmann
Maria cristina hartmann Maria cristina cataudella
Maria cristina cataudella Maria cristina cataudella
Maria cristina cataudella Paravidas cloud 9 letra
Paravidas cloud 9 letra Monumento a maria cristina d'austria
Monumento a maria cristina d'austria