Hydrognation des olfines Hydrognation asymtrique des olfines Hydrognation

























- Slides: 37

Hydrogénation des oléfines Hydrogénation asymétrique des oléfines Hydrogénation des imines, carbonyles. . . Master 1 CV et CMSM chimie organométallique 1

Hydrogénation des oléfines Master 1 CV et CMSM chimie organométallique 2

Hydrogénation des oléfines Master 1 CV et CMSM chimie organométallique 3

Hydrogénation des oléfines Catalyseur de Wilkinson (prix Nobel de chimie en 1973) découvert en 1961 : Rh. Cl(PPh 3)3 1 atmosphère de H 2, 25° C Rh. Cl 3 + 4 PPh 3 PCl 2 + 2 Et. OH Master 1 CV et CMSM Et. OH Rh. Cl(PPh 3)3 + Ph 3 PCl 2 Ph 3 P=O + 2 HCl + Et 2 O chimie organométallique 4

Master 1 CV et CMSM chimie organométallique 5

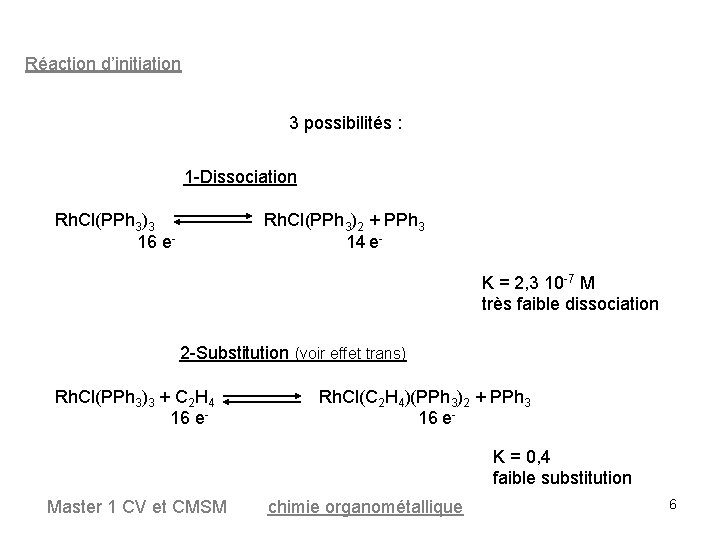
Réaction d’initiation 3 possibilités : 1 -Dissociation Rh. Cl(PPh 3)3 16 e- Rh. Cl(PPh 3)2 + PPh 3 14 e. K = 2, 3 10 -7 M très faible dissociation 2 -Substitution (voir effet trans) Rh. Cl(PPh 3)3 + C 2 H 4 16 e- Rh. Cl(C 2 H 4)(PPh 3)2 + PPh 3 16 e. K = 0, 4 faible substitution Master 1 CV et CMSM chimie organométallique 6

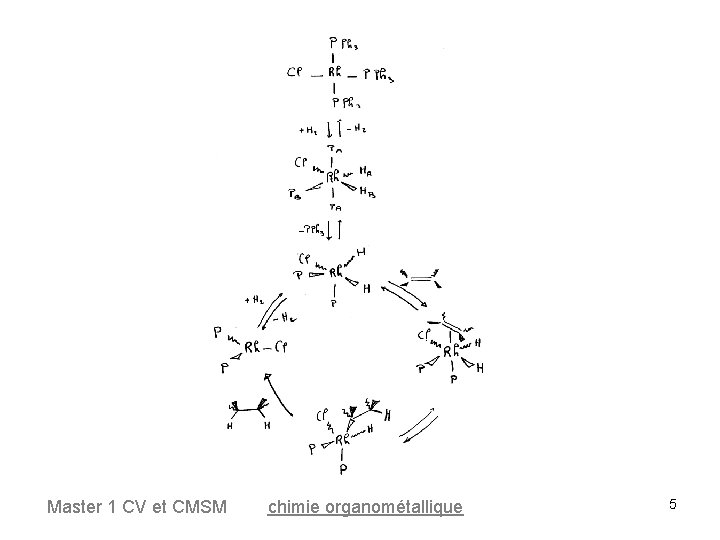
3 -Réaction d’addition oxydante I III d 8 16 e- rouge jaune d 6 18 e- Réaction rapide à 25°C Espèces observées et caractérisées en solution par RMN 1 H et 31 P Master 1 CV et CMSM chimie organométallique 7

Formation du complexe dihydrure (en cis) Master 1 CV et CMSM chimie organométallique 8

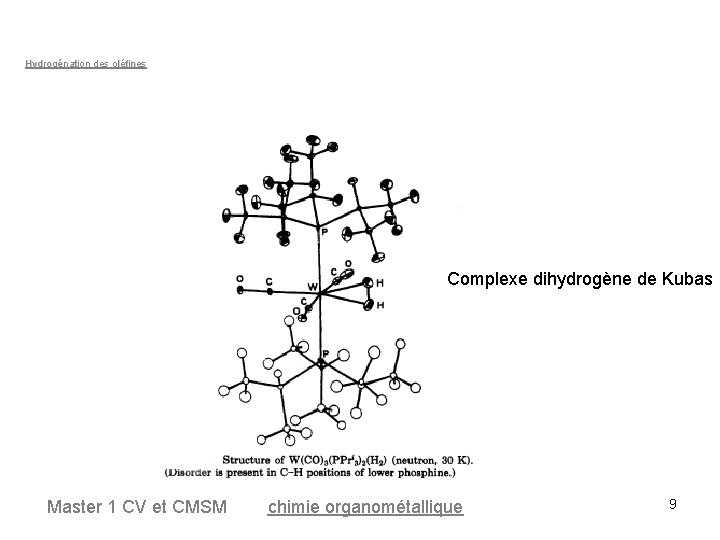
Hydrogénation des oléfines Complexe dihydrogène de Kubas Master 1 CV et CMSM chimie organométallique 9

III 18 e- 16 e- Dissociation rapide en solution à 25°C Etudes par RMN 31 P Master 1 CV et CMSM chimie organométallique 10

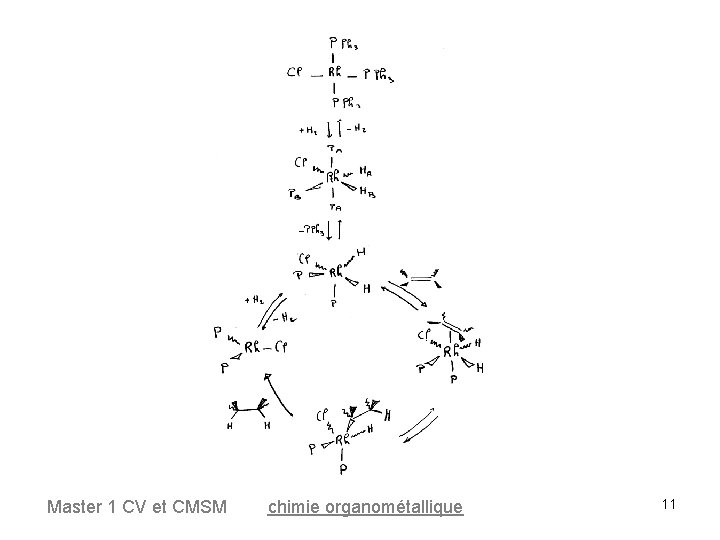
Master 1 CV et CMSM chimie organométallique 11

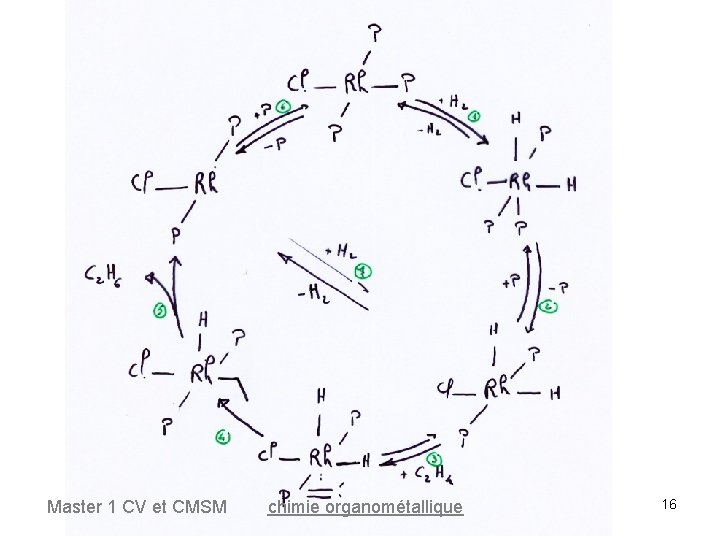
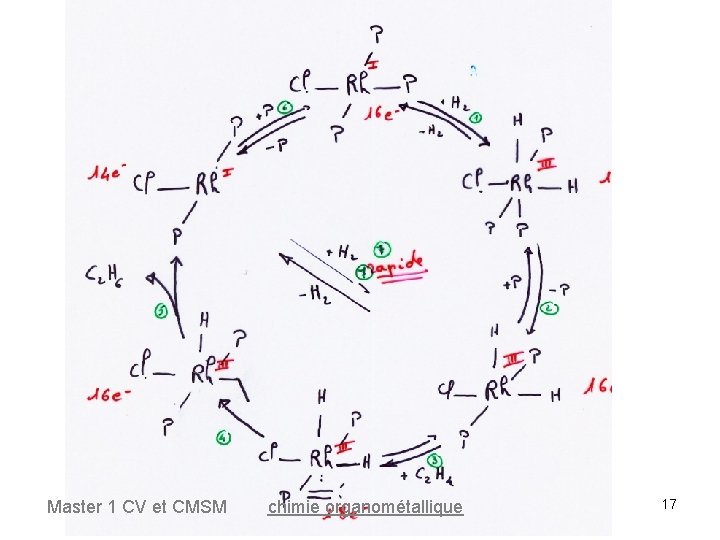
Cycle catalytique 16 e- Master 1 CV et CMSM 18 e- chimie organométallique 12

Hydrogénation des oléfines Réaction d ’insertion-migratoire Master 1 CV et CMSM chimie organométallique 13

Élimination réductrice B A Master 1 CV et CMSM chimie organométallique 14

Hydrogénation des oléfines L'hydrogénation se fait en cis Master 1 CV et CMSM chimie organométallique 15

Master 1 CV et CMSM chimie organométallique 16

Master 1 CV et CMSM chimie organométallique 17

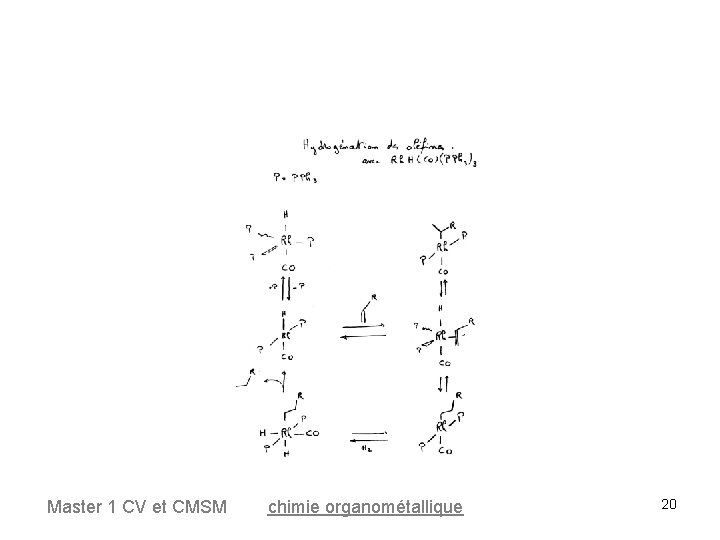
Hydrogénation des oléfines L'addition d'un excès de PPh 3 ou de CO inhibe la réaction une espèce très active est donc le complexe à 14 e. Rh. Cl(PPh 3)2 + PPh 3 Rh. Cl(PPh 3)3 La réaction de dissociation/addition est très rapide, elle est fortement déplacée vers l'espèce à 16 e- Rh. Cl(PPh 3)3 Master 1 CV et CMSM chimie organométallique 18

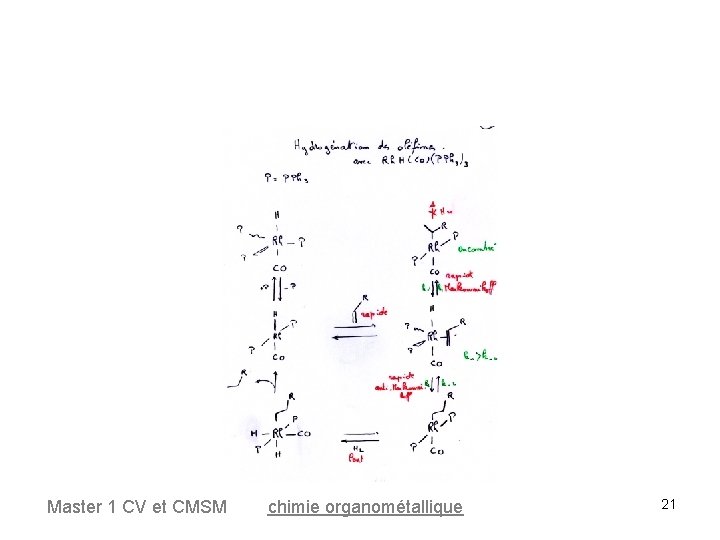
Hydrogénation des oléfines Autres catalyseurs • de G. Wilkinson complexes hydrures de Rh ou Ir (réalisant également la catalyse de l'hydroformylation des oléfines) Rh. H(CO)(PPh 3)3 • Catalyseur de Crabtree 198 : [Ir. PPh 3)py. S 2]+ Master 1 CV et CMSM chimie organométallique 19

Master 1 CV et CMSM chimie organométallique 20

Master 1 CV et CMSM chimie organométallique 21

Hydrogénation des oléfines Dans le cas de Rh. H(CO)(PPh 3)3, l'hydrogénation est beaucoup plus rapide pour les alcènes terminaux que pour les alcènes internes. k 1 >> k 2 Cette sélectivité est expliquée par des phénomènes d'encombrement stérique. Master 1 CV et CMSM chimie organométallique 22

Hydrogénation des oléfines • Autres catalyseurs : • Catalyseur de Schrock / Osborn • [(PR 3)2 Rh. S 2]+ S = solvant Espèce cationique dérivée des catalyseurs de Wilkinson Plus actifs que ceux-ci, les mécanismes différent légèrement. Très importants pour la catalyse asymétrique Master 1 CV et CMSM chimie organométallique 23

Hydrogénation des oléfines • Hydrogénation par transfert de protons entre une cétone et un alcool secondaire, catalyseur de Noyori (2000) Master 1 CV et CMSM chimie organométallique 24

Hydrogénation des oléfines Ligand amino et amido LX Ru(L 3)(X)(LX) = Ru. L 4 X 2 18 e- Ligand bisamido X 2 Ru(L 3)(X 2) 16 e. Master 1 CV et CMSM chimie organométallique 25

Hydrogénation des oléfines Master 1 CV et CMSM chimie organométallique 26

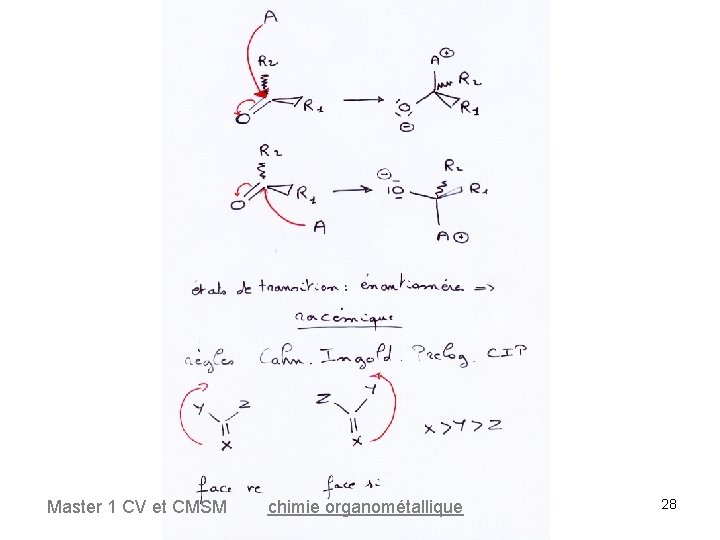
Hydrogénation asymétrique des oléfines Hydrogénation asymétrique Les molécules trigonales (pe oléfines) prochirales ont deux faces énantiotopiques. Lorsqu'un agent achiral attaque une des faces, on obtient un énantiomère. Master 1 CV et CMSM chimie organométallique 27

Master 1 CV et CMSM chimie organométallique 28

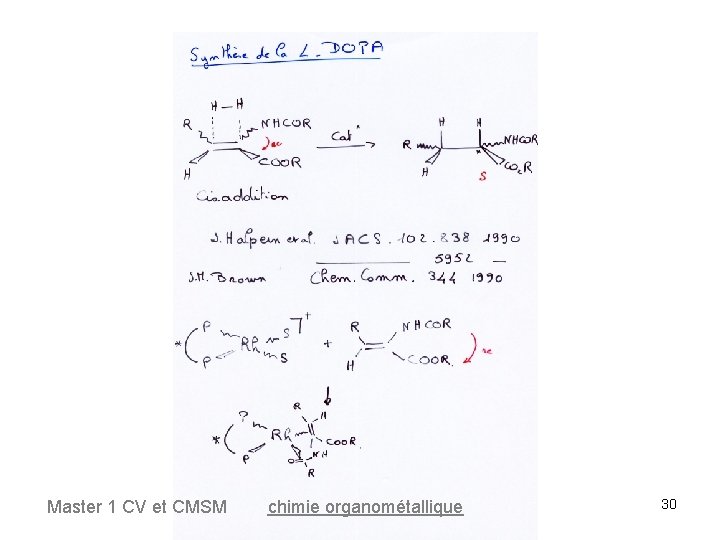
Master 1 CV et CMSM chimie organométallique 29

Master 1 CV et CMSM chimie organométallique 30

Hydrogénation asymétrique des oléfines • Si l'agent A est chiral, les faces sont dites diastéréotopiques. Ont obtient des diatéréomères. Master 1 CV et CMSM chimie organométallique 31

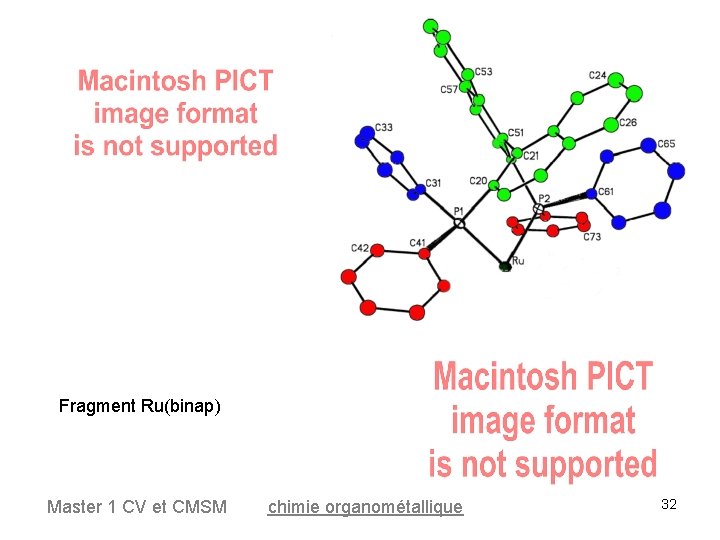
Fragment Ru(binap) Master 1 CV et CMSM chimie organométallique 32

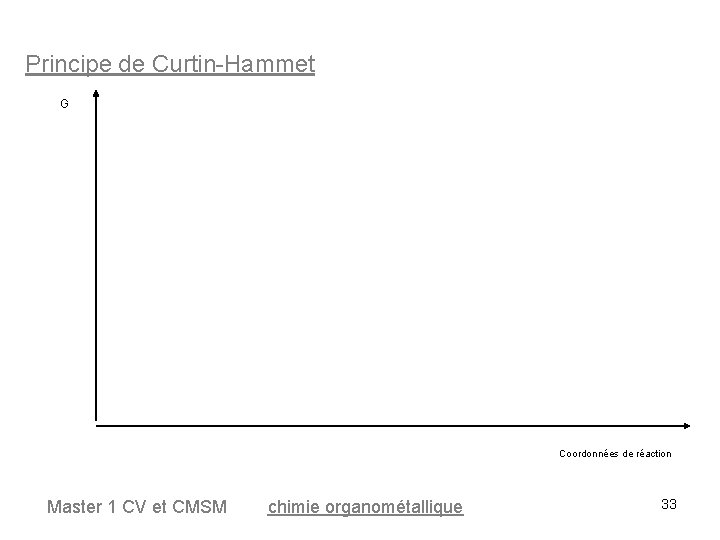
Principe de Curtin-Hammet G Coordonnées de réaction Master 1 CV et CMSM chimie organométallique 33

Master 1 CV et CMSM chimie organométallique 34

Voir le schéma Master 1 CV et CMSM chimie organométallique 35

Hydrogénation asymétrique des oléfines G Coordonnées de réaction Master 1 CV et CMSM chimie organométallique 36

Master 1 CV et CMSM chimie organométallique 37
 Catalyseur de wilkinson
Catalyseur de wilkinson Olfines
Olfines Des des des
Des des des Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Hectolitr
Hectolitr Robin des bois des alpes
Robin des bois des alpes Les valeurs des modes et des temps
Les valeurs des modes et des temps Mesure de niveaux pour liquides et solides
Mesure de niveaux pour liquides et solides Triple des meet in the middle attack
Triple des meet in the middle attack Plan marshall affiche
Plan marshall affiche Cartographie des flux
Cartographie des flux La diffusion des idées des lumières
La diffusion des idées des lumières Budget des ventes
Budget des ventes Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Aes des
Aes des Répartition bimodale des altitudes
Répartition bimodale des altitudes Hippopotomonstrosesquippedaliophobie larousse
Hippopotomonstrosesquippedaliophobie larousse Des s-box
Des s-box Les chansons des roses
Les chansons des roses Methode de valorisation des stock
Methode de valorisation des stock Lieferverzug schreiben
Lieferverzug schreiben Cotation des risques
Cotation des risques Cifrado por bloques
Cifrado por bloques Historique de la gestion des ressources humaines
Historique de la gestion des ressources humaines Diagramme des exigences technologie college
Diagramme des exigences technologie college Zusammensetzung des universums
Zusammensetzung des universums Representation d'etat des systemes lineaire
Representation d'etat des systemes lineaire Des conseils pour la vie
Des conseils pour la vie Kg hg dg g dg cg mg
Kg hg dg g dg cg mg Déplasmolyse spontanée
Déplasmolyse spontanée Methode des internen zinsfußes
Methode des internen zinsfußes Politique rh cours
Politique rh cours Azéotrope
Azéotrope Enlèvement des sabines rubens
Enlèvement des sabines rubens Emulsification des graisses
Emulsification des graisses Gefahren des elektrischen stroms präsentation
Gefahren des elektrischen stroms präsentation Erste missionsreise des paulus
Erste missionsreise des paulus